汞是一种毒性极强的重金属元素,具有很强的生物富集性.含汞废水是对环境污染最为严重的工业废水之一,主要来源于PVC合成、氯碱工业、电子工业、混汞炼金以及汞矿开采等生产过程.含汞废水直接排入水体后,在物理、化学以及生物作用下会形成各种形态的汞化合物,甚至转化成毒性更强的甲基汞.含汞废水的处理方法主要有化学沉淀法、金属还原法、吸附法、离子交换法、电解法、微生物法等.但这些方法都存在一定局限性.化学沉淀法会产生含汞污泥,处置费用高;离子交换法不仅运行资本高,而且目前适用于处理重金属离子的树脂种类并不多.电解法不仅耗电大,投资高,并且在处理过程中容易形成汞蒸气,造成二次污染.吸附法由于操作简单,成本低,去除效果好,吸附剂来源多而被广泛使用.常规吸附剂有活性炭、沸石、二氧化硅、离子交换树脂等,但传统吸附剂往往存在吸附效率低、吸附容量小、选择性不高并且难以再回收利用等问题,因此,研究高效环保价廉的吸附材料成为治理含汞废水的一大热点.
膨润土是由两层硅氧四面体夹一层铝氧八面体组成的天然层状硅酸盐黏土矿物,具有较大的比表面积和良好的吸附性能,且存储量大,价格低廉,但是天然膨润土直接用于处理污水的效果并不理想.近年来研究发现,通过活化改性能改善膨润土的吸附性能,提高去除水体中有机污染物和重金属离子的能力.纳米TiO2不仅吸附性强,且性能稳定,毒性小,可有利于汞的安全回收,因而成为处理含汞废水中最有发展前景的吸附材料之一,受到广泛关注.但在溶液体系中纳米TiO2通常存在易聚集、难回收等问题,所以选择合适的载体是将纳米TiO2工业应用的关键.膨润土可作为一种较好的载体. TiO2与膨润土的复合不仅可固载TiO2,而且TiO2/膨润土复合材料具有较大的比表面积和孔体积,对污染物具有较好的吸附性能.近年来,TiO2/膨润土复合材料开始应用于污水处理及环境修复.毛树红等以膨润土和TiCl4为原料制备TiO2/膨润土复合材料,研究其对甲基橙的吸附性能,结果显示,经过钛改性后的膨润土吸附速率都显著增大,可快速达到吸附饱和量.刘剑锋研究发现,钛柱撑蒙脱土经过压力溶弹处理后,Ti元素有效替换了Al元素并形成柱撑结构,在紫外光作用下可以有效地去除水体中的无机砷. Gaffour等[18]在超声波条件下合成了掺Fe2O3的TiO2柱撑膨润土,发现在紫外光照射下可以有效降解98%以上的对硝基苯酚.
近年来,TiO2/膨润土复合材料多用于污染物的光催化降解及Cr、As、有机污染物等的吸附,关于水中Hg2+的吸附研究鲜有报道,因此本研究通过室内模拟实验,探究TiO2/膨润土复合材料对Hg2+的吸附去除特征,并确定吸附去除Hg2+的最佳条件,以期为TiO2/膨润土复合材料的实际工业应用提供科学理论依据.
1 材料与方法1.1 实验材料
实验材料包括纳米TiO2(锐钛矿相,平均粒径100 nm),钙基膨润土.其中,纳米TiO2颗粒购自杭州万景新纳米科技有限公司,膨润土购自巩义市龙鑫净水材料有限公司.其他试剂,丙三醇、NaOH、HCl、SnCl2、HClO4、NaCl、HNO3均为分析纯,实验用水为超纯水.
TiO2/膨润土复合材料(T/P复合材料):将钙基膨润土加水浸泡制浆,过孔径为2 mm的筛,经干燥粉碎过100目筛,制成粉末,然后按TiO2与膨润土质量比例为1:1,取一定量TiO2和膨润土置于烧杯中,加入50 mL丙三醇(甘油)作为融合剂,然后在300℃下油浴2 h,每间隔0.5 h搅匀一次,油浴后静置,倒出上清液,再用超纯水洗净,干燥后研磨过100目.
模拟含汞废水配制:称取1.35 g氯化汞,溶于水后移入1 L容量瓶中并定容至刻度,配制成浓度为1 000 mg·L-1 HgCl2水溶液.其他浓度含汞废水由该溶液稀释得到[19].
1.2 实验方法1.2.1 吸附材料表征
观察改性前后膨润土结构特征的变化.采用扫描电镜(SEM,JSM-6610)观察样品的表面形貌和颗粒大小;采用日本岛津XRD-7000型X射线衍射仪(Cu Kα射线,40 kV,30 mA)分析样品的晶型结构.
1.2.2 单因素吸附实验
选择添加量、pH、吸附时间、初始Hg2+浓度这4种因素,以单一膨润土做对比,逐步研究这4种因素对T/P复合材料吸附Hg2+的影响.
(1) 添加量
在50 mL 15 mg·L-1的模拟含汞废水中,分别投加不同量的T/P复合材料和膨润土,调节溶液pH为6.0,置于磁力搅拌器上进行吸附,在220 r·min-1下T/P复合材料、膨润土分别经12 h、2 h吸附达平衡后,取少量样液测定平衡溶液中Hg2+浓度.
(2) pH
在各自最优添加量下,用0.01 mol·L-1盐酸和0.01 mol·L-1氢氧化钠将15 mg·L-1模拟含汞废水分别调节至不同的pH,吸附后各取少量样液测定平衡溶液中Hg2+浓度.
(3) 吸附时间
在各自最优添加量、pH条件下,分别在不同的时间段下进行实验,吸附后各取少量样液测定平衡溶液中Hg2+浓度.
(4) 初始Hg2+浓度
在各自最优添加量、pH条件及吸附时间下,分别加入不同浓度的模拟含汞废水进行实验,吸附后各取少量样液测定平衡溶液中Hg2+浓度.
1.2.3 最优条件选择
在单因素实验的基础上,进一步筛选优化,选择4个因素3个水平进行正交试验,确定T/P复合材料吸附Hg2+的最优条件. 4个因素分别是:T/P复合材料添加量w(A),g·L-1;溶液pH (B);溶液初始Hg2+浓度c(C),mg·L-1;吸附时间t(D),min.
1.2.4 解吸实验
在实际工业应用中,吸附剂的回收再利用是评价吸附剂性能的一个重要指标.为了进一步了解T/P复合材料吸附Hg2+后的回收情况,在最优吸附条件的基础上进行解吸实验.待吸附饱和后,取1 mL上清液测定Hg2+浓度,然后弃去上清液,再分别加入50 mL 0.01 mol·L-1 NaCl、1% HClO4和HNO3作为解吸剂,在磁力搅拌器上进行解吸.解吸2 h后,各取1 mL样液测定Hg2+浓度,计算解吸率与解吸量,并比较得出最佳解吸剂.
1.2.5 测定方法及质量控制
Hg2+浓度用F732-V冷原子吸收测汞仪(上海华光仪器仪表厂)测定,检出限为0.05 μg·L-1.吸附平衡后,取少量样液过0.22 μm尼龙膜,然后取过滤后的样液1 mL,稀释定容至10 mL.加入2 mL质量分数为30%的SnCl2,在调好标准工作曲线的F732-V测汞仪上测定Hg2+浓度. pH用溶液pHS-3C+酸度计测定.实验过程中用平行实验和空白实验对数据进行质量控制.平行样间分析的相对标准偏差均小于2%,实验空白均低于检测限.数据处理与图形制作分别使用Excel 2013和Origin 8.0.
1.3 计算方法
层间距根据Bragg方程计算:
式中,λ为入射特征射线波长,θ为衍射角,d为晶面间距.
吸附量及吸附率:
式中,q为吸附量,mg·g-1;c0为初始Hg2+溶液浓度,mg·L-1;ce为Hg2+的平衡浓度,mg·L-1;V为废水体积,L;m为吸附剂质量,g;R为吸附率,%.
解吸量及解吸率:
式中,Q为解吸量,mg·g-1;ce为解吸后测出的溶液中Hg2+溶液浓度,mg·L-1;V为废水体积,L;m为吸附剂质量,g;R′为解吸率,%;q为吸附量,mg·g-1.
2 结果与讨论2.1 吸附材料表征
膨润土改性前后的SEM图如图 1、图 2所示.由图 1可知,改性前,钙基膨润土呈层状结构,经过TiO2复合改性,如图 2所示,可以很明显地看出,T/P复合材料颗粒整体变小,颗粒分布比较均匀,这与刘涛[20]、汤育才[21]观察到的结果类似.这可能是由于TiO2进入蒙脱石层间结构,破坏了蒙脱石原有的层状结构,导致其剥落成更细小的颗粒.此外,膨润土颗粒变小,比表面积也随之增大,有助于提高其吸附性能.

图 1 膨润土SEM照片

图 2 T/P复合材料SEM照片
由图 3可知,经过TiO2复合改性后,膨润土的d(001)衍射角向小方向偏移,由原来的5.8°变成5.4°.经过计算,钙基膨润土的层间距为1.522 nm,改性后,T/P复合材料层间距增大为1.635 nm.改性后,图 3(b)中在25.4°、37.8°、48°、55°均出现了锐钛矿TiO2的特征衍射峰,说明TiO2在膨润土层间呈平行有序分布,结晶度较好.部分膨润土的特征衍射峰在改性后消失,可能是由于TiO2进入膨润土层间,形成复合结构,导致膨润土结构发生变化.由此可见,TiO2已进入膨润土层间域,在层间垂直于晶层排列,并形成柱撑缔合结构,把片层撑开为较大的空间,形成具有开口的二维孔道.这与SEM分析结果一致.

图 3 膨润土和T/P复合材料的XRD谱图
2.2 单因素吸附实验
吸附含汞废水时,不同添加量、pH、吸附时间及初始Hg2+浓度都会对Hg2+的吸附率产生一定影响,结果如图 4所示.从中可知,在不同的单因素吸附实验中,T/P复合材料对Hg2+的吸附率均远远大于单一膨润土,由此可见,经过TiO2改性后的膨润土吸附性能大大提高,对Hg2+的吸附率可达到98%以上.

(c1)和(c2)为吸附时间对T/P复合材料和膨润土吸附Fg2+的影响
图 4 各因素对TiO2/膨润土复合材料吸附Hg2+的影响
由图 4(a)可知,在一定范围内,T/P复合材料与膨润土对Hg2+的吸附率均随着添加量的逐渐增加而不断上升. T/P复合材料在添加量低于1.5 g·L-1前,吸附率呈不断上升的趋势,随后吸附逐渐趋于平衡,最大吸附率达到98.0%.而膨润土在添加量为15 g·L-1时吸附率达到最大,为41.0%.随着添加量的不断增大,为Hg2+提供的吸附点位也随之增多,因此吸附率随之增大.而当添加量增加到一定程度,对溶液中的Hg2+来说吸附点位达到饱和,吸附逐渐达到平衡,吸附率也将随之趋于稳定.相对于单一膨润土来说,一方面,经过TiO2改性,T/P复合材料层间距增大,比表面积也增大,有助于提高吸附能力.另一方面,研究表明纳米TiO2对Hg2+具有很强的吸附能力,使用TiO2对膨润土进行改性,能提供更多的吸附点位,提高T/P复合材料对Hg2+的吸附性能.
由图 4(b)可知,T/P复合材料和膨润土对Hg2+的吸附率受pH的影响非常大. T/P复合材料在pH 3.0~7.0变化范围内吸附率从9%逐渐上升到99.0%,增幅90%,之后趋于平衡,并且在pH为7.0时吸附率达到99.0%.膨润土在pH 2.0~10.0变化范围吸附率不断增大,吸附率从19.9%逐渐增加到46.8%.有研究表明,酸性条件不利于膨润土吸附重金属离子,而近中性和偏碱性的环境则有利于吸附.这是由于在pH较低的酸性条件下,溶液中存在大量游离的H+,部分H+会通过占据蒙脱石上的吸附位点来与金属离子产生竞争吸附;而当pH > 7时,蒙脱石的晶体端面由于附着了溶液中大量的OH-而带负电荷,因此有利于金属阳离子通过端面负电荷而被吸附.另外,对T/P复合材料来说,有研究发现,pH的变化会引起TiO2表面电荷、导带电子、汞化合物形态也产生变化.在碱性条件下,Ti-OH是TiO2表面的主要形态,可与Hg (OH)2发生络合反应,因此,相比于酸性条件,在初始pH为7.0和8.0时T/P复合材料能达到更高的吸附率,这也与周雄等[25]研究pH对纳米TiO2吸附Hg2+的结果类似.
由图 4(c1)和4(c2)可知,相对于T/P复合材料,膨润土在较短时间内就能达到吸附平衡,在240 min时吸附率为46.7%. T/P复合材料在前120 min内吸附速率较快,此后逐渐趋于平衡,在1 440 min吸附率达到99.2%.随着吸附反应的持续进行,越来越多的Hg2+被吸附,因此吸附率逐渐增大.而当吸附点位达到饱和,吸附反应逐渐达到平衡,吸附率也随之趋于稳定.由图 4(d)可知,T/P复合材料与膨润土对Hg2+的吸附率均随着初始Hg2+浓度的增大而逐渐减小.在初始Hg2+浓度为5~100 mg·L-1的变化过程中,吸附率从99.9%下降到了49.5%,而膨润土在初始Hg2+浓度为2~100 mg·L-1的变化过程中,吸附率从58.7%下降到了13.1%.在添加量不变的情况下,初始Hg2+浓度越大,对溶液中Hg2+来说,提供的吸附点位就相对越少,因此吸附率逐渐降低.
2.3 吸附动力学
为了研究T/P复合材料对Hg2+的吸附过程,采用准一级动力学方程、假二级动力学方程、Elovich动力学方程和颗粒内扩散模型来拟合吸附过程,分析它们的动力学参数并进行对比,得到吸附速率控制步骤和吸附机制.
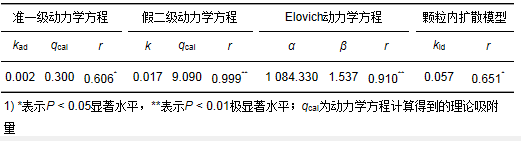
由图 5及表 1可知,假二级反应动力学方程的拟合度远远高于准一级动力学方程,并且计算得到的理论值qcal(9.090)更接近于实验值(9.070),而准一级动力学方程计算得出的理论值误差较大.这是因为准一级吸附模型一般只适合对吸附初始阶段的动力学进行描述,在吸附初期才具有较好的拟合效果,而假二级动力学模型是建立在整个吸附平衡时间范围内,涉及所有的吸附过程,包括外部液膜扩散、表面吸附和颗粒内扩散等,因此能更好地解释吸附机制.本实验数据的拟合结果说明T/P复合材料对Hg2+的吸附动力学过程更适合用假二级动力学方程描述,吸附过程以化学吸附为主.

图 5 TiO2/膨润土复合材料吸附Hg2+的动力学模型拟合
表 1 吸附动力学拟合参数
从Elovich模型的拟合结果可以看出,拟合效果较好,相关系数达到0.910(P < 0.01),验证了化学吸附速率是Hg2+吸附控制步骤的结论.而从颗粒内扩散模型可以看出,拟合曲线没有经过原点,由此表明内扩散并不是控制吸附过程的唯一步骤.总的来看,颗粒内扩散模型对实验数据拟合的效果要好于准一级动力学模型,这说明内扩散对吸附过程的控制作用比外部传质明显.
2.4 等温吸附曲线
吸附等温线揭示了在吸附平衡时,吸附质在液相和吸附剂内的分布情况.吸附等温线可以反映吸附剂的吸附能力.为了更好地描述T/P复合材料对Hg2+的吸附性能,分别用Langmuir和Freundlich模型来拟合吸附过程.两个吸附等温方程的拟合结果见表 2.
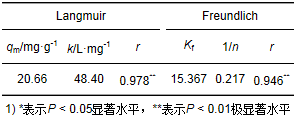
表 2 Langmuir和Freundlich等温方程参数
由表 2中的相关系数可以看出,T/P复合材料对Hg2+的吸附均符合Langmuir和Freundlich等温吸附方程,但Langmuir方程的拟合更为显著,说明其吸附是单分子层吸附,由拟合计算得出最大吸附量qm为20.66 mg·g-1.
2.5 最优条件选择
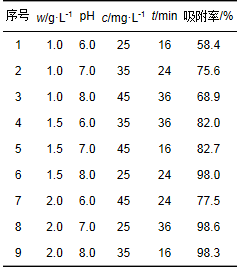
正交试验结果见表 3,试验结果分析见表 4.
表 3 正交试验设计及结果
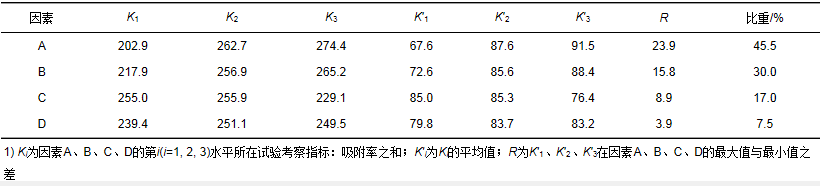
表 4 正交试验结果分析
在正交试验中,通过计算各因素的极差可以确定不同因素的改变对试验结果的影响大小.极差越大,该因素对试验结果的影响也就越大.用极差法对实验结果进行分析,由表 4中R大小可排出影响T/P复合材料吸附Hg2+的各因素强弱顺序为:添加量 > 溶液pH > 初始Hg2+浓度 > 吸附时间.由正交试验相关计算及单因素实验确定最佳实验方案为T/P复合材料添加量为2.0 g·L-1,pH为8.0,初始Hg2+浓度为45 mg·L-1,吸附时间为16 h.在此试验条件下,T/P复合材料对Hg2+的去除率为99.9%,平衡浓度为0.034 mg·L-1.与100 nm TiO2吸附Hg2+的最佳试验条件相比较,T/P复合材料除了吸附时间较长外,两种吸附材料最终的吸附平衡浓度相近,但T/P复合材料成本远低于单一纳米TiO2,由此可见,T/P复合材料在实际应用中的经济可行性更强,更适合作为治理含汞废水的吸附材料.
2.6 T/P复合材料对Hg2+的解吸附
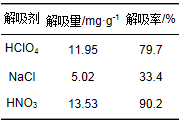
3种解吸剂对T/P复合材料吸附Hg2+后的解吸结果如表 5所示.从中可以看出,HNO3的解吸效果最好,解吸率达到90.4%,解吸量为13.53 mg·g-1.因此,T/P复合材料吸附Hg2+后可用HNO3进行解吸再回收利用.其他治理含汞废水的方法普遍存在二次污染、成本高和处理效果不理想等问题,而T/P复合材料用于吸附Hg2+不仅操作简单,处理效果好,而且成本低,吸附剂可重新回收利用,具有较大的工业应用前景.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
表 5 解吸实验结果
3 结论
(1) 通过将改性前后的膨润土进行表征发现,改性后的膨润土颗粒变小,层间距增大,已形成柱撑缔合结构.
(2) 通过单因素实验研究发现,相比于原始膨润土,T/P复合材料对Hg2+的吸附性能明显提高.其吸附率随着添加量、pH、吸附时间的增大而增大,随初始Hg2+浓度的增大而减小.
(3) T/P复合材料对Hg2+的吸附过程符合假二级动力学方程和Elovich动力学方程,说明吸附过程是由多因素控制的,整个吸附过程中最重要的限速过程是化学吸附. T/P复合材料对Hg2+的吸附符合Langmuir和Freundlich等温方程,但Langmuir方程拟合更显著,说明T/P复合材料对Hg2+的吸附是典型的单分子层吸附,最大吸附率为99.9%,吸附量为20.66 mg·g-1.