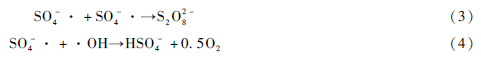近年来,合成染料在各行业中的应用日益增加,导致染料废水的处理量大量增多,其在染料使用中应用最多,所占比例占达70% 以上 。然而,由于偶氮染料的难生物降解性与化学稳定性,使其难以采用传统的物化法或生化法进行处理。因此,近年来采用新型手段有效处理偶氮染料废水的研究得到越来越多的关注。高级氧化技术中的Fenton 氧化法由于其反应的无选择性、处理效率较高、无二次污染等特点,逐渐成为深度处理包括染料废水在内的各种难降解有机废水的主要方法之一。
传统的Fenton 体系通过利用铁的氧化还原循环活化H2 O2 产生高活性的羟基自由基(·OH)从而达到对污染物降解的目的。由于SO4- ·的氧化性与·OH 相当,近年来开始在降解有机污染物方面的应用引起关注。过硫酸盐(persulfate,PS)的氧化还原电势(E0 = 2. 01 V) 高于H2 O2 (E0 = 1. 76 V) ,是水溶液中最强的氧化剂之一。同时,过硫酸盐和亚硫酸盐在室温下呈固体状态,方便储存和输送,还具有稳定性和水溶性,且价格较低廉 的特点,使其在污染物的降解和矿化的应用中具有广阔的前景。
乙二胺二琥珀酸(ethylenediamine disuccinic acid,EDDS)是一种天然的氨基多羧酸,为EDTA 的同分异构体,由于其良好的生物降解性且毒性小,被作为环境友好型螯合剂替代EDTA 用于环境修复中。同时,EDDS 与Fe(Ⅲ) 形成的Fe(Ⅲ)-EDDS 配合物也具有一定的生物降解能力,不易引起二次污染。HAN 等 研究发现,EDDS 能降低过硫酸盐与Fe(Ⅱ)的反应速率,使橙黄G 的降解效果得到提升。因此,本研究将EDDS 用于基于硫酸根类自由基的光-Fenton 体系中。
橙黄Ⅱ是一种化工染料,被用于羊毛织品、蚕丝、纸张、皮革等的染色,也可用作化学指示剂、生物着色剂使用。本研究选取橙黄Ⅱ作为典型偶氮染料的模拟污染物,分别进行了Fe( Ⅲ)-EDDS 配合物与亚硫酸钠和过硫酸钠协同光降解模拟橙黄Ⅱ的印染废水的研究,分析了2 个体系中适宜的Na2 SO3 /NaS2 O8 投加量、Fe(Ⅲ)-EDDS 投加量以及初始pH 值,根据降解率获得最佳的工艺条件,初步探讨体系的降解机制,为含有偶氮染料的有机废水的处理提供依据,也为硫代光-Fenton 体系的进一步推广应用提供依据。
1 实验部分
1. 1 实验试剂与仪器
试剂:硫酸(分析纯);硫酸铁(分析纯);橙黄Ⅱ(分析纯);无水亚硫酸钠(分析纯);过硫酸钠(分析纯);(N,N)-二琥珀酸三钠盐溶液(分析纯);氢氧化钠(分析纯)。
仪器:801 型磁力搅拌器(上海三信仪表厂);JJ500 精密电子天平(巩义市予花仪器有限责任公司);722 N 型722 光栅分光光度计(上海精密科学仪器有限公司);STARTER2100 精密pH 计(上海奥豪斯仪器有限公司);TLD15 W /05 自制耐热光反应器。
1. 2 实验方法
分别配制Fe( Ⅲ)-EDDS 浓度为20 mmol· L - 1 ,Na2 SO3 浓度为200 mmol· L - 1 ,Na2 S2 O8 浓度为100 mmol·L - 1 ,橙黄Ⅱ浓度为1 000 mg·L - 1 的储备液,取确定体积橙黄Ⅱ溶液置于反应器(1 L 大烧杯)中,加入一定量的Fe(Ⅲ)-EDDS 配合物储备液,稀释至接近1 L,调节pH 值至设定值,待其充分混合溶解后分别迅速加入设定量的亚硫酸钠溶液与过硫酸钠溶液,置于自制的紫外光催化反应器(λ = 350 nm)中照射并开始计时,每间隔一定时间用移液管取出一定量水样进行吸光度测定。
吸光度采用分光光度计测定,去除率计算公式为:
式中:η 为去除率;A0 为反应前的吸光度值;A 为反应后的吸光度值。
通过研究Fe(Ⅲ)-EDDS 配合物在光-Fenton 中对橙黄Ⅱ的降解脱色情况,分析考察亚硫酸钠/ 过硫酸钠的投加量,Fe(Ⅲ)-EDDS 浓度,pH 值等对橙黄Ⅱ的降解影响。
2 结果与分析
2. 1 Fe( Ⅲ) -EDDS 配合物浓度的影响
2. 1. 1 Na2 SO3 -Fe( Ⅲ) -EDDS
在pH = 7. 0,Na2 SO3 的投加量为1 mmol·L - 1 ,橙黄Ⅱ的浓度为10 mg· L - 1 条件下,反应时间为180 min,考察分别投加0. 05、0. 10、0. 25、1. 00 和2. 00 mmol·L - 1 的Fe(Ⅲ)-EDDS 配合物时,对橙黄Ⅱ降解率的影响(如图1 所示)。
由图1 可以看出,不同的Fe(Ⅲ)-EDDS 配合物浓度,总体来说对于橙黄Ⅱ降解率的影响相差不大,当反应达到180 min 时体系的去除效率均为80% 左右。但当反应达120 min 后,浓度较低的Fe( Ⅲ)-EDDS 配合物降解效率略高于浓度较高的配合物。研究表明,Fe(Ⅲ)与EDDS 能够形成稳定的螯合物,光照条件下可以产生·OH 和超氧自由基等活性氧自由基。基于此,上述现象是由于较高浓度的配合物导致EDDS 和橙黄Ⅱ对于羟基自由基存在竞争反应(kEDDS,·OH = 2. 0 × 108 M-1 S-1 ) ,更高浓度的配合物将有可能使得其对橙黄Ⅱ的降解效率下降。出于综合经济性考虑,选取最小的浓度0. 05 mmol·L - 1 作为工艺最适浓度,来进行接下来的Na2 SO3 投加量和pH 的确定。
2. 1. 2 Na2 S2 O8 -Fe( Ⅲ) -EDDS
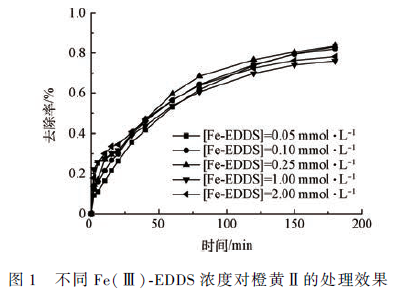
在pH = 7. 0,Na2 S2 O8 投加量为10 mmol·L - 1 ,橙黄Ⅱ的浓度为10 mg·L - 1 条件下,反应时间为180min,分别考察投加0. 10、0. 50、1. 00、1. 25、1. 50 和2. 00 mmol·L - 1 的Fe(Ⅲ)-EDDS 配合物时,对橙黄Ⅱ降解率的影响(如图2 所示)。
由图2 可以看出,适当增加Fe(Ⅲ)-EDDS 配合物的浓度可提高橙黄Ⅱ的降解率,而过量投加,则对橙黄Ⅱ 的降解产生抑制作用。不同于Na2 SO3 -Fe(Ⅲ)-EDDS 体系,该体系中配合物的影响更为显著。由图2 可知,当Fe( Ⅲ)-EDDS 配合物浓度由0. 10 mmol·L - 1 提升至1. 00 mmol·L - 1 时,反应效率随之升高;但当Fe(Ⅲ)-EDDS 配合物浓度由1. 00mmol·L - 1 提升至2. 00 mmol·L - 1 时,反应效率反而随之降低。反应中Fe(Ⅲ)-EDDS 配合物起活化作用,使过硫酸离子快速氧化为具有强氧化能力的硫酸根自由基。LIANG 等认为,过硫酸盐-Fe(Ⅲ)-EDTA体系中产生的·OH 和SO4- ·自由基,能与EDTA 反应生成有机自由基中间体(R·),将Fe(Ⅲ)还原形成Fe(Ⅱ),Fe(Ⅱ)与过硫酸盐反应产生硫酸根自由基。
EDDS 作为EDTA 的同分异构体,在体系中起相似的作用。由此,在过硫酸盐-Fe(Ⅲ) 体系中加入EDDS 能促进Fe(Ⅲ)-Fe(Ⅱ)间的循环,通过产生的Fe(Ⅱ)持续活化过硫酸盐产生活性氧自由基,从而有效降解橙黄Ⅱ。在反应中Fe(Ⅲ)-EDDS 配合物浓度存在一个最适浓度,低于该浓度,反应会由于催化剂量不足而使活化分子减少,反应减缓;而高于该浓度,配体与底物之间的竞争作用则会带来抑制。0. 50mmol·L - 1 与1. 00 mmol·L - 1 的Fe(Ⅲ)-EDDS 配合物对橙黄Ⅱ降解率的影响相差不大,出于综合经济性考虑,选取较小的0. 50 mmol·L - 1 的浓度作为最适浓度。
2. 2 氧化剂投加量的影响
2. 2. 1 Na2 SO3 -Fe( Ⅲ) -EDDS
在pH = 7. 0,Fe ( Ⅲ)-EDDS 的投加量为0. 05mmol·L - 1 ,橙黄Ⅱ的浓度为10 mg·L - 1 的条件下,反应时间为180 min,考察分别投加1、2、3、5 和7mmol·L - 1 浓度的Na2 SO3 时,对橙黄Ⅱ降解率的影响(如图3 所示)。
由图3 可知,随着Na2 SO3 浓度的增加,橙黄Ⅱ的去除率逐渐增大。且随着反应时间的增加橙黄Ⅱ的降解率并没有大幅度增加,体系的反应速率非常迅速,反应110 min 左右,体系的去除率基本接近平稳,说明体系的反应基本达到饱和状态。作为降解目标污染物的氧化剂,亚硫酸钠的浓度越大,经活化后产生的自由基就越多。随着亚硫酸钠浓度的增大,去除效率增大,但是当亚硫酸钠浓度达到一定值后,继续的增加对体系去除效率的影响逐渐减小。出于综合经济性考虑,选取浓度为5 mmol·L - 1 的Na2 SO3 ,用以pH 为变量的实验中。

2. 2. 2 Na2 S2 O8 -Fe( Ⅲ) -EDDS
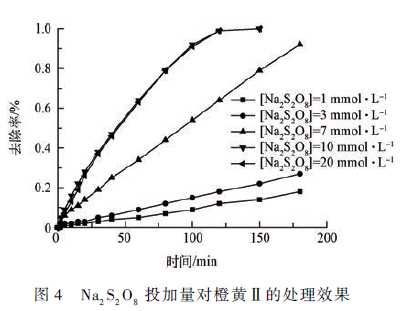
在pH = 7. 0, Fe ( Ⅲ )-EDDS 投加量为0. 50mmol·L - 1 ,橙黄Ⅱ的浓度为10 mg·L - 1 的条件下,反应时间为180 min,考察分别投加1、3、7、10 和20mmol·L - 1 浓度的Na2 S2 O8 时,对橙黄Ⅱ降解率的影响(如图4 所示)。
理论上,作为橙黄Ⅱ的氧化剂,过硫酸钠的浓度越高,经活化后产生的活性自由基越多,处理橙黄Ⅱ的降解效率以及降解程度会随其增加而增加。但由图中可以看出,在初始阶段,随着过硫酸钠浓度的增加橙黄Ⅱ的降解率也随之增加。但当浓度增大到一定程度时,降解率不再有显著改变。由图4 结果可知,当过硫酸钠浓度为1 mmol·L - 1 与3 mmol·L - 1时,橙黄Ⅱ 降解程度较低, 降解率分别为17% 和28% 。而当过硫酸钠浓度增加到10 mmol·L - 1 与20 mmol·L - 1 时,降解率显著增大,降解率均为92% 以上。已有研究表明,提高过硫酸钠的浓度能够增强体系中活性自由基的浓度,但当氧化剂浓度过高时,产生的高浓度SO4- ·与·OH 会由于相互反应而消耗,从而降低自由基活性。
由图4 可知,10 mmol·L - 1 Na2 S2 O8 时体系效率以达到最高,继续增加反应浓度并不能继续提高体系中底物的降解效率,因此,选取浓度为10 mmol·L - 1 的Na2 S2 O8 ,用以pH 为变量的实验中。
2. 3 pH 值的影响
2. 3. 1 Na2 SO3 -Fe( Ⅲ) -EDDS
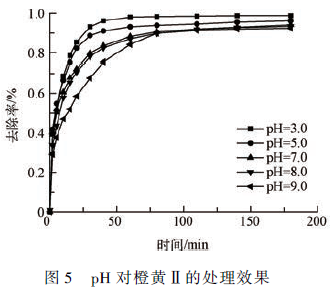
在Fe(Ⅲ)-EDDS 浓度为0. 05 mmol·L - 1 ,Na2 SO3 浓度为5 mmol·L - 1 的条件下,橙黄Ⅱ的浓度为10 mg·L - 1 ,反应时间为180 min,分别考察pH 为3. 0、5. 0、7. 0、8. 0 和9. 0 时,对橙黄Ⅱ降解率的影响(如图5 所示)。
由图5 可知,随着pH 在一定范围内的增大,体系中橙黄Ⅱ的降解率逐渐减小,pH 为3. 0 时反应效率最高。当反应80 min 时,降解率基本趋于稳定。
由此可知,该体系在酸性条件下效率较高。研究表明,碱性条件下,硫酸根自由基会与氢氧根离子发生反应,产生羟基自由基。
从实验结果同样可以看出,在pH = 3. 0 ~ 9. 0 的范围内,该体系对橙黄Ⅱ的降解均可获得较高的降解效率,经过60 min 的反应后所有体系中橙黄Ⅱ的去除率均超过80% ,由此可以认为该体系适用的pH范围较广,也克服了传统Fenton 体系受环境pH 限制使用范围的缺陷。

2. 3. 2 Na2 S2 O8 -Fe( Ⅲ) -EDDS
在Fe ( Ⅲ )-EDDS 浓度为0. 50 mmol · L - 1 ,Na2 S2 O8 浓度为10 mmol·L - 1 ,橙黄Ⅱ的浓度为10mg·L - 1 条件下,反应时间为180 min,分别考察pH为3. 0、5. 0、6. 0、7. 0、9. 0 和11. 0 时,对橙黄Ⅱ降解率的影响(如图6 所示)。
由图6 可知,该体系在中性条件下(pH = 7. 0)时反应效率最高,而在酸性与碱性条件下,体系对橙黄Ⅱ的降解率均降低,尤其在碱性条件下,该体系对于橙黄Ⅱ的处理效果较差。研究发现,在不同以pH 条件下,所发生的反应如下:
1)酸性:
2)碱性条件发生反应如式(5):
3)所有pH 溶液中:
由此可认为,在酸性较强的情况下,体系内大量的存在的氢离子会导致反应的逆反应更易发生,从而抑制硫酸根自由基的产生,导致反应的降解率降低。在碱性的条件下,反应液中硫酸根自由基与氢氧根发生反应,产生更多的羟基自由基,二者会发生反应而消耗,使得降解率降低。由图也可看出碱性条件下体系对橙黄Ⅱ的降解效果最差。因此,过硫酸钠在Fe(Ⅲ)-EDDS 配合物的活化条件下,最适宜的pH 范围为5. 0 ~ 7. 0。
2. 4 不同新型硫代光- Fenton 体系对比
在Na2 SO3 -Fe(Ⅲ)-EDDS 体系中,最优降解条件为[Na2 SO3 ] = 5 mmol·L - 1 ,[Fe(Ⅲ)-EDDS] = 0. 05mmol·L - 1 ,pH = 3. 0。在Na2 S2 O8 体系中,最优降解条件为[Na2 S2 O8 ] = 10 mmol·L - 1 ,[Fe(Ⅲ)-EDDS]=0. 50 mmol·L - 1 ,pH = 7. 0。分别考察这两个体系在最优降解条件下对橙黄Ⅱ降解率的影响(如图7 所示)。
由图7 可知,前50 min 在Na2 SO3 -Fe(Ⅲ)-EDDS体系的降解速率明显高于Na2 S2 O8 -Fe(Ⅲ)-EDDS 体系。在Na2 SO3 -Fe(Ⅲ)-EDDS 体系最优降解条件中,降解率在30 min 内达到98% 。氧化剂Na2 SO3 最佳浓度为5 mmol·L - 1 ,Fe(Ⅲ)-EDDS 为0. 05 mmol·L - 1 均少于Na2 S2 O8 -Fe(Ⅲ)-EDDS 体系中的浓度,节省二者的投加量。体系的pH 适用范围为3. 0 ~ 9. 0,拓宽了pH 的适用范围,但体系中酸性条件下降解效果均高于碱性条件且体系的最优pH 为3. 0。而大部分废水的pH 值均在6. 0 以上,pH 偏碱性,因而在实际废水运用过程中,需添加酸性药剂以调节废水的pH,药剂成本也随之增加,从而增加了处理的成本。
在Na2 S2 O8 -Fe( Ⅲ)-EDDS 体系最优降解条件中,橙黄Ⅱ在120 min 内基本去除,pH 适用范围为5. 0 ~ 7. 0 且最优pH 为7. 0,同样克服了Fenton 法中pH 的限制,其降解效率虽不如Na2 SO3 -Fe(Ⅲ)-EDDS 迅速,但在废水的实际处理中,该体系不需要对其添加药剂以调节pH,所以节约了药剂处理成本。综上所述,在处理实际的染料废水中,出于经济型原则考虑,Na2 SO3 -Fe(Ⅲ)-EDDS 更占优势。2 种体系对于偶氮类染料废水的处理均有较好的效果,在实际的废水处理应用中,应根据实际的目标底物,环境条件,以及成本核算等选择更为适合的体系。
2. 5 新型硫代光- Fenton 体系降解机制初探
EDDS 与铁离子形成的Fe(Ⅲ)-EDDS 配合物可以提高铁离子在水体中的稳定性,并促进铁离子的氧化还原循环,从而激发体系中过氧化氢产生强氧化性的羟基自由基,有效降解水体中的有机污染物。
而本次实验中,利用过硫酸盐和亚硫酸盐取代过氧化氢对橙黄Ⅱ进行降解的研究发现,在我们新构建的体系中,Fe(Ⅲ)-EDDS 配合物中铁离子的氧化还原循环,同样可以持续活化过硫酸盐/ 亚硫酸盐,从而产生活性自由基,有效降解橙黄Ⅱ。而对于光-Fenton 体系中橙黄Ⅱ的降解产物,有研究通过对混合溶液光照前后进行UV-Vis 扫描,得出在反应过程中橙黄Ⅱ分子中的偶氮键(—N =N—)被打断后,将萘环和苯环结构也被一定程度破坏,发生氧化开环,从而将含有萘环等的复杂中间产物氧化降解为低分子有机化合物,接着进一步矿化为CO2 、H2 O 等无机物,使得橙黄Ⅱ得到有效矿化。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
1)实验证明Fe(Ⅲ)-EDDS 活化硫酸盐与过硫酸盐体系均能在一定程度上克服传统Fenton 对pH 的限制,在实际运用中获得较高的降解效率,为进一步的染料废水处理提供技术支撑。
2)使用EDDS 螯合Fe(Ⅲ)活化硫酸盐与过硫酸盐体系,提升了对硫酸类自由基的利用率,降解速率较高且降解彻底。
3)Fe(Ⅲ)-EDDS 活化硫酸盐与过硫酸盐体系能够有效提高对橙黄Ⅱ的去除率,在Na2 SO3 -Fe(Ⅲ)-EDDS 体系中,当[Na2 SO3 ] = 5 mmol·L - 1 ,[Fe(Ⅲ)-EDDS] = 0. 05 mmol·L - 1 ,pH = 3. 0 时,30 min 内橙黄Ⅱ被完全去除。在Na2 S2 O8 -Fe(Ⅲ)-EDDS 体系中,当[Na2 S2 O8 ] = 10 mmol·L - 1 ,[Fe(Ⅲ)-EDDS] =0. 50 mmol·L - 1 ,pH = 7. 0 时,120 min 内橙黄Ⅱ基本被完全去除。
4)两个体系中,Fe(Ⅲ)-EDDS 存在一个最适浓度,低于或高于该浓度,均不利于橙黄Ⅱ降解。在Na2 SO3 -Fe(Ⅲ)-EDDS 体系中提升溶液初始pH,不利于Fe( Ⅲ)-EDDS 活化其对橙黄Ⅱ的去除。而在Na2 S2 O8 -Fe(Ⅲ)-EDDS 体系中,存在最适pH 为7. 0,高于或低于7. 0,均不利于橙黄Ⅱ降解。在Na2 SO3 -Fe(Ⅲ)-EDDS 体系中,[Na2 SO3 ] 越大越有利于橙黄Ⅱ的降解;而对于Na2 S2 O8 -Fe(Ⅲ)-EDDS 体系中,[Na2 S2 O8 ]存在最适浓度10 mmol·L - 1 。
5)在构建的新型硫代光-Fenton 体系中,Fe(Ⅲ)-EDDS 配合物通过促进铁离子的氧化还原循环,持续活化过硫酸盐/ 亚硫酸盐产生活性自由基,使得偶氮发色基团被氧化打开后,将生成的含有萘环等中间产物降解为低分子有机化合物,而后进一步将其矿化为CO2 、H2 O 等无机物,从而达到橙黄Ⅱ有效矿化的目的。