随着经济社会的快速发展,工农业废水中的氮素含量日益增加,含氮物质的超标排放将引起严重的环境问题。因此,对高浓度含氮污水的处理显得尤为迫切。污水中的氮素主要以氨氮和有机氮的形式存在,脱氮是污水处理的一个重要指标,传统的生物脱氮是基于好氧自养硝化作用和厌氧异养反硝化的过程 。然而,这种传统的工艺水力停留时间长、能耗大,且基建费用高,同时,自养菌在高浓度的氨氮和有机废水中难以存活,从而限制其在处理高浓度氨氮废水中的应用。近年来为了克服这些限制因素,人们开发了一些新型的生物脱氮工艺,包括部分亚硝化、好氧反硝化和厌氧性氨氧化等。
早在1983 年,ROBERTSON 等 筛选得到一株具有异养硝化-好氧反硝化能力的菌株Thiosphaera pantotropha。该菌在好氧生长结束后,就会立即迅速地进行反硝化作用。后来多个种属的具有异养硝化-好氧反硝化的细菌被报道,包括粪产碱菌(Alcaligenes faecalis) 、施氏假单胞菌(Pseudomonas stutzeri) 、铜绿假单胞菌( Pseudomonas aeruginosa ) 、土壤杆菌属( Agrobacterium sp. ) 、不动杆菌属( Acinetobactersp. )、克雷伯氏肺炎杆菌(Klebsiella pneumoniae)、芽孢杆菌属(Bacillus sp. ) 、泛养硫球菌(Thiosphaerapantotropha) 等。异养硝化细菌与自养菌相比,具有更高的生长率,并能利用有机物质作为碳源和能源在有氧条件下将氨氮转变为N2 。此外,反硝化过程中产生的碱性可以部分中和由硝化过程产生的酸。因此,同步硝化反硝化可以实现低运营成本和在一个反应器达到高速脱氮的效果。
虽然大量的新型脱氮菌株已经被报道,但是人们对异养硝化-好氧反硝化菌的分子学研究、反应机理及在废水脱氮中的应用研究仍然不够充分。本研究从活性污泥中筛选出1 株异养硝化-好氧反硝化菌,经鉴定为不动杆菌属,通过单因素实验和正交实验对该菌的脱氮性能进行了分析,旨在为脱氮功能菌强化处理高浓度氨氮废水提供理论支持。
1 实验部分
1. 1 培养基
硝化富集培养基:(NH4 )2 SO4 0. 4 g·L - 1 ,柠檬酸钠3. 5 g·L - 1 ,MgSO4 ·7H2 O 1 g·L - 1 ,NaCl 0. 12 g·L - 1 ,MnSO4 ·H2 O 0. 01 g·L - 1 ,FeSO4 ·7H2 O 0. 02 g·L - 1 ,KH2 PO4 0. 25 g·L - 1 ,Na2 HPO4 0. 3 g·L - 1 ,pH 7. 0 ~ 7. 5。固体培养基添加20 g·L - 1 琼脂。
异养硝化培养基: (NH4 )2 SO4 0. 35 g·L - 1 ,柠檬酸钠3. 03 g·L - 1 ,MgSO4 ·7H2 O 1 g·L - 1 ,KH2 PO40. 25 g·L - 1 ,Na2 HPO4 0. 3 g·L - 1 ,pH 7. 0 ~ 7. 5。
反硝化培养基:KNO3 0. 53 g·L - 1 (NaNO2 0. 5),柠檬酸钠3. 0 g·L - 1 ,KH2 PO4 0. 25 g·L - 1 ,Na2 HPO40. 3 g·L - 1 ,MgSO4 ·7H2 O 1 g·L - 1 ,pH 7. 0。
溴百里酚蓝(BTB)培养基:KNO3 1 g·L - 1 ,琥珀酸钠8. 5 g·L - 1 ,MgSO4 ·7H2 O 1 g·L - 1 ,CaCl2 0. 15g·L - 1 , FeSO4 ·7H2 O 0. 05 g·L - 1 ,KH2 PO4 0. 25 g·L - 1 ,Na2 HPO4 0. 3 g·L - 1 ,1% 溴百里酚蓝乙醇溶液1 mL,琼脂20 g·L - 1 。
培养基使用前均需置于灭菌锅中,121 ℃ 灭菌20 min。
1. 2 富集培养及菌株分离
活性污泥取自江苏省常州市某吕业公司污水处理池,取5 mL 污泥悬浮于45 mL 硝化富集培养基,30 ℃ ,200 r·min - 1 摇床富集培养12 h,将富集液进行梯度稀释涂布于硝化富集固体培养基,培养1 d 后,挑取形态大小不一的单菌落,多次划线分离纯化得到10 余株初筛菌株。挑取初筛菌株接种于溴百里酚蓝固体平板,挑取培养基出现蓝色晕圈的菌株,进行异养硝化性能和好氧反硝化性能测定,定量筛选出具有较高异养硝化能力和好氧反硝化能力的菌株。
1. 3 菌株的鉴定
菌株鉴定采用16S rDNA 序列比对法。提取菌株总DNA,利用一对通用引物扩增菌株16S rDNA。上游引物为8f(5′-AGAGTTTGATCCTGGCTCA-3′),下游引物为1 492 r (5′-GGTTACCTTGTTACGACTT-3′)。
基因测序后通过GenBank 进行同源性序列分析,应用MEGA5. 0 软件构建该菌株系统发育树。
1. 4 菌株YN3 的脱氮性能研究
1. 4. 1 单因素实验研究不同培养条件对菌株YN3 异养硝化的影响
利用单因素实验研究碳源、温度、转速、pH、C / N 和氨氮浓度对氨氮去除效果的影响。培养条件为C /N 为10,氨氮浓度为70 mg·L - 1 ,转速为200 r·min - 1 ,pH 为7,碳源选择柠檬酸钠、琥珀酸钠、葡萄糖、乙酸钠和蔗糖,以下实验均按上述要求固定其他因素,只改变研究的单因素条件;温度分别为20、30 和37℃ ;摇床转速分别为100、150、200 和250 r·min - 1 ;pH 分别为5、6、7、8 和9;C / N 分别为5、10、15 和20;初始氨氮浓度分别为50、100、150、200 和250 mg·L - 1 。所有实验一式3 份。将处于对数期的菌液以5%(OD600 = 1)的接种量接种于装有100 mL 异养硝化培养基的500 mL 三角瓶中,恒温培养,测定水样中OD600 、氨氮(NH4+ -N)、硝氮(NO3- -N)、亚硝氮(NO2- -N)、羟氨(NH2 OH-N)和总氮(TN)的质量浓度变化。
1. 4. 2 正交实验优化培养条件
为优化菌株YN3 的脱氮条件,以氨氮为唯一氮源,设计L18 (35 )正交实验,因素水平表见表1。将菌液以相同接种量接种于装有100 mL 异养硝化培养基的500 mL 三角瓶中,以氨氮降解效率为反应值分析得到最优培养条件。初始氨氮的质量浓度为70 mg·L - 1 ,依照不同的碳氮比计算碳源质量。
表1 正交实验因素水平表
1. 4. 3 菌株YN3 的适应性进化实验设计
1)菌株YN3 的适应性进化。配置不同氨氮浓度(70、150、200、250 和300 mg·L - 1 )的硝化培养基,以菌株YN3 作初始育种菌株。以氨氮浓度为70 mg·L - 1 的硝化富集培养基富集培养菌株YN3,置于30 ℃ ,200 r·min - 1 的恒温摇床培养12 h 后,以2% 接种量接入100 mg·L - 1 的硝化富集培养基,12 h 后测量菌株培养液的OD600 ,如果OD600 小于1 乃至更低,则将菌株YN3 再次接种到新鲜的氨氮浓度为100 mg·L - 1的硝化培养基;如果OD600 大于1,则菌株被认为能适应100 mg·L - 1 的氨氮浓度,以氨氮浓度为100 mg·L - 1 的硝化培养基多次传代,直至菌株YN3 稳定适应该浓度后,以2% 接种量接种到氨氮浓度为150 mg·L - 1 的硝化培养基,以如前所述方式培养,直至菌株YN3 适应150 mg·L - 1 的氨氮浓度。转接适应于150 mg·L - 1 的氨氮浓度的菌株于氨氮浓度为200 mg·L - 1 的硝化培养基培养,直至菌株稳定适应后,同样地,转接入250 mg·L - 1 的硝化培养基培养直至稳定适应。重复此步骤,直到菌株适应于300 mg·L - 1的氨氮浓度。
2)氨氮适应性验证。配制不同浓度的氨氮实验废水,初始氨氮浓度分别为100、200、300、500 和1 000 mg·L - 1 。将处于对数期的菌液以5% (OD600 = 1)的接种量接种于装有100 mL 异养硝化培养基的500 mL 三角瓶中,恒温培养,测定水样中OD600 和氮素的质量浓度变化。实验一式3 份。
1. 4. 4 菌株YN3 的异养硝化功能验证
将菌株YN3 接入100 mL 异养硝化培养基中,在优化条件下培养,1 d 后检测培养基中各组分氮的质量浓度变化。
1. 4. 5 菌株YN3 的好氧反硝化能力验证
将菌株YN3 接入反硝化培养基中,分别以硝酸盐和亚硝酸盐为唯一氮源,30 ℃ 、200 r·min - 1 恒温摇床培养,测定样品中各组分氮的质量浓度变化。
1. 5 分析方法
菌体生长状态(OD600 )采用吸光度法测定;NH4+ -N 浓度采用纳氏试剂分光光度法;NO3- -N 浓度采用紫外分光光度法(HZ-HJ-SZ-0138);NO2- -N 浓度采用N-(1-萘基)-乙二胺光度法(GB 7493-87);细胞内氮的含量采用凯氏定氮法(GB 11891-89),绘制菌体密度和含氮量的关系图 ;NH2OH-N 浓度采用间接分光光度法 ;TN 浓度为NH4+ -N、NO3- -N、NO2- -N 和NH2OH-N 浓度之和。
2 结果与讨论
2. 1 菌株的分离及鉴定
通过异养硝化培养基富集培养,获得在异养硝化固体培养基上生长的菌株10 株。将这些菌株通过溴百里酚蓝平板复筛,获得一株菌,命名为YN3。YN3 菌落表面为黄白色,圆形,表面光滑,不透明,革兰氏染色为阴性。
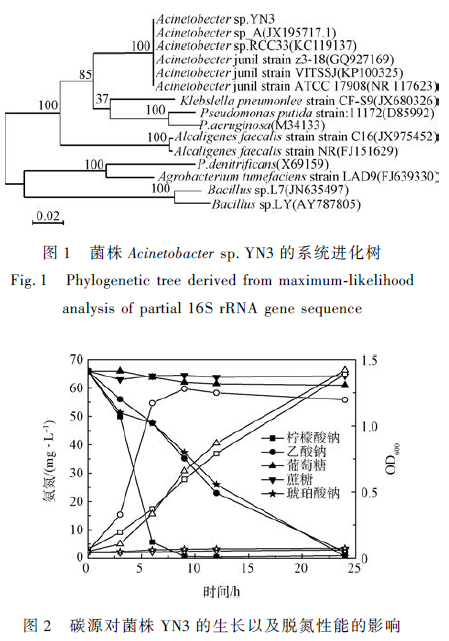
通过BLAST 检索与GenBank 中的核酸序列进行菌株YN3 16S rDNA 序列的同源性比对,该序列与NCBI 数据库的Acinetobacter junii (NCBI 登录号为:KP100 325. 1)同源性达99% ,结合菌株的形态学,确定菌株YN3 属于不动杆菌属(Acinetobacter sp. )。使用MEGA 5. 0 核酸分析软件将菌株YN3 与其他不动杆菌属和一些异养硝化好氧反硝化细菌进行系统发育分析,得到菌株的系统进化树(见图1),由图1 可以看出,菌株YN3 与不动杆菌亲缘关系较近。
2. 2 菌株YN3 异养硝化性能研究
2. 2. 1 碳源对菌株YN3 脱氮性能的影响
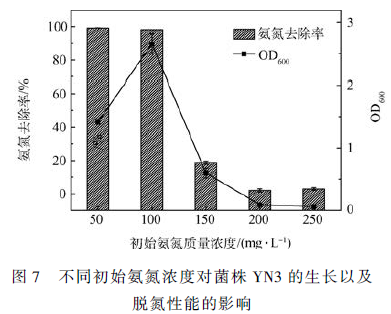
碳源常常作为异养细菌的能量和电子来源。图2 表明,不同的碳源对氨氮的去除以及菌株的增长具有重要的影响。分别以柠檬酸三钠、琥珀酸钠和乙酸钠为碳源时,其最大氨氮去除率分别为99% 、99%和97% ,且OD600 分别达到1. 25,1. 392 和1. 421。而碳源是葡萄糖和蔗糖时,菌株基本没有增长,氨氮含量没有降低,与REN 等 研究结果一致。说明相对于糖类,菌株更容易高效利用有机酸。可能是因为有机酸可以直接参与TCA 循环,而糖类需要先转化为有机酸再被利用。实验结果表明,柠檬酸钠是菌株YN3 的最佳碳源。
2. 2. 2 温度对菌株YN3 脱氮性能的影响
由图3 可以看出,温度对于菌株的生长以及脱氮能力的影响。当温度升高时,菌株的生长量和氨氮去除率增加,30 ℃ 条件下,菌株的生长适应期最短,快速进入对数期,12 h 内氨氮去除率达到99% 。而20 ℃ 和37 ℃ ,经过24 h 其氨氮去除率仅达到59% 和53% 。可能是温度太低或太高的情况下,菌株YN3 中起脱氮作用的相关酶活性降低,导致菌株的脱氮效率降低 。可见菌株YN3 的最适脱氮温度是30 ℃ 。
2. 2. 3 溶氧对菌株YN3 脱氮性能的影响
通过改变摇床的转速来调节培养基中的溶解氧。由图4 可以看出,摇床转速越高,菌株的对数期越短,越快达到最佳氨氮去除效果,200 和250 r·min - 1 条件基本相似,均在6 h 达到最佳去除效果,而低转速100 和150 r·min - 1 下溶氧不足,不利于菌株生长,菌株的对数期长,其达到最佳去除效果需要9 h。原因是当转速较低时,培养基中的溶氧偏低,抑制菌株YN3 的生长。随着摇床转速的提高,培养基中的液体形成涡流,延长了空气的停留时间,加大了空气接触面积,使培养基中的溶解氧提高,满足了菌株YN3 的生长代谢,所以提高了菌株YN3 的氨氮去除效率。当摇床转速过高时,培养基中溶氧过剩,同时在高速运转下,菌液与三角瓶强烈碰撞,造成了菌体YN3 细胞的损伤,抑制了脱氮过程中相关酶的合成能力,所以菌株YN3 对氨氮的去除效率不再提高 。因此,在实际废水处理过程中,要控制适当的溶解氧,以适合微生物的生长,从而提高菌株处理氨氮废水的效率。
2. 2. 4 pH 对菌株YN3 脱氮性能的影响
从图5 可以看出,pH = 6 ~ 9 时,菌株YN3 具有很好的生长及氨氮去除性能,最高的氨氮去除率均达到99% ,而在pH = 5 时,菌株YN3 基本不生长,同时也没有氨氮的去除。结果表明,菌株更适合在弱碱性的环境中生长,强酸性或强碱性环境会抑制菌株YN3 的脱氮效率。其适应的pH 范围与吴建江等 研究的一株高效异养硝化菌Pseudomonas. sp XS76(pH6 ~ 9)大致相同。因为环境中的pH 与菌株YN3 的生长代谢有着密切联系:一方面,pH 是微生物酶活性的重要影响因素之一,pH 过高或过低都会影响酶的带电状态和稳定性,抑制酶活性;另一方面,pH 会改变微生物细胞膜的电位,从而影响微生物对营养物质的吸收;此外,过低的pH 会导致核酸和微生物表面蛋白的水解变质,抑制微生物的生长代谢。因此,菌株YN3在最适pH 下才具有快速生长和高效脱氮的能力。考虑到实际污水处理生化池的pH 一般为6 ~ 7,选择7 ~ 7. 5 作为菌株YN3 的最佳初始pH。
2. 2. 5 C / N 对菌株YN3 脱氮性能的影响
不同的C / N 比对菌株YN3 的氨氮去除性能影响非常显著,C / N 比越高,菌株的生长情况越好,氨氮去除效果越佳。随着C / N 增大,菌株YN3 对氨氮的降解效率越高,在C / N 比大于15 时,在9 h 达到最大降解率99% 以上,相比C / N = 5,氨氮的去除率有了很大程度的提高。当C / N 增大到20 后,降解效率不再提高,这是因为碳源量增加有利于促进菌株YN3 的硝化性能;但碳源量过高时,部分碳源有机物会直接嵌入酶结构而影响酶的活性,抑制硝化反应的进行。实际污水处理池中C / N/ P 一般为100 ∶ 5 ∶ 1,考虑到成本问题,选择C / N = 10 ~ 15 为菌株YN3 的最佳碳氮比。
2. 2. 6 菌株YN3 的氨氮浓度耐受性
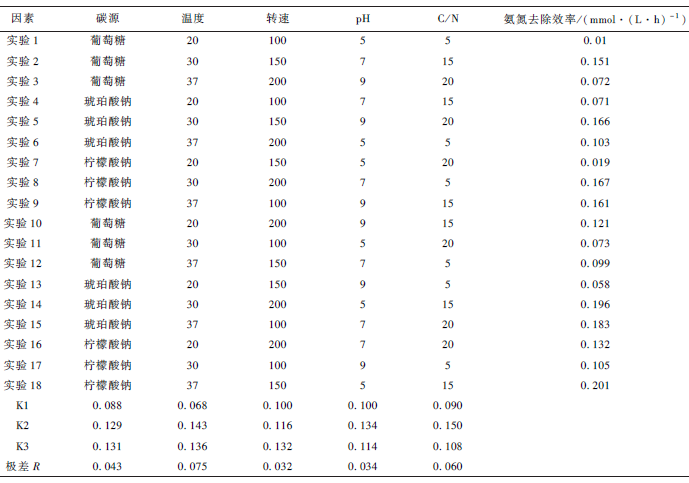
将菌株YN3 接种于不同初始氨氮浓度的培养基中,培养1 d 后测定培养基氨氮浓度,结果如图7 所示。初始氨氮质量浓度分别为50、100、150、200 和250 mg· L - 1 ,氨氮去除率分别为99. 2% 、98. 3% 、18. 7% 、2% 和2. 8% ,其对应的OD600 分别是1. 414、2. 655、0. 6、0. 089 和0. 06,说明菌株生长量与氨氮去除率成正相关。随着初始氨氮浓度的提高, 菌株YN3 对氨氮的去除能力越来越低,这是因为氨氮浓度过高时对菌株产生抑制作用,抑制了菌株的生长代谢以及有效反应。当初始氨氮增加到200 mg·L - 1 ,反应1 d 后,几乎无氨氮降解。说明菌株YN3比较适合初始氨氮浓度在150 mg·L - 1 以内的范围。
2. 3 正交实验优化
L18 (35 )正交实验结果如表2。培养1 d 后,有10 组实验条件下的氨氮去除率达到50% 以上,其中有6组达到90% 以上,分别为99. 85% 、99. 36% 、99. 36% 、97. 06% 、96. 38% 和93. 18% 。其对应的氨氮去除效率分别为0. 201、0. 186、0. 161、0. 196、0. 166 和0. 183 mmol·(L·h) - 1 。结果显示,去除率更高时,去除效率不一定更高,考虑时间的经济性,氨氮去除效率更加直观有效。
表2 正交实验直观分析表
由表2 可以看出,菌株YN3 脱氮的最优条件为A3B2C3D2E2,即,碳源为柠檬酸钠,30 ℃ ,200 r·min - 1 ,pH = 7,C / N = 15 时。通过极差分析法,分析5 种因素对菌株YN3 硝化性能的影响顺序,依次为温度> C / N > 碳源> pH > 转速。由表3 方差分析得到,影响因子温度和C / N 对菌株YN3 的脱氮效率影响显著,同时,F 比值越大,因子的影响越显著,其结果与方差分析结果一致。说明菌株YN3 对温度的敏感度最大。C / N 比、碳源影响次之,充足的碳源才能保证菌株YN3 的生长以及异养硝化的有效进行,但C / N过高时,会使有机物嵌入酶结构,影响酶活性从而抑制反应。碳源的结构影响菌株YN3 对其吸收的效率,从而影响菌株YN3 的生长以及反应的有效进行,pH 和转速的影响最小,说明菌株YN3 对pH 和转速的适应范围比较广。
表3 正交实验方差分析表
为了检验正交实验所得结果的可靠性,在最佳条件下进行了3 次重复验证实验,氨氮去除效率的平均值为0. 488 7 mmol·(L·h) - 1 ,高于以上所有实验组,这充分验证了该实验的可靠性,表明正交实验适用于对氨氮去除条件进行参数优化。
2. 4 菌株YN3 的适应性进化
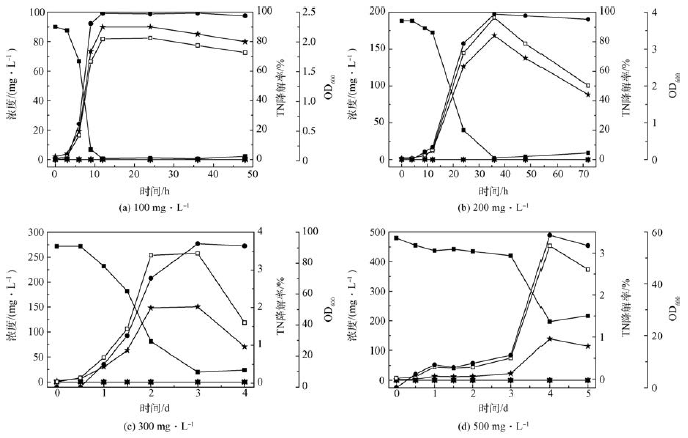
通过浓度梯度递增法,驯化菌株YN3 的氨氮耐受性,结果如图8 所示。在最适条件下鉴定菌株YN3的氨氮耐受性,初始氨氮浓度分别为100、200、300、500 和1 000 mg·L - 1 ,在低、中、高浓度的氨氮条件下, 氨氮去除率分别为99. 38% 、98. 86% 、99. 26% 、58. 85% 和25. 00% ,其对应的最大去除效率分别为0. 644、0. 442、0. 268、0. 210 和0. 175 mmol·(L·h) - 1 。最大生长量分别为2. 05、3. 855、3. 44、3. 175 和2. 675。其原因可能是氨氮浓度越低,菌株能够更快的将其去除,而氨氮浓度过高的时候会降低菌株脱氢酶活性,抑制硝化菌的生长,影响硝化反应 。虽然高浓度下菌株的氨氮去除效率低于中浓度,但是它们的氨氮去除量差别不大,分别是270、282. 5 和245 mg·L - 1 ,说明菌株YN3 对氨氮浓度在300 mg·L - 1 以内的废水具有非常好的氨氮去除效果。在整个反应过程中,几乎没有中间产物NH2 OH、NO2- -N 和NO3- -N 的积累,菌株在低、中、高氨氮浓度下均生长良好。与图3 相比,菌株YN3 的氨氮去除能力大幅度提高,说明经过驯化后的菌株YN3 的氨氮耐受范围很大,完全可以应用于高浓度的氨氮废水的治理。

2. 5 菌株YN3 硝化-反硝化过程氮平衡分析
菌株YN3 硝化实验中的氮平衡分析如表4 所示。以氨氮作为初始氮源,初始总氮浓度为274. 2 mg·L - 1 。反应最后,氨氮下降到2 mg·L - 1 ,伴随着微量的亚硝酸盐的积累,而羟胺和硝酸盐几乎无积累。与初始总氮相比,在整个异养硝化-好氧反硝化过程中37. 8% 的初始氮被菌株降解,以转化成气体产物的形式被去除,62. 0% 的初始氮被菌株YN3 转化为生物量,说明菌株YN3 具有良好的异养硝化作用。
2. 6 菌株YN3 反硝化功能验证
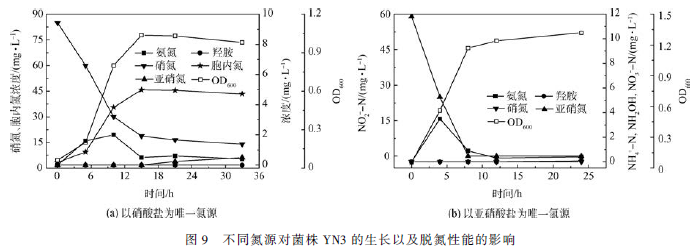
反硝化过程是指在反硝化菌株的作用下将硝酸盐转化为亚硝酸盐,再由亚硝酸盐最终转化为氮气的过程。以硝酸盐作为唯一氮源培养菌株YN3,如图5(a)所示,随着菌株YN3 生长曲线的上升,硝酸盐浓度降低,亚硝酸盐逐渐积累,但其最大积累量只有0. 68 mg·L - 1 ,反应过程中同时伴有微量的氨氮积累,无羟胺累积。反应15 h 后,硝酸盐去除率即达到了78. 8% ,亚硝酸盐的积累量很低,只有0. 1 mg·L - 1 左右,相比于菌株Rhodococuus pyridinivorans CPZ24只能将硝氮浓度由初始的50 mg·L - 1 降解到16. 6mg·L - 1 ,菌株YN3 降解硝氮的能力更强。
以亚硝酸盐为唯一氮源培养菌株YN3 进一步实验验证,如图5(b)所示。初始亚硝酸盐氮为60 mg·L - 1 ,8 h 后,亚硝酸盐完全去除,去除率为100% ,氨氮微量积累,无硝酸盐和羟胺的累积,相比于菌株Serratiamarcescens N-2 以初始浓度为50 mg·L - 1 亚硝酸钠为氮源时,72 h 后对亚硝氮的去除率达到98. 52% ,菌株YN3 对亚硝氮的处理更具优势。
为了直观了解菌株YN3 在反硝化培养基中氮素的转化情况,在最适条件下将菌株YN3 接入反硝化培养基中,以200 r·min - 1 的转速,30 ℃ 摇床培养,定期取样测定各形态氮的含量。如表5 所示,以硝酸盐作为初始氮源,初始总氮浓度为88. 3 mg·L - 1 。培养结束后,氨氮质量浓度下降到14 mg·L - 1 ,同时伴有微量亚硝酸盐和氨氮的积累,而羟胺几乎无积累。整个反硝化过程硝酸盐去除率为83. 5% ,总氮降解率为35. 4% ,即35. 4% 的硝氮通过反硝化作用转化为气体达到脱除效果,47. 0% 的氮转化为细胞内的生物量,说明菌株YN3 具有良好的好氧反硝化功能。
综上所述,菌株YN3 能够利用硝酸盐、亚硝酸盐和高浓度的氨氮进行生长代谢,以氨氮为底物时,菌株YN3 的生长量最大,对氮素的去除效率最高,亚硝酸盐、硝酸盐次之。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
1)从活性污泥中筛得一株异养硝化-好氧反硝化菌YN3,经鉴定为不动杆菌(Acinetobacter. sp)。其系统抗冲击能力较强,能在高浓度(1 000 mg·L - 1 )的氨氮废水中生长及反应,可以运用于高浓度氨氮废水的处理应用。
2)通过单因素实验和正交实验得出菌株YN3 生长及脱氮的最适条件为:碳源为柠檬酸钠,C / N 为15,pH 为7. 0,温度为30 ℃ ,转速为200 r·min - 1 。其影响显著性依次为温度> C / N > 碳源> pH > 转速。
3)最佳条件下,初始氨氮浓度为300 mg·L - 1 时,氨氮去除率为99. 3% ,其中37. 8% 的氮被菌株YN3降解,以转化成气体产物的形式被去除,62. 0% 的氮被菌株YN3 转化为细胞内的生物量。
4)菌株YN3 还能够利用亚硝酸盐和硝酸盐进行生长代谢,去除率分别为100% 和83. 5% 。
5)以硝酸盐为唯一氮源验证好氧反硝化功能。35. 4% 的硝氮通过反硝化作用转化为气体达到脱除效果,47. 0% 的氮转化为细胞内的生物量,说明菌株具有较强反硝化作用。为实现同步硝化反硝化提供了理论基础。