铅(Pb)是一种有毒的重金属元素,在环境中难降解,可被水生动植物富集吸收,进人食物链可能危害人畜安全。另外,直接饮用或皮肤接触含Pb水体均能使其进人人体,对人体健康造成危害。Pb中毒能导致人体出现失眠、幻觉、头痛、焦虑、肌无力等症状,且能损伤人的中枢神经系统,对肾、肝、生殖系统以及大脑都有严重危害。因此寻找一种高效、环保的方法处理含Pb废水,使其达标排放,减少环境污染,是急需研究和解决的环境问题。吸附法是目前重金属废水处理的主要方法之一,具有高效、简便和选择性好等优点,当前常用的吸附剂有树脂、壳聚糖、硅藻土、膨润土、活性炭等。利用农业废弃物制备的生物炭处理含重金属废水,是近年来吸附法的研究热点。
生物炭表面富含梭基、酚经基、碳基、酉昆基等多种官能团,有大量的孔隙结构,是一种高效的吸附剂。据统计,我国每年产生的农业废弃物达数千万t,这些农业废弃物是很好的廉价易得的生物炭原料。生物炭在水溶液中对As( V ) .Pb( II)和Cd( II)有巨大的吸附能力。当前一些报道应用稻壳、水稻秸秆、玉米秸秆等制备的生物炭对水体中重金属的吸附效果和特性进行研究,结果表明,生物炭表面具有较多的吸附位点,对水体中Pb2+,Cd2+等重金属的吸附效果较好。将生物炭进行改性或表面修饰能显著提高其吸附效果。李坤权等利用硝酸及乙二胺在蔗渣生物炭的孔道内修饰了含氮多胺基团,使其对Pb ( II)的吸附量比原碳提高了1. 5倍;YANG等将生物炭用硝酸进行改性后,其对Cu(II)的吸附容量比未改性时增加了5倍。近年来,将吸附剂用磁性铁氧化物纳米粒子进行表面修饰,不仅能快速、高效地吸附去除废水的重金属离子,而且由于其独特的磁学性质还可方便地外加磁铁进行回收,有很好的可重复再利用性,表现出良好的应用前景。CONC等将果胶吸附剂用磁性铁氧化物纳米粒子进行表面修饰,吸附Cu2+后再用E DTA对其进行再生,第5次再生后,仍可达到原始吸附容量的58. 66%,再生利用性良好。许飘利用磁性纳米固定化黄抱原毛平革菌吸附重金属污染废水中的Pb2+,吸附量高达185. 25 mg / g ,且经过吸附一解吸循环后仍能达到很好的去除效果。目前国内对生物炭表面负载磁性材料研究尚处于初期阶段,很有必要将吸附条件进行优化,确定吸附模型,探索其吸附机理。因此,本研究将谷壳生物炭改性后负载Fe3O4,制备成具有磁性的生物炭,通过对其进行表征分析及模拟废水中Pb2+的吸附效果研究,为磁性生物炭作为一种新型的吸附材料运用于实际工程打下坚实的理论基础。
1材料与方法
1. 1磁性炭化谷壳的制备
将谷壳原材料洗净,烘干,于400℃缺氧条件下加热4h,炭化后粉碎过100目筛,用超纯水清洗3次以去除灰分,70℃烘干后得到炭化谷壳。取一定量的炭化谷壳按固液比例为1:10置于2 mol / L 的硝酸中,110℃氧化反应2h,期间偶尔搅拌。冷却后用蒸馏水清洗直到上清液pH至中性,烘干后得到酸改性炭化谷壳。
将一定比例的FeCl3 · 6H2O和FeCl2 · 4H2O昆合溶解到0.4 mol / L HCl溶液中,加人到0. 7 mol / L 氨水溶液中,生成黑色的Fe3O4胶状沉淀。加人一定量的炭化谷壳,搅拌30 min,静置分离,烘干后得到磁性炭化谷壳(BC-Fe),收集备用。
1. 2吸附实验方法
1. 2. 1吸附时间对吸附的影响
在一系列150 mL锥形瓶中,加人pH值为5. 0、初始浓度为100 mg / L的模拟含Pb2+废水50 mL,然后分别加人0. 100 g BC-Fe ,25 ℃下振荡5 、 10 、 15 ,30 ,60 、 120 ,240 ,480 ,720 、 1 440 min,过滤,保存待测。
1.2.2初始pH对吸附的影响
在一系列150 mL锥形瓶中,加人初始浓度为100 mg / L的模拟含Pb 2+废水50 mL,用2 mol / L的HNO3和NaOH调节pH值分别为1.0,2.0,3.0,4.0,5.0,6.0,然后分别加人0. 100 g BC-Fe,置于恒温振荡箱中25℃振荡2h,用磁铁分离BC-Fe,上清液保存待测。
1.2.3添加量对吸附的影响
在一系列150 mL锥形瓶中,加人pH值为5. 0,初始浓度为100 mg / L的模拟含Pb2+废水50 mL,然后分别加人0.02,0.05,0. 1,0. 15,0.2,0.3,0.5 g BC-Fe ,25 ℃振荡2h,过滤,保存待测。
1.2.4不同初始浓度对吸附的影响
在一系列150 mL锥形瓶中,加人pH值为5. 0,初始浓度为10,20,50,100,150,200,300,350,400 mg / L模拟含Pb2+废水50 mL,然后分别加人0. 100 g BC-Fe ,25℃振荡2h,过滤,保存待测。
1.2.5吸附温度对吸附的影响
在一系列150 mL锥形瓶中,加人pH值为5. 0、初始浓度为100 mg / L的模拟含Pb2+废水50 mL,然后分别加人0. 100 g BC-Fe,于15 ,25 ,35 ,45 ℃下振荡2h后,过滤,保存待测。
1. 3样品分析方法
1. 3. 1磁性炭化谷壳的表征分析
使用全自动氮吸附比表面积测试仪测定活性炭比表面积(3 H-2000BET-A,北京);傅里叶变换红外光谱仪(FTIR)分析BC-Fe表面官能团(SHIMADZU : IRAfIinity-1,日本)。
1.3.2实验样品分析
溶液中的Pb 2+含量采用ICP-OES (ICP 6300 , Thermo)进行测定;溶液pH值采用PHS-3 C型pH计测定。实验中所有试剂均为分析纯或优级纯。
1. 4数据处理方法
BC-Fe对模拟含Pb2+废水的吸附效果采用吸附量及去除率进行研究,其计算方法如下:
吸附量:
去除率:
式中:C。为溶液中Pb2+初始浓度,mg / L;Ct 为某一时刻溶液中Pb2+浓度,mg / L ;m为溶液中吸附剂投加量,g;V为溶液体积,L。
实验中所有处理均设置3个平行样,数据结果均为平均值士标准偏差。采用Langergren准一级、准二级动力学模型,Langmuir 、 Freundlich等温吸附模型进行拟合,使用Excel 2010 、 Origin 8. 5软件进行数据处理与分析。
2结果与讨论
2. 1 BC-Fe的比表面积及红外光谱分析
经测定,未处理谷壳生物炭、硝酸改性后谷壳生物炭、以及负磁后谷壳生物炭的比表面积分别为1.48,1. 12和72. 94 m2 / g ,由此可知,对生物炭进行负磁后大大增加了生物炭的比表面积,提供了更多的吸附位点。
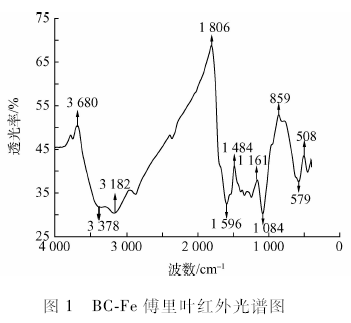
FTIR红外光谱分析表明(图1),BC-Fe具有部分游离醇和酚的O—H键( 3 680 cm-1)、不饱和烯、炔烃C-H键(3 182 cm-1)、以及梭基中的C=O键(1 806 cm-1),同时还出现了芳环的骨架伸缩振动峰(1 596 cm-1)、Si—O—Si ( 1 084 cm-1)的反对称伸缩振动峰,以及Fe3O4的特征峰(579 cm -1) ,这表明炭化谷壳成功负载FP3 O4,具有磁性,而且具有大量活性基团,能够与重金属结合。
2. 2 不同吸附条件对BC-Fe吸附Pb2+的影响
2.2.1 不同吸附时间对吸附Pb2+的影响
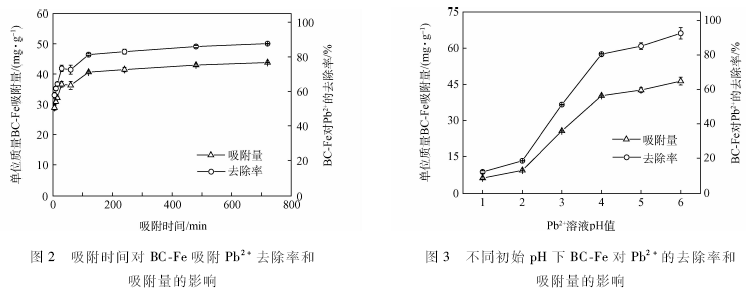
吸附时间对吸附Pb2+的影响结果如图2所示。
BC-Fe对Pb2+的吸附较快,在吸附时间为5 min时已经达到吸附总量的50%以上,2h时已达到吸附平衡。去除率以及单位质量吸附量的变化趋势一致。随着吸附时间的延长,BC-Fe对Pb 2+的去除率逐渐增加,在吸附时间为2h时达到81.3%,继续延长吸附时间,去除率增幅较小,在12h时达到87.6%,增加了6. 3 %。单位质量的BC-Fe对Pb2+的吸附量在吸附时间为2h时达到40. 6 mg / g ,基本达到饱和吸附状态,而后随吸附时间的延长,在12h时达到43. 8 mg / g,比2h时增加了3.2 mg。溶液中吸附剂与吸附质的结合是一个渐进过程,需要一定的时间才能达到平衡。由于BC-Fe对Pb2+的吸附可能存在多种吸附机理,推测在初始吸附阶段,主要发生的是表面吸附,物理吸附占主导地位,Pb2+能快速占据BC-Fe表面的活性位点,随着吸附时间的延长,BC-Fe表面的活性位点减少,吸附量以及去除率增幅较为缓慢最后达到平衡。
2.2.2不同pH值对Pb2+吸附的影响
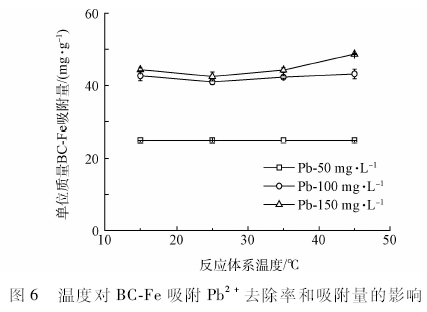
pH值是影响重金属离子吸附的一个非常重要的因素,在强酸环境下一般不利于吸附反应的进行。由于水溶液pH的不同,Pb离子的存在形态也不同。pH值小于6时,主要以游离的Pb2+形式存在;pH值大于6时,Pb的羟合配位离子逐渐生成,并开始沉淀。为研究在不同pH值条件下BC-Fe对Pb 2+的吸附特性,本实验中Pb溶液pH值设置为1. 0一6. 0。
由图3可知,BC-Fe对Pb2+的去除率和吸附量随着pH值的上升而增加。在pH值为1.0 -2.0时,BC-Fe对Pb2+的去除率很低,仅为12. 0%一18.5%;当pH值由2. 0升至4. 0时,去除率显著增加,由18. 5%上升至80.5%;当pH值介于4. 0一6. 0之间时,去除率逐渐增加但增幅不大;在pH值为6. 0时达到最高,去除率到达92.6 %。吸附量的变化与去除率的变化一致。在pH值为1. 0一2. 0时吸附量较低,为6. 01 - 9. 26 mg / g;当pH值由2. 0升至4. 0时,吸附量显著增加,由25. 5 mg / g上升至40. 2mg / g;当pH值介于4. 0一6. 0之间时,吸附量增幅不明显;在pH值为6. 0时达到最高,为46. 3 mg / g。BC-Fe对Pb2+的去除率随pH的升高而增加,在pH值接近中性时趋于平缓,这与安增莉等研究结果一致。由此可见,溶液强酸性时BC-Fe对Pb2+的去除率和吸附量都比较低。产生这种现象的可能原因,一方面是当溶液为强酸性,其中存在着大量的H+,H+与Pb2+之间存在竞争作用,占据了BC-Fe表面大量的吸附位点,从而抑制了吸附剂对Pb2+的吸附;另一方面是溶液中过多的H+使得BC-Fe表面的一些活性基团质子化,形成带正电的基团,与带正电的Pb2+相互排斥,抑制其吸附。随着pH值的升高,溶液中的H+逐渐减少,且活性基团被去质子化带负电,BC-Fe表面可供吸附Pb2+的位点增多,去除率上升。
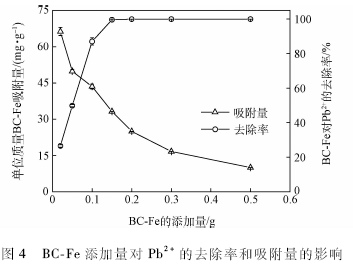
2. 2. 3不同BC-Fe添加量对吸附Pb 2+的影响
图4为BC-Fe添加量对Pb2+去除率和吸附量的影响。可以看出,BC-Fe对Pb2+的去除率随着BC-Fe添加量的增加而增加,而吸附量随着添加量的增加而降低。当BC-Fe添加量由0. 02g增加到0. 15g时,Pb 2+的去除率由26. 5%上升至99.9%,之后再增加BC-Fe的用量,去除率无明显变化,达到饱和吸附。在BC-Fe添加量为0. 02 - 0. 5 g时,单位质量的BC-Fe吸附量逐渐下降,由66. 3 mg / g下降至9. 99mg / g。 BC-Fe对Pb2+的去除率和吸附量随添加量变化的主要原因是由于溶液中Pb2+浓度一定时,增加吸附剂的用量,同时也增加了吸附剂的总比表面积,增多了可供吸附Pb2+的吸附位点,从而使去除率增加;在Pb2+为100 mg / L的溶液中,BC-Fe添加量为0.15g时,吸附已基本达到饱和,再增加BC-Fe的用量(0. 15一0. 5 g ),导致了单位质量吸附剂上的Pb2+吸附量下降。这与耿勤等的研究结果相一致。

2.2.4不同初始Pb2+浓度对BC-Fe吸附Pb 2+的影响
Pb2+溶液浓度对BC-Fe吸附Pb2+的影响结果如图5所示。BC-Fe对溶液中Pb2+的去除率随着Pb2+溶液初始浓度的增加而降低。在溶液Pb 2+浓度小于50 mg / L时,去除率基本保持在95%以上;随着Pb 2+浓度从100 mg / L增加至300 mg / L 时,Pb2+的去除率由81. 9%降低至34.2%;而后再增加溶液中Pb2+的浓度,Pb2+的去除率降低幅度变小,在浓度为350 mg / L时达到最低,为28.8% 。 BC-Fe对Pb 2+的吸附量随着Pb2+溶液初始浓度的增加而增加。当溶液Pb2=浓度从10 mg / L增加至100mg / L时,BC-Fe对Pb2+的吸附量显著增加,从4. 99 mg / g增加至41.0 mg / g;而后随着溶液Pb2+浓度的增加而缓慢增加,在Pb2+浓度为300 mg / L时达到51. 3 mg / g,基本达到饱和吸附量。BC-Fe对Pb 2+的去除率和吸附量随Pb2+溶液初始浓度变化的主要原因是由于增大Pb2+溶液浓度,有利于BC-Fe对Pb 2+的吸附。随着溶液浓度的逐渐升高, BC-Fe对Pb 2+的吸附量逐渐增加,提高了单位质量BC-Fe的利用率。但是,吸附剂表面的结合位点有限,一定质量的BC-Fe能够吸附Pb2+的量也有限,Pb2+溶液浓度过高,过多的Pb2+并不能被BC-Fe吸附,使其去除率降低。
2. 2. 5不同温度对吸附Pb2+的影响
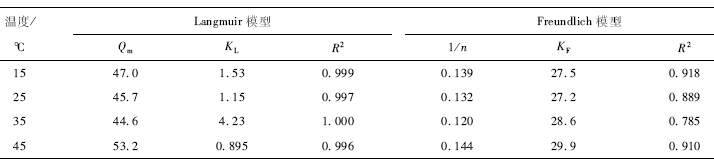
温度对BC-Fe吸附Pb2+效果的影响差异不明显(图6)。在pH值为5. 0时,当溶液中Pb 2+浓度为50 mg / L、温度为15 -45℃时,0. 1 g的BC-F能够e完全吸附溶液中的Pb2+,吸附量基本上维持在25 mg / g左右,去除率在99%以上。当溶液中Pb 2+浓度为100 mg / L 时,吸附量随着温度的升高而稍微微下降后小幅度上升,在25℃时最低为41. 0 mg / g ,45℃时最高为43. 2 mg / g ,去除率分别为81.9% ,86.3%。当溶液中Pb2+浓度为150 mg / L时,吸附量的变化趋势与Pb2+浓度为100 mg / L时相似,在25℃时最低分别为42. 5 mg / g(去除率56.6% ) ,45℃时最高分别为48. 7 mg / g(去除率64.9 % )。这一变化趋势与黄鑫等的研究结果相似。在较低温度环境下(如15 ℃时),BC-Fe对Pb2+的吸附以物理吸附为主,温度的升高可能使平衡吸附容量降低;当温度达到25℃左右时,物理吸附作用减弱,化学吸附占主导地位,此时升温使化学反应活化能增加,活化分子百分数增强,吸附容量增大。
2. 3吸附行为
2. 3. 1吸附动力学
吸附动力学能够研究吸附反应速率以及其他各种因素对反应速率的影响。为了更好地描述BC-Fe对溶液中Pb2+的吸附行为,本研究采用Langergren准一级、准二级动力学方程对实验数据进行拟合。
表1 BC-Fe吸附Pb2+动力学模型拟合
当Pb2+溶液浓度为100 mg / L 时,其动力学拟合结果如表1所示。BC-Fe对Pb2+的吸附用准二级动力学方程拟合结果更好,相关系数R2为1. 00,高于准一级动力学方程的相关系数R2= 0. 967,且由其计算出来的理论平衡吸附量为43. 9 mg / g,接近实际平衡吸附量40. 6 mg / g(图5)。这说明BC-Fe对Pb 2+的吸附过程能用Langergren准二级动力学方程进行描述,其吸附过程主要是由化学吸附控制。
2.3.2吸附等温线
吸附等温线可以用来描述吸附剂与吸附质之间的平衡关系,并且能宏观地表述吸附容量、吸附强度、吸附状态等特性,通过相关公式计算能得到最大饱和吸附量。Langmuir等温吸附方程主要针对的是均一表面进行的单分子层吸附,且被吸附分子之间无任何相互作用;而Freundlich等温方程常用于描述物理吸附,多层吸附,在高浓度时吸附量会持续增加。将实验数据进行等温吸附拟合,其相关计算方程如下:
Langmuir方程:
Freundlich方程:
式中:Ce为吸附平衡时溶液中离子浓度,mg / L;qe为平衡吸附量,mg / g;Qm为Langmuir模型计算出的最大吸附量,mg / g;KL为Langmuir常数;KF,1/n均为Freundlich常数。
由表2可知,在温度为15,25,35,45 ℃时,Langmuir方程拟合的相关系数R2分别为0. 999 , 0. 997 ,1. 000 ,0. 996,明显高于Freundlich方程的相关系数0. 785 ,0. 889 ,0. 918 ,0. 910。由此可见,Langmuir等温吸附方程能更好地描述BC-Fe对Pb2+的吸附特性,表明该吸附反应近似单分子层吸附。且由Langmuir方程计算出的饱和吸附量,随温度的增加先降低再增加,在35℃达到最低为44. 6 mg / g ,在45℃时达到最高为53. 2 mg / g。由Freundlich模型计算出的参数可以看出,吸附指数1/n介于0. 1 - 0. 5之间,表明该吸附容易进行。在温度为45℃时,吸附指数1/n及K。数值相对较大,表明45℃时吸附质与吸附剂的吸附亲和力最强。
表2 不同温度下BC-Fe对Pb2+等温吸附模型拟合
2.3.3吸附热力学
为了进一步探讨BC-Fe对Pb2+的吸附过程及机制,对吸附过程的热力学参数标准自由能( ![]() )、标
)、标
准烩变(![]() )和标准墒变(
)和标准墒变(![]() )进行了分析,其相关计算公式如下:
)进行了分析,其相关计算公式如下:
式中:R为常数8. 314 J · ( mol · K)-1;T为绝对温度;K为某一温度下的平衡常数(K = qe / Ge ) 。
以1nK对1/T作图并进行线性拟合,通过式(6)计算出各参数值列于表3中。由表3可知,BC-Fe对Pb 2+的吸附过程中,![]() <0,
<0,![]() >0,
>0,![]() >0,表明该吸附反应在较高温度时是自发的吸热反应。随着温度的升高,
>0,表明该吸附反应在较高温度时是自发的吸热反应。随着温度的升高,![]() 先降低后升高,推测在较低温度环境下(15一25 ℃ ) , BC-Fe对Pb 2+的吸附以物理吸附为主;升温后(25 -45℃),增加了反应体系的活化分子百分数,有利于吸附反应的自发进行,化学吸附占主导地位,这与温度升高对吸附有利的实验结果一致。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
先降低后升高,推测在较低温度环境下(15一25 ℃ ) , BC-Fe对Pb 2+的吸附以物理吸附为主;升温后(25 -45℃),增加了反应体系的活化分子百分数,有利于吸附反应的自发进行,化学吸附占主导地位,这与温度升高对吸附有利的实验结果一致。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
表3 BC-Fe吸附Pb 2+热力学参数
3结论
1)经过改性和负磁后的生物炭BC-Fe的比表面积显著增加,到达72. 94 m2 / g FTIR红外光谱分析表明,BC-Fe具有梭基、经基以及不饱和烯、炔烃等官能团,可与Pb2+结合,是BC-Fe对Pb2+具有良好吸附能力的原因之一。
2) BC-Fe对模拟废水中Pb2+的吸附能力与溶液pH值、初始浓度、BC-Fe添加量、吸附时间等因素显著相关。在Pb2+溶液初始浓度为100 mg / L ,pH =5. 0,温度为25℃,吸附时间为2h,分别添加0. 1 g和0. 15 g的BC-Fe于50 mL Pb2+溶液中,BC-Fe对溶液中Pb2+的吸附量分别为40. 6 mg / g和33. 2 mg / g,去除率分别为81. 3%和99.9%。
3 ) BC-Fe对Pb2+的吸附过程与Langergren准二级动力学模型拟合度更高,吸附主要为化学吸附,理论平衡吸附量为43. 9 mg / g。等温吸附研究表明,Langmuir等温吸附方程能更好地描述BC-Fe对Pb2+的吸附行为,该反应近似单分子层吸附,且在25℃时的理论最大饱和吸附量为45. 7 mg / g,BC-Fe对Pb2+具有良好的吸附能力。