铬在自然界中主要以Cr3+和Cr6+的形态存在,其中,Cr6+的活性更强,具有更高的流动性,故被认为具有更强的毒性.铬被广泛用于工业生产中,大量含铬废水排到自然界中,会影响河流水质甚至污染地下水资源,进而严重威胁动植物的健康生长.目前,铬污染已越来越严重,对铬污染的水体主要采取物理化学修复法和生物修复法进行净化,但物理化学法容易造成二次污染.而生物修复法尤其是植物修复,无二次污染,且能绿化环境,并可通过二次提取实现重金属的循环利用.用人工湿地模拟自然湿地,具有基建和运行费用低、维护管理方便、生态效益高等优点,已被广泛应用于废水的净化.近年来,利用人工湿地净化含重金属废水已经引起诸多研究者的关注.例如,韦菊阳等(2013)的研究表明,人工湿地可以有效清除废水中的Cd、Pb,污水停留7 d时,梭鱼草和芦苇人工湿地对Cd2+的去除率分别为86.0%、86.4%,对Pb2+的去除率分别为89.7%、90.2%.
薏米(薏苡)生长于温暖潮湿的河边地,生长迅速,根系发达,虽不属于超积累植物,但它适应人工湿地环境的能力强.研究发现,薏米人工湿地对铬的去除能力较强,能够维持长时间的去除能力.在课题组前期的研究中发现,虽然薏米人工湿地能够高效清除生活污水中的铬,但大部分的铬积累于根系,只有少量的铬可以通过收割带走,而残留于湿地系统根系的铬将是湿地系统内铬化学形态变化及水中可溶性铬的重要来源,若对根系分解过程中铬积累和释放规律认识不清,会导致湿地的高效管理出现困难,也会影响到人工湿地高效去除铬的长期和稳定运行.
对湿地植物枯落物的分解及分解过程中重金属的变化动态已经有报道,但对于人工湿地植物根系分解及分解过程中重金属元素释放及化学形态分布的变化尚未见报道.为弄清残留于湿地系统内根系铬化学形态转化及释放的规律,本研究拟通过构建微型薏米垂直流人工湿地,在生活污水中添加不同浓度的Cr6+,运行一段时间后,将根系切下,重新埋回湿地中,以研究薏米根系分解、铬元素含量及形态分布的动态变化,为人工湿地高效处理含铬生活污水的技术研究及人工湿地的运行、管理提供理论支持.
2 材料与方法(Materials and methods) 2.1 供试材料
广西野生湿生薏米(Coix aquatica Roxb)由广西农业科学院作物品种资源研究所提供.
2.2 试验设计
实验于2011年在广西大学农学院教学科研基地温室进行,参考文献方法在棚内构建模拟垂直流人工湿地系统:在上端口直径71 cm、下端口直径45 cm、桶高61 cm的大塑料桶进行实验,桶内从下至上依次填入10 cm 厚的大鹅卵石(直径 3~5 cm),然后填入40 cm 厚的河沙层,在距桶底部10、25、40 cm 处分别安装水龙头用于排水;种植薏米幼苗,每桶6株.构筑以生活污水为营养源的小型薏米垂直流人工湿地系统,进水Cr6+浓度分别为0、20、40 mg · L-1,以K2Cr2O7的形式加入,重复3次,每处理均设不种植植物为对照,每桶每次进水量为30 L.该人工湿地构筑于2012年3月,已在相同Cr6+浓度下持续运行1年,于2013年3月5日剪掉越冬苗,待幼苗重新长出,当苗高60 cm左右时进行铬胁迫实验.人工湿地采用间歇式进水方式,进水后水停留3 d,然后落干4 d,每7 d为1个循环.
采用埋袋法进行研究,分解袋由孔径0.5 mm的尼龙网制成(20 cm×20 cm).铬胁迫3周时,在2013年5月15日收集20、40 mg · L-1铬处理的薏米根.根清洗干净后挑去发黄的老根,吸干表面的水,剪成5 cm长根段;取7 g装袋(鲜样);另取部分根烘干,取3 g装袋(干样).将装袋后的根样品对应埋回原处理大桶距离表层沙面20 cm的沙层中,每个浓度设置为A桶和B桶,A桶灌溉含铬的生活污水(20、40 mg · L-1 Cr6+),用W20A、W40A表示;B桶为只灌溉等量的生活污水(0 mg · L-1 Cr6+),用W20B、W40B表示.每桶埋9袋鲜样和9袋干样.
2.3 样品的采集与测定方法 2.3.1 样品采集
在分解袋埋下30、45、60 d时取样,每次在每个投放点取回3袋鲜样和3袋干样,洗净,鲜样袋的根吸干根表面的水后直接称重,干样袋的根在70 ℃下烘干至恒重后再称重.干样袋的根用于分析分解率,鲜样袋的根用于其他指标测定.
2.3.2 根分解系数测定
参考文献方法,用残留率和分解系数表示.根分解过程中干物质残留率的变化可以用指数衰减模型来描述,即ln(Xt/Xo)= -kt,其中,Xt为分解t时后根的残留量(g),Xo为根的初始质量(g),k为分解速率常数(d-1),t为分解时间(d).对分解残留率数据进行自然对数转化后,线性拟合得到回归方程和参数.
2.3.3 根Cr含量的测定
根内铬总量的测定方法参考文献.
2.3.4 根中Cr的化学形态的测定
参考杨居荣等(1995)的方法,用化学提取剂对薏米根中不同Cr形态进行顺序提取,提取剂及提取顺序如表 1所示.称5 g鲜样,液氮速冻研磨至粉末状,加入30 mL提取剂移至50 mL离心管中,25 ℃振荡提取24h,5000g离心,上清液倒于锥形瓶中,将上清液蒸至近干,V(HNO3):V(HClO4)=4:1下红外消解,10% HNO3定容到25 mL.残渣态直接使用残渣消解,消解方法同上.消煮后用FAAS测定(ZEE nit700P,德国耶拿).
表 1 薏米根体内不同Cr形态进行顺序
2.4 数据处理
采用Microsoft Excel 2003 作图表;利用SPSS Statistics 19进行计算和统计分析,并用 Duncan 检验法对显著性差异(p<0.05)进行多重比较.
3 结果与分析(Result and analysis) 3.1 不同处理下薏米根的分解动态
由图 1 可知,根干物质的残留率都随着时间的延长而下降,添加在污水中的Cr6+会抑制根的分解,根的残留率比不添加铬处理的大.埋根后30~60 d,不同处理下薏米根干物质残留率差异显著(p<0.05); A桶的根干物质残留率显著大于B桶,其差异随着Cr6+浓度的增大而增大.不同处理之间,根的干物质残留率大小顺序为:W40A>W20A>W20B>W40B.在0~30 d,不同处理下的根分解迅速,此为快速损失阶段,也是易溶性物质的淋溶阶段.在30~60 d,根分解变慢,残留率变化不大,之后根分解缓慢为慢速损失阶段.

图 1 不同处理下薏米根分解过程中干物质残留率的变化
由表 2可知,在不同处理下根系分解残留率经过指数模型分析其R2>0.99(p<0.05),符合Olson单指数分解模型,W20B、W20A、W40B、W40A处理的分解常数(k)分别为 0.0032、0.0019、0.0036、0.0016 d-1.

表 2 薏米根残留率自然对数(y)和分解时间(t)的回归方程和参数
不同处理下根系分解速率存在差异性,埋回20 mg · L-1和40 mg · L-1 Cr6+处理的桶内,相同处理浓度下,均为不继续进行铬处理的分解速率比继续进行铬处理的快.由分解常数可以推算出不同处理下薏米根系分解50%和95%所需的时间(表 2).
3.2 不同处理下薏米根中Cr 元素变化动态
根中的铬元素变化动态可以用根残留体中铬元素含量变化和铬元素绝对量的变化来描述.铬元素绝对量的变化用铬元素残留率表示,是由根残留体中铬元素质量除以初始根中铬元素的质量而得.由图 2可知,在0~60 d的分解过程中根残留体Cr含量呈先升高后下降的趋势.埋根30 d时,不同处理的根内Cr含量均提高,且与初始含量差异显著(p<0.05),W20B、W40A两者之间差异不显著,但均与W20A、W40B差异显著(p<0.05).45 d时,W20B、W20A、W40B、W40A处理根内Cr含量分别比根初始含量增大了94.72%、98.92%、58.84%、24.36%.不同处理下都是在分解45 d后Cr含量开始下降,W20B处理下降的幅度最大,下降了60.69%.在分解60 d后,W20B、W20A、W40B、W40A处理根的Cr含量差异显著(p<0.05),分别为134.82、170.12、199.78、216.56 mg · kg-1,根残留体的Cr含量均小于初始含量.
图 2(Fig. 2)
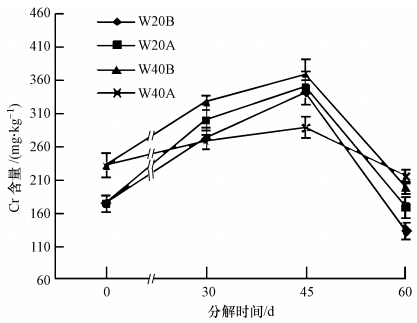
图 2 不同处理下根内总铬含量变化动态
由图 3可知,在0~45 d,不同处理条件下根残留体的铬绝对量均呈上升趋势,在45 d时达到最大,说明在0~45 d的分解过程中人工湿地中的Cr被固持到残留的根内.分解45 d后铬绝对量均下降,60 d时,W20B、W20A、W40B、W40A处理的铬绝对量分别为76.49%、96.90%、85.90%、93.36%,说明根内的铬发生了净释放,并且埋于B桶内的根的铬净释放量大于A桶.不同处理下根铬绝对量变化在0~45 d为固持阶段,45~60 d为释放阶段.

图 3 根分解过程中铬绝对量的变化
3.3 分解过程薏米根的Cr形态分布变化动态 3.3.1 埋根后不同处理下不同形态Cr的分布
由图 4可知,埋根前,不同浓度Cr6+处理3周时薏米根内Cr形态均是F1、F2、F6占的比重较大,F3、F4、F5占的比重相对较小;随着Cr6+处理浓度的增大,F2的百分比提高了6.65个百分点,但F1的百分比则降低了5.21个百分点,其他形态百分比变化不大.

图 4 不同分解时间不同处理下薏米根内Cr形态分布百分比图
埋根30 d后,正常灌溉的B桶所埋细根内Cr形态分布与埋根前根内Cr形态分布存在显著差异,W20B、W40B处理的F1、F2百分比均大幅度降低,但F6百分比均大幅度提高,分别提高了25.24个百分点和27.73个百分点,此时占总铬的比例已经超过50%,分别为61.02%和63.21%.埋根30~45 d,W20B、W40B处理的各形态百分比变化趋势相似,变化幅度均较小,F6百分比均增大;F2、F3百分比均不同程度下降.埋根45~60 d,W20B、W40B处理皆以F6占的百分比最大,W20B处理的F6百分比增大了9.6个百分点,但W40B处理的F6百分比下降了8.47个百分点,其他形态变化幅度均小.
埋根30 d后,埋于继续添加Cr6+的A桶的根内Cr形态分布与埋根前根内Cr形态分布差异显著.埋根30 d后,W20A、W40A处理的F1、F2、F6的百分比均大幅度下降,但F3、F4、F5的百分比均大幅增大,此时W20A处理中以F5所占总铬比例最大,为38.67%,但W40A处理以F4所占总铬比例最大,为25.63%.埋根30~45 d,W20A、W40A处理的Cr形态变化趋势存在差异,W20A处理的F3、F5、F6的百分比均呈下降趋势,其他形态百分比均呈上升趋势;W40A处理的F3、F5的百分比减小,其它形态的百分比均不同程度增大.但埋根45 d时W20A、W40A处理均以F4所占百分比最大.埋根45~60 d,W20A处理的F4形态所占百分比大幅上升,提高了22.93个百分点,但F2、F5所占百分比大幅下降,其它形态所占百分比则变化不大;W40A处理的F4、F5百分比提高了10.06个百分点、5.12个百分点,其它形态所占百分比均不同程度降低.
在分解过程中,不添加与继续添加Cr6+处理根内Cr形态分布存在差异.W20B与W20A、W40B与W40A处理之间的Cr形态分布差异均显著.分解过程中,W20B、W40B处理F6所占比重整体呈上升趋势,埋根60 d后占总铬的比例高达76.76%、68.67%,W20A、W40A处理F6所占比重整体呈降低的趋势,但F4所占比重均呈逐渐上升的趋势,埋根60 d后F4所占比重分别为49.99%、38.39%.埋根60 d后,不添加Cr6+处理根Cr形态分布以F6占据明显优势,其他形态的百分比均小于12%;继续添加Cr6+处理根内Cr形态皆以F4百分比最大,但未超过50%的形态分布.
4 讨论(Discussion) 4.1 不同处理下薏米根系分解动态
林成芳等(2008)的研究表明,在720 d内3个径级细根分解均出现了2个以上快慢不同的阶段,呈现前期分解快、后期分解慢的特征;而李新华等(2007)的研究则表明,小叶章湿地根分解过程中呈现明显的阶段性:0~30 d分解快速,之后分解较缓慢.本实验结果与之相符.
细根在分解过程中受土壤条件和细根特性的影响.湿地基质中的微生物对根的分解速率影响很大,不同种类的微生物在分解过程中起到的作用不同.研究表明,细菌控制着植物枯落物的分解速率,其分解作用量可达总流失量90%;真菌主要通过改变枯落物物理、化学性质,对枯落物起破碎作用.黄建祥等(2013)研究了六价铬对薏米人工湿地微生物群落数量的影响,结果表明:低中浓度Cr6+(5、20 mg · L-1)对人工湿地基质中真菌和放线菌数量有促进作用,而高浓度Cr6+(40、60 mg · L-1)处理下这些微生物数量则受到抑制.本研究结果表明,在薏米根的分解过程中,在培养液中添加Cr6+显著抑制了埋根的分解.由此推测,Cr6+处理下分解率降低的原因之一可能是长期的Cr6+(20、40 mg · L-1)胁迫下,微生物的生长受到了抑制,进而抑制了细根的分解.
4.2 分解过程不同处理下根内Cr含量的变化
目前,关于人工湿地根系分解过程中重金属变化动态的研究尚不多见.盛华夏(2009)研究发现,湿地植物白骨壤落叶Cr含量在冬季分解0~42 d 内呈上升趋势,21 d时Cr含量为对照组的2.82倍,分解后期整体呈下降趋势,本研究也呈现类似的变化趋势.刘汝海等(2005)研究了小章叶湿地枯落物在分解过程中汞含量的变化,结果表明,分解初期汞含量略有升高,随着分解程度的增强,汞含量逐渐降低并低于初始值.由此可推测,分解过程中湿地植物凋落物重金属变化动态与枯落物的分解程度有关.李新华等(2007)在研究三江平原小叶章湿地根分解过程中硫元素释放动态的结果表明,根中硫的释放模式分为固持、释放2个阶段.本实验结果显示,分解前期根残留体Cr含量升高,随着分解程度的加强,Cr含量逐渐降低并低于初始含量.这是因为伴随着薏米根系的分解,人工湿地中的Cr先被积累到根残留体内,然后又逐渐向湿地水和土壤中迁移.由此可推测,根系中Cr元素的变化与根系质量损失相关.
4.3 埋根后不同处理下根内Cr形态分布变化
Cr的化学形态直接体现Cr的生物有效性,根系作为重要的吸收Cr的器官,研究其分解过程中Cr化学形态变化对人工湿地的管理具有重要意义.本研究表明,人工湿地植物薏米的根在培养液中继续添加铬与不添加铬的条件下,随着分解过程进行Cr形态分布差异显著,未继续添加Cr6+处理的薏米根残留体的F6百分比均大幅度提高;继续添加Cr6+处理的薏米根残留体的F6百分比减小,而F4的比重却大幅度提高.F4为难溶于水的二代磷酸盐、亚磷酸盐等结合态的Cr,F6为残渣态中的Cr,F4、F6的生物活性均较低.说明Cr6+胁迫下,在根系分解过程中没有提高根残留体内Cr的生物活性.研究表明,Cr的F1、F2形态生物活性高,在植物体内容易被迁移和转化.本实验结果表明,不同处理下F1、F2形态Cr分解过程中均大幅度降低,可能是由于其金属活性较强,比较容易被迁移和转化.
具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。5 结论(Conclusions)
在60 d的分解过程中,人工湿地植物薏米根系的分解速率呈现前30 d快速分解,后30 d慢速分解的模式.根内Cr含量变化在埋根30~45 d呈增加的趋势,在45 d之后又呈下降的趋势,不同的处理条件下,根内Cr可分为固持和释放两个阶段.根系分解过程中,不同处理的F1、F2形态Cr含量均大幅度下降.分解60 d后,W20B、W40B处理的F6百分比分别为76.76%、68.67%,故以F6为主要优势的形态分布;但W20A、W40A处理的 F6比例均显著降低,最终以F4比例最高,其他形态次之.



