1、1,4-二氯苯(p-DCB)是一种应用广泛、对环境毒性高且难以降解的有机化合物,它主要用于防蛀剂、防霉剂和除臭剂生产,也是生产聚苯硫醚的主要化工原料.p-DCB能在水生生物中发生生物蓄积,是潜在的环境和食物污染源,可对人体产生严重的“三致效应”.因此,如何有效降解1,4-二氯苯成为研究治理有机污染物的难点. 目前处理难降解有机污染物主要有吸附法、化学氧化法、生物法、电催化氧化等方法,其中电催化氧化法因其具有能产生高氧化能力的羟基自由基,对有机污染物降解较为彻底,很少或一般不产生二次污染,反应条件温和,可控性强等优点而得到广泛应用.电极材料是电催化氧化的“核心”,因此,选择合适的电极材料对有机污染物的降解有着重要的意义.以钛为基体掺Sb的SnO2电极,因其析氧电位高,催化能力强等特点,在电催化氧化处理难降解有机废水中得到广大学者的关注.然而Ti/SnO2-Sb电极稳定性较差,限制了该电极的推广使用.针对这一问题,学者们提出了掺杂其他元素和增加中间层等方法来提高Ti/SnO2-Sb电极的稳定性,但研究大多集中在掺杂稀土元素、贵金属,而对于采用非贵金属掺杂改性的研究探讨相对较少.
本文采用聚合物前驱体法制备了Ti/SnO2-Sb电极及3种非贵金属掺杂复合电极,分析改性前后Ti/SnO2-Sb电极形貌和结构变化,考察改性前后不同电极对1,4-二氯苯废水电催化氧化降解效果的影响,旨在对该类废水的有效处理进行探究,提供新的技术方法.
2 实验部分
2.1 试剂、材料与仪器
试剂:草酸、对二氯苯、乙二醇、柠檬酸、结晶四氯化锡、三氯化锑、硝酸铜、硝酸镍、硝酸铋、氢氧化钠等,均为分析纯.
材料:自制电解槽,有机玻璃材质,尺寸为80 mm×100 mm×100 mm;钛板,深圳市欧帝富金属材料有限公司,尺寸为40 mm×50 mm×1 mm;石墨板,海门市曙光碳业有限公司,尺寸为40 mm×50 mm×1 mm.
仪器:MPS-3303直流电源,深圳市麦威仪器有限公司;78-1型磁力加热搅拌器,江苏省金坛市金城国胜试验仪器厂; HH-6型数显恒温水浴锅,金坛市白塔新宝仪器厂;EVO-18型扫描电镜,德国蔡司公司;X′pert PRO型X射线衍射仪,荷兰帕纳科公司;CHI 760C电化学工作站,上海辰华仪器公司;Agilent 1260型高效液相色谱仪,安捷伦科技有限公司.
2.2 实验过程
2.2.1 电极制备
以钛板为基体,将其先后用80目和320目的砂纸打磨,去除表面的氧化层及杂质,用蒸馏水冲净后置于40% NaOH溶液中,水浴80 ℃下浸泡除油.取出洗净后浸入质量分数为10%的草酸溶液中,加热煮沸3 h,经草酸刻蚀过的钛板呈均匀灰色麻面,然后用蒸馏水冲洗钛基体表面残存的草酸及草酸钛,100 Hz条件下超声10 min,清洗后放入1%的草酸溶液中保存待用.
采用聚合物前驱体法制备改性电极:在65 ℃水浴搅拌下,使乙二醇和柠檬酸反应制得乙二醇柠檬酸酯,加入一定量的结晶四氯化锡(SnCl4·5H2O)和三氯化锑(SbCl3),并升温至90 ℃促进螯合和凝酯化,再加入金属硝酸盐至充分溶解,将混合液在80 Hz下超声20 min,即制得涂层溶液.最后,将涂液均匀涂覆在钛基体上,于130 ℃的烘箱中烘10 min,随后转入600 ℃的马弗炉焙烧10 min,取出冷却后再进行下一次的涂覆、烘干、焙烧,如此反复数次,最后1次焙烧1 h并随炉冷却.
2.2.2 电极结构表征
利用扫描电子显微镜(SEM)观察电极表面涂层形貌;利用X射线衍射仪(XRD)对所制备的电极进行结构分析,确定涂层物相.
2.2.3 电化学性能测试
利用CHI 760C电化学工作站测试电极的电化学性能,根据极化曲线考察掺杂不同金属对Ti/SnO2-Sb电极析氧电位的影响,用恒电位下的电流-时间曲线反映电极的稳定性,以循环伏安曲线考察电极催化性能.采用三电极体系:制备电极为工作电极、纯钛板为辅助电极、饱和甘汞电极为参比电极,在常温25 ℃条件下,测定其在0.5 mol · L-1硫酸钠溶液中的极化曲线,在恒电位(1 V)下测定电流与时间的关系曲线,并在0.5 mol · L-1 Na2SO4溶液和0.5 mol · L-1 Na2SO4+100 mg · L-1 1,4-二氯苯溶液中对改性Ti/SnO2-Sb电极进行循环伏安测试.
2.2.4 电催化降解实验
在自制电解槽中,以1,4-二氯苯为目标降解物,加入浓度为100 mg · L-1的废水,同时添加3.55 g的Na2SO4作为支持电解质,以掺杂不同金属的Ti/SnO2-Sb电极作阳极,石墨作阴极,通过磁力搅拌装置控制一定的搅拌速率,恒定电压为15 V,板间距1 cm,分别测定不同时间1,4-二氯苯的降解情况.1,4-二氯苯的测定采用高效液相色谱法.
3 结果与讨论
3.1 电极表面形貌分析
不同金属掺杂Ti/SnO2-Sb电极表面形貌如图 1所示,放大倍数是5000倍.从图 1中并未看到各电极有明显的“龟裂”现象,说明涂层能够很好覆盖钛基体.电极表面裂缝的减少可以避免电极在电解过程中产生新生态的氧向钛基体扩散,生成高阻抗的TiO2,继而影响电极的氧化性能,缩短电极寿命.另外,图中所有电极表面均不平整,有许多不规则的凸起与凹陷,其中掺杂Cu和Ni的电极表面呈“蜂窝状”结构.这种表面细小蜂窝状的小孔结构使电极拥有更大的比表面积,同时增加催化活性点位数.因此,掺杂金属能改善电极表面形貌,提高催化活性.

图1 掺杂不同金属Ti/SnO2-Sb电极SEM图
3.2 电极晶体结构分析
对所制备电极进行XRD分析.从图 2数据可见,所有电极的X衍射峰的位置跟四方形金红石型的SnO2晶体结构的标准卡片(00-041-1445)的峰数据基本一致,并未检测到Sb及掺杂金属相应氧化物的衍射峰,表明金属掺杂并没有改变SnO2晶体结构.这可能是因为金属离子进入SnO2的晶格中取代了晶格中Sn4+的部分位置,以金属氧化物的形式固溶到SnO2的晶格中,因而在XRD中Sb及掺杂的金属没有以单独的氧化物形式存在.但是掺杂金属后电极的X射线衍射峰位置发生了微小偏移,主要由于金属离子与被替代的Sn4+之间离子半径存在差异,以及金属离子加入后出现的氧空穴而造成晶格缺陷.

图2 掺杂不同金属Ti/SnO2-Sb电极XRD图
同时从所有电极的XRD图谱中也没有发现有钛基体的特征峰出现,说明所制备电极的表面已经 完全被二氧化锡微粒所覆盖.这样的结构避免电解 过程中产生的氧渗透到钛基体,改变其界面的张力,造成活性涂层的脱落,影响电极的催化活性.
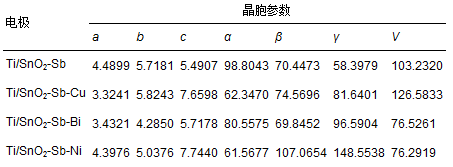
通过XRD分析软件(X′Pert highscore plus)对数据进行分析得到各电极的晶胞参数见表 1,分析表中数据发现,对Ti/SnO2-Sb电极进行金属掺杂改性后,晶胞参数发生改变,主要体现在晶胞体积的增大或减小,这是由于各金属离子成键半径不同,当金属离子以固溶或者类质同相的形式取代Sn4+进入SnO2晶格内部,必然引起金属氧键的键长发生变化,从而造成晶胞参数的改变.XRD图谱和晶胞参数等数据表明,通过金属掺杂改性使金属离子进入到SnO2晶格中,其中,Cu和Ni以其p型半导体的性质形成了空穴点位,使电极表面形成较为密集的蜂窝状,微观结构(图 1)中也观察到电极无裂缝且蜂窝状结构分布均匀,这样的结构可以增加电极的活性点位而提高电催化性能;而Bi则为n型半导体,与SnO2有着相似的性质,进入SnO2晶格后主要通过增加自由电子的浓度来达到增强导电能力的效果.
表1 各电极晶胞参数对比
3.3 电化学性能分析
3.3.1 阳极极化曲线分析
电极的析氧电位是影响有机物电化学降解效率的重要因素,有机物在阳极发生氧化的同时,伴随着析氧副反应.析氧反应的发生主要是因为电极表面吸附的· OH和转移到晶格内的O不稳定,除了可与有机物发生反应外,还可能以O2的形式释放.当析氧电位低时,通过的电流大部分用于氧气的析出,导致有机物降解效率降低;当析氧电位高时,氧气难于析出,有机物在阳极直接被氧化降解的概率就会增加.因此,较高的析氧电位是催化电极的一个重要指标.
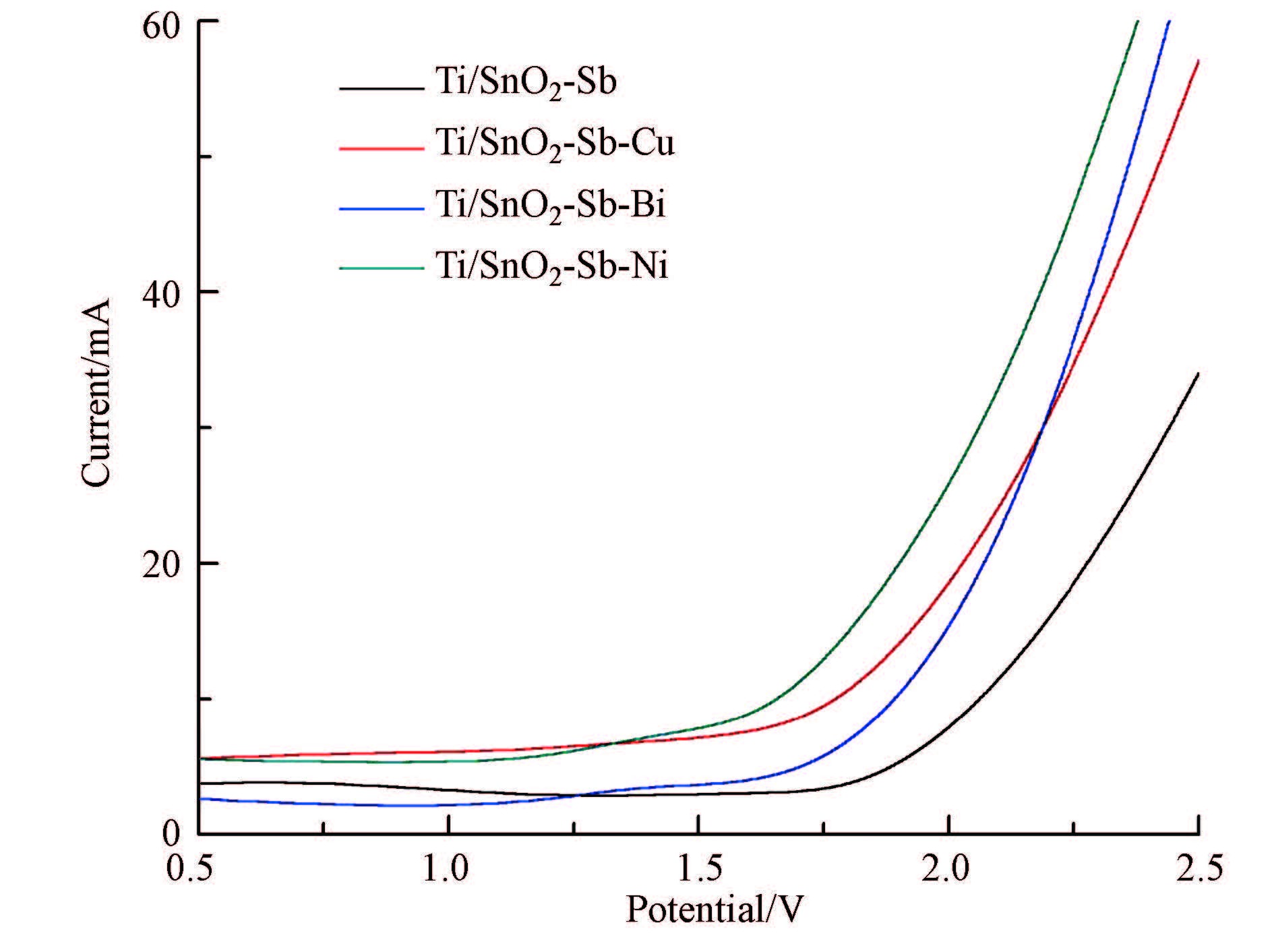
图3 电极的析氧极化曲线
图 3为所制备电极在0.5 mol · L-1Na2SO4溶液中的阳极极化曲线.图中数据表明,4个电极的析氧电位都在1.7 V(vs.SCE)以上,均处于较高的析氧电位,高析氧电位能抑制氧气的析出,提高电极的催化活性和电流效率.但是,金属掺杂后电极的析氧电位并没有明显改变,这可能是金属掺量和焙烧温度综合影响的结果.
3.3.2 电流与时间关系分析
图 4是4种改性电极在恒电位1.0 V下的电流-时间曲线,在1.0 V下,不会有析氧反应发生,氧化电流归因于电极材料的氧化.图中0 min的较大电流是由于电极的双层充电所致;在恒电位氧化400 min内,四种电极的氧化电流基本恒定,掺杂Cu、掺杂Bi、掺杂Ni氧化电流相近,明显低于未掺杂电极氧化电流,这表明改性电极氧化速度比未改性的要小,可以推测改性电极性能衰减会更慢,具有较高的稳定性.
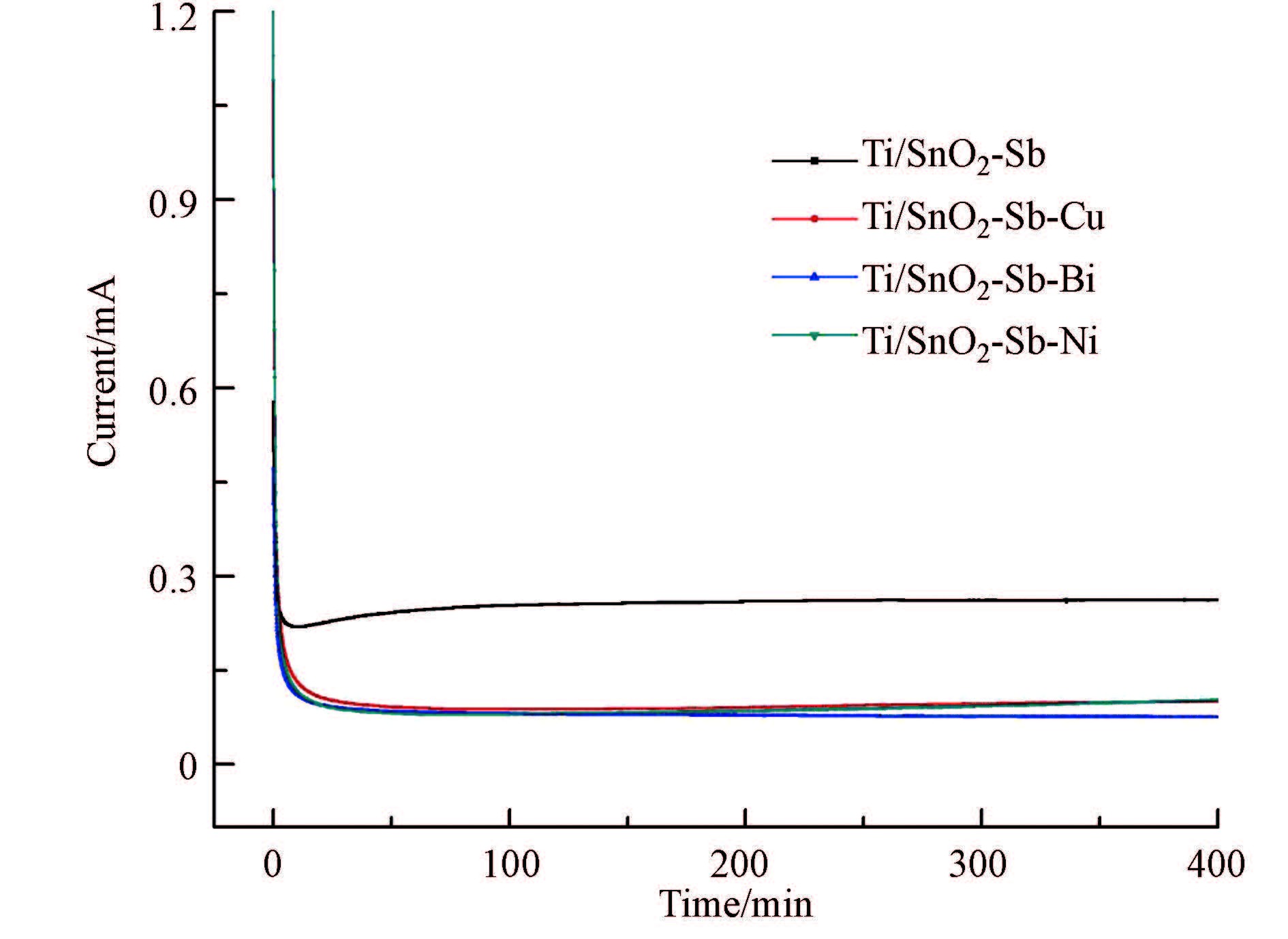
图4 电流-时间曲线
3.3.3 循环伏安曲线分析
实验分别在0.5 mol · L-1 Na2SO4溶液和0.5 mol · L-1 Na2SO4+100 mg · L-1 p-DCB溶液中对未掺杂、掺杂Cu、掺杂Bi、掺杂Ni 4种Ti/SnO2-Sb电极进行了循环伏安测试,测试结果见图 5.对比0.5 mol · L-1 Na2SO4溶液中4种不同电极的循环伏安曲线,其形状几乎相同,说明四种电极在溶液中具有相似的电化学行为.在+0.3 V(vs.SCE)附近,4条曲线都出现了一个共同的氧化峰,但是其峰电流值不同,峰电流值高有利于· OH等的生成,使其具有更高的催化活性.四种电极峰电流值大小:Ti/SnO2-Sb-Cu>Ti/SnO2-Sb-Nitalic>Ti/SnO2-Sb-Bitalic>Ti/SnO2-Sb,可知掺杂Cu的改性电极具有最优的催化活性.与图 5a相比,图 5b中未有明显的氧化峰出现,这表明p-DCB在改性电极上直接氧化不显著,而是通过间接氧化被降解的,改性电极生成的· OH等自由基具有极强的氧化能力,能够迅速氧化降解有机物,使得电极对p-DCB有较高的电催化氧化能力.

图5 不同改性电极的循环伏安曲线
3.4 1,4-二氯苯的电催化降解分析
3.4.1 不同电极对p-DCB的降解
以石墨为阴极,自制电极为阳极,在电压15 V,板间距1 cm的条件下进行电催化降解实验.发现4种电极均能降解p-DCB,但是改性后的Ti/SnO2-Sb电极对p-DCB的降解效果更好,说明掺杂金属能提高电极的催化性能.这是由于SnO2具有电子型半导体的特性,这类半导体的自由电子浓度远大于空穴浓度,适当的掺杂金属元素可增加自由电子的浓度,并在提供电子的同时在半导体材料中形成半导体能带,在SnO2内层导体中引入深能级杂质能带,为电子的传输提供一个能级较低的通道,有利于进一步改善电极材料的导电性能.
如图 6所示,各电极反应开始阶段p-DCB的去除率上升较快,特别是Ti/SnO2-Sb-Cu电极,在电解30 min后,对p-DCB的去除率达到了68.3%,掺Bi和掺Ni电极对p-DCB降解率分别为32.4%和45.7%,而未掺杂的Ti/SnO2-Sb电极对p-DCB的去除率只有26.6%.4种不同电极对p-DCB的降解能力与3.3.3节中循环伏安测试得出的电极催化活性顺序一致.随着反应时间的延长,p-DCB去除率趋势逐渐变缓,这是因为在电解刚开始时,p-DCB的浓度较高,溶液和电极表面存在较高的浓度梯度,传质作用较强,因此各电极上p-DCB降解速率很快,但是随着反应的进行,体系中p-DCB浓度已经大大降低,同时体系中产生的中间产物对p-DCB降解也有一定的竞争作用,所以p-DCB在各电极上的去除率随电解时间的延长逐渐减慢.
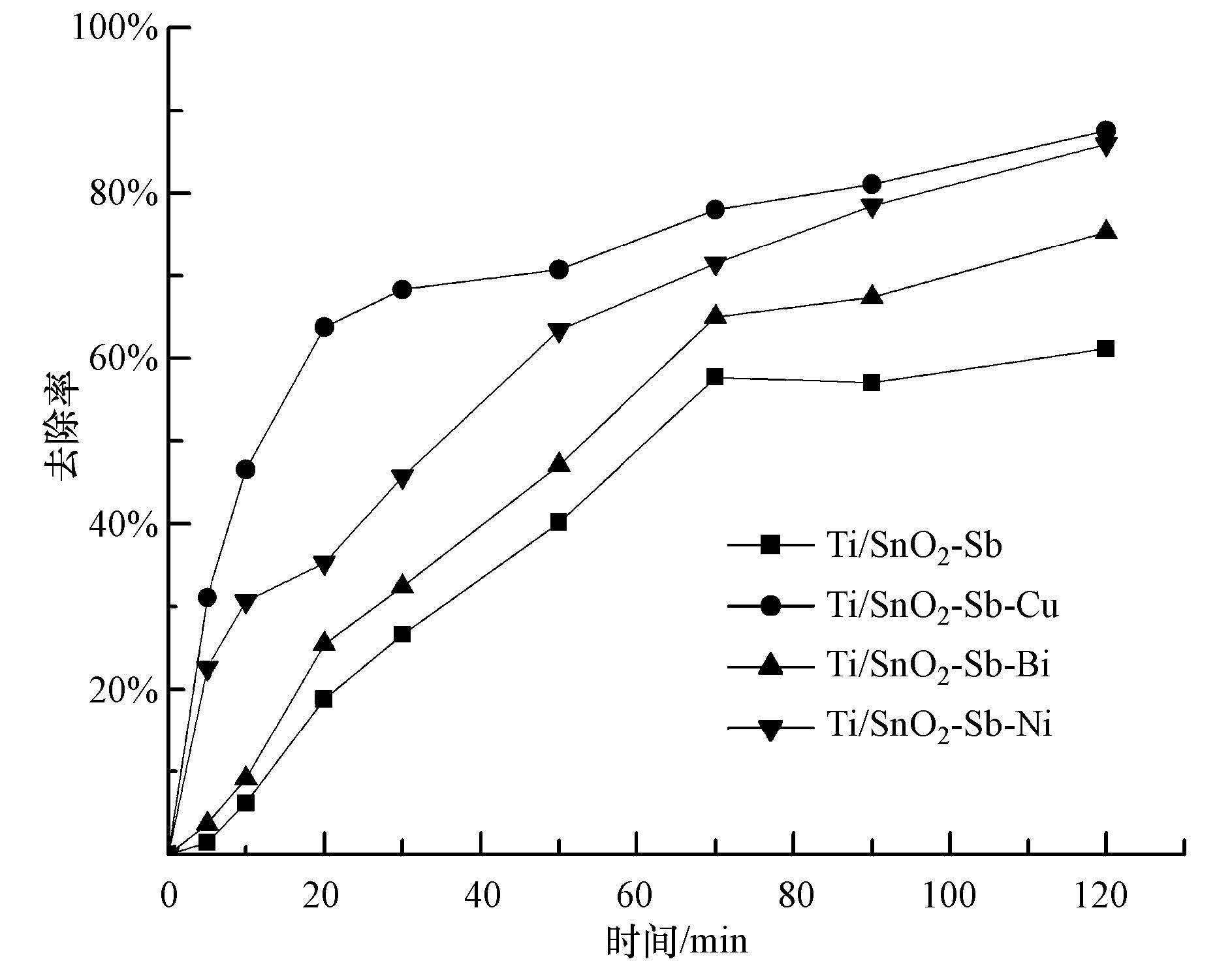
图6 不同电极对1,4-二氯苯的降解曲线
3.4.2 p-DCB降解机理初探
有机物在金属氧化物阳极表面的降解机理可分为两类:一类是直接氧化,即有机物吸附在电极表面通过电子转移而发生的氧化反应;一类是间接氧化,即利用电化学反应过程中产生的有活性的中间产物(· OH等)氧化有机物.在实际电化学反应体系中,两者并没有明显的界限,一般都是同时进行的.
NaHCO3作为水中羟基自由基的清除剂,可以阻止· OH对p-DCB的氧化,使p-DCB的降解率降低;反应体系中产生的· OH越多,碳酸氢钠的阻滞作用就越强.从循环伏安测试得出p-DCB在改性电极上直接氧化不显著,为了进一步探究改性Ti/SnO2-Sb电极对p-DCB的降解是哪种机制起主要作用,通过向反应体系中加入一定量的NaHCO3进行验证,结果如图 7所示.图中显示,电解持续2 h后,加NaHCO3的体系中p-DCB的去除率只有52%,比未加NaHCO3的条件下低了35.6%,可见加入NaHCO3后(体系中的· OH降低),p-DCB的去除率大幅降低,间接说明改性Ti/SnO2-Sb电极对p-DCB的降解主要是羟基自由基起作用,即间接氧化.

图7 碳酸氢钠对P-DCB降解效果的影响
3.4.3 动力学方程
在电解过程中,Ti/SnO2-Sb电极对p-DCB的降解主要是电催化反应过程产生氧化能力极强的· OH与有机物作用,将其氧化降解,根据绝对速率理论,可用下式表示有机污染物的反应动力学方程:-ln(Ct/C0)=kt;式中C0和Ct分别为p-DCB的初始浓度和降解时间为t时刻时溶液中p-DCB的浓度,k为一级反应速率常数.对实验数据进行模型拟合(图 8),拟合的相关系数均大于0.95,说明在研究范围内p-DCB在各电极上的降解过程均遵循一级反应动力学规律,得到各电极的动力学参数见表 2.

图8 动力学模型拟合
表2 各电极的动力学参数
反应速率常数越大说明有机物的降解速率越快,从表中可以看出在相同条件下,p-DCB在各电极上的反应速率常数由大到小依次为KTi/SnO2-Sb-Cu,KTi/SnO2-Sb-Ni,KTi/SnO2-Sb-Bi,KTi/SnO2-Sb.因此p-DCB在Ti/SnO2-Sb-Cu电极上的降解速率最快,在Ti/SnO2-Sb电极上的降解速率最慢,可见金属元素的掺杂对p-DCB的降解起到了促进作用.
4 结论
1)通过掺杂Cu,Bi,Ni 3种非贵金属对Ti/SnO2-Sb电极进行改性.掺杂金属后电极表面形貌有所改善,表面呈现无数细小蜂窝状小孔结构,不仅增大电极的比表面积,而且增加活性点位数,提高其电催化活性。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
2)对各电极进行电化学性能测试得出:各电极的析氧电位均在1.7 V(vs.SCE)以上,处于较高的析氧电位,具有较高催化活性和电流效率;循环伏安测试发现掺杂Cu的改性电极具有最优的催化活性;电极的电流-时间曲线表明,4种电极的氧化电流基本恒定,金属掺杂改性后电极氧化电流明显低于未掺杂电极,说明改性电极具有较高的稳定性.
3)对p-DCB的电催化降解实验表明,与未改性的Ti/SnO2-Sb电极相比,掺杂金属改性后的电极对p-DCB的降解效果更好,尤其是Ti/SnO2-Sb-Cu电极电催化性能最好,对p-DCB的降解效率也最高,电解2 h后p-DCB的去除率达到87.6%.
4)通过对比加入羟基自由基清除剂前后的p-DCB降解效果,说明改性Ti/SnO2-Sb电极对p-DCB的降解主要是电化学反应过程中产生强氧化能力· OH的间接氧化作用,且p-DCB的降解过程符合一级动力学方程.