1 引言(Introduction)
人工快渗系统(Constructed Rapid Infiltration, CRI)兼具了污水快渗土地处理系统和人工构造湿地系统的优点, 其基建投资少、工艺操作简便、运营成本低, 特别适合中小城镇生活污水、受污染地表水、分散污水及市政管网尚未覆盖的边远地区污水的处理.然而随着有机物的逐级降解, CRI系统后续反硝化段C/N值偏低, 总氮去除率仅为10%~35%, 不能达标排放, 限制了其进一步推广应用.目前, CRI系统强化脱氮研究多集中在添加碳源、优化填料结构、分段进水等方面, 由于这些方法仍然依赖于传统硝化反硝化过程, 随着碳源的消耗和反硝化菌活性的降低, 系统长期运行的效果并不理想, 且在实际运行中由于操作复杂、稳定性差而难以应用.因此, 如何实现CRI系统高效低耗脱氮成为其应用推广的技术难点和研究热点.
近年来, 短程硝化反硝化工艺突破了传统反硝化对碳源的限制, 整个脱氮过程经NH4+-N→NO2--N→N2完成, 具有反应历时短、耗氧量低、节约碳源等优势, 为生物处理低C/N值废水提供了新途径.短程硝化作为该工艺的起始步骤, 保持较高的亚硝氮积累率对最终脱氮效能的提升至关重要.目前, 国内外学者通过对DO、温度、pH、水力停留时间、游离氨等单因素或多因素联合控制实现了SBR、A/O、MBR、ABR等工艺的短程硝化,但是针对CRI系统内短程硝化发生机理和调控方法的研究尚未见报道.
由于CRI系统内基质处于非流动体系, 进水条件随着填料深度的增加也随之发生变化, 单纯依靠过程控制难以实现系统内亚硝氮的有效积累.此外, 由于易受水质波动和环境条件改变的影响, 上述方法仍存在过程控制复杂、亚硝化不稳定或效率低的问题.根据文献报道, 一些化学物质如氯、氯酸盐、硫化物、羟胺、叠氮化钠等可对参与硝化反应的氨氧化菌(Ammonia Oxidation Bacteria, AOB)和亚硝酸盐氧化菌(Nitrite Oxidation Bacteria, NOB)产生不同作用,通过控制适宜的抑制剂浓度可以选择性淘汰NOB而对AOB影响较小, 因而可以作为快速启动短程硝化的控制因素.基于此, 从经济、简便、易行的角度出发, 本研究选择羟胺(NH2OH)作为微生物活性抑制剂, 探讨其对CRI系统内氮素转化的影响机制及形成亚硝氮积累的可行性, 以期找到能快速启动CRI系统短程硝化的最适羟胺添加量与添加方式.同时, 选择实际运行中较易控制且影响较为显著的进水pH值作为协同调控因子, 考察能有效提高或稳定AOB亚硝化效果的最适pH范围, 为实现CRI系统后续短程反硝化的高效脱氮提供基础, 推进其在污水短程脱氮领域的应用.
2 材料与方法(Materialsandmethods)2.1 试验装置
本试验所采用的CRI反应器如图 1所示.装置采用PVC材料制作, 柱高120 cm, 内径16 cm.填料高100 cm, 自上而下每隔20 cm设置一处取水口, 内置滤布防止填料随水流出, 另一侧每20 cm填料段层间设置一处采土口.采用环形布水管均匀布水, 可调流速泵和转子流量计调节进水量, 继电器控制进水时间, 试验期间控制温度(28±2) ℃.

图 1试验装置示意图
2.2 试验进水与挂膜启动
CRI系统采用接种挂膜启动, 采用粒径分别为0.25~0.35 mm、1.0~2.0 mm、1.0~1.3 mm的天然河砂、大理石砂、沸石砂及取自于成都某污水处理厂(A2/O工艺)二沉池的回流污泥按照质量比6:1:1:2均匀混入柱内.由于CRI系统采用干湿交替自然复氧并依靠重力推进水流动, 本试验仅接种适量活性污泥的目的在于引入活性微生物的同时不会造成系统堵塞.
试验进水采自西南交通大学犀浦校区化粪池的生活污水, 通过自来水稀释或添加CH3COONa、NH4Cl、KH2PO4、KNO3等配制而成, 主要水质指标COD、NH4+-N、NO2--N、NO3--N浓度范围分别为120~160、45~50、0.01~0.05、0.35~0.5mg·L-1, pH 7.2~7.5.通过逐步提升水力负荷的方式启动CRI系统, 每周期运行6 h, 湿干比1:4, 每隔1 d监测1次出水水质.经过45 d后, CRI系统水力负荷达到1.0 m·d-1, COD和NH4+-N去除率均稳定在75%以上、镜检生物相良好, 系统趋于稳定, 完成挂膜.
2.3 试验方案
采用4组同等条件下启动的CRI系统, 编号C1~C4, 根据相关文献(Kindaichi et al., 2004;Xu et al., 2012)及前期预实验的结果, 4个反应器每周期进水分别添加0.3~1.0 mmol·L-1羟胺, 每天运行结束时取水检测, 当氨氮去除率和亚硝氮积累率趋于稳定后, 停止投加羟胺继续运行若干周期观察氮素的变化, 同时采集各阶段运行结束时不同深度范围内的填料, 根据AOB和NOB的空间分布情况及活性, 分析羟胺对两类功能菌的影响差异及原因, 确定能有效抑制亚硝氮氧化的羟胺添加浓度范围.在最佳羟胺添加模式下, 根据AOB对pH的适应范围, 调整进水pH值分别至7.2~9.0, 分析系统中氮素的变化情况, 以此确定最有利于实现CRI系统短程硝化稳定运行的pH范围.
2.4 分析项目及测试方法
NH4+-N、NO2--N、NO3--N检测分别采用纳氏试剂分光光度法、N-(1-萘基)-乙二胺分光光度法、酚二磺酸光度法;pH采用雷磁PHS-3C+酸度计;AOB和NOB计数采用MPN多管发酵法;微生物活性采用比耗氧速率(SOUR)表征, 为减少有机物耗氧速率的干扰, 本试验中仅采用NH4Cl与自来水配制成NH4+-N浓度为50 mg·L-1的溶液作为基础营养液.
3 结果与分析(Resultsandanalysis)3.1 羟胺对氮素污染物转化的影响
第Ⅰ阶段是未添加羟胺时CRI系统内氮素污染物的转化情况.由图 2可知, 该阶段的硝化类型以全程硝化为主, 亚硝氮积累率仅为3%~5%, 出水中含有大量的NO3--N和少量未转化的NH4+-N.由于100 cm处的COD去除率均维持在90%以上, 如果出水直接进入反硝化脱氮将因碳源不足而出现NH4+-N去除率较高、TN去除率偏低的问题.
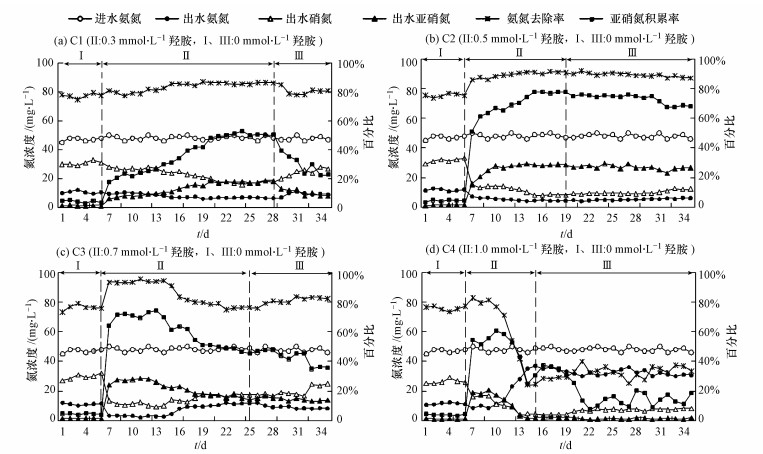
图 2氨氮去除和亚硝氮积累随羟胺添加的变化
第Ⅱ阶段在各系统进水中添加不同浓度羟胺后, 初期氨氮去除率和亚硝氮积累率均出现不同程度的提升.经过前4个周期连续添加羟胺后C1~C4反应器的亚硝氮积累率分别较未添加时提高了14.5%、47%、60.1%、49.8%, 此时C1反应器仍以全程硝化为主, 其余反应器则在受到较高浓度羟胺(0.5~1.0 mmol·L-1)冲击后迅速呈现出向短程硝化转变的趋势.此后, C1和C2反应器内的亚硝氮积累率逐步提高, 分别在连续添加羟胺22 d、13 d后趋于稳定, 最终亚硝氮积累率各为51.3%、77.9%.C3反应器内亚硝氮积累率在前11 d均超过60%, 但从第12 d开始缓慢下降, 第19 d时稳定在45%左右, 这表明羟胺添加量为0.7 mmol·L-1时在反应初期主要对亚硝氮氧化过程具有较强的抑制效应, 但随着运行时间的延长同时开始抑制氨氧化过程, 因此该羟胺浓度可作为NH4+-N向NO2--N转化的抑制点.而C4反应器在添加羟胺8 d后亚硝氮积累率出现大幅下降, 可能是高浓度羟胺持续添加导致系统内微生物中毒, 进而使得亚硝化、硝化过程均受到严重抑制.此外, 各反应器的氨氮去除率与亚硝氮积累率呈现出基本一致的变化规律, 除C4反应器外, 其余羟胺添加量下的氨氮去除率均有所提高, 其中C2从第7 d起一直高于90%直至阶段Ⅲ结束.
第Ⅱ阶段除C3、C4反应器出水中检测出明显的羟胺残留外, 其余反应器出水中仅含有微量羟胺, 为进一步减少羟胺用量, 同时避免由于羟胺长期添加导致的潜在毒性和累积二次污染, 在阶段Ⅱ运行稳定后进入第Ⅲ阶段:进水中不再添加羟胺.此时, C1、C2、C3反应器的亚硝氮积累率分别维持30%、70%、40%以上的天数为3 d、12 d、7 d, 之后均表现出下降趋势, 但C2反应器的下降幅度相对最小, 经16 d不添加羟胺运行后氨氮去除率和亚硝氮积累率依然达到87.2%、68.1%, 可见0.5 mmol·L-1羟胺连续添加13 d后对CRI系统的硝化抑制具有较强的稳定性, 即使不再添加羟胺时这种抑制作用依然保持着较高的不可恢复性, 削弱了NO2--N向NO3--N的转化能力.C4反应器的波动较大, 虽然亚硝氮积累率有上升趋势, 但是NO2--N和NO3--N的含量均较低, 出水中含有大量未能转化的NH4+-N.由此可见, 高浓度羟胺持续添加后对CRI系统的亚硝化和硝化过程的抑制均表现出较强的不可逆性, 因而经20d的恢复期后C4反应器的氨氮去除率依然较低.
3.2 羟胺对硝化菌的影响3.2.1 空间分布
为解析羟胺添加对CRI系统内氮素污染物迁移转化的影响机制, 试验对阶段I~Ⅲ运行结束时各反应器在不同填料深度范围内的AOB、NOB进行了定量分析(单位:个·g-1干填料).从图 3a可知, 羟胺添加前各CRI系统内AOB和NOB的数量和空间分布基本保持在同一水平且都随着填料深度的增加而依次减少, 0~80 cm填料段内聚集了超过90%的AOB和NOB, 故NH4+-N的主要转化过程也是发生在该段内, 而80~100 cm段由于营养物质缺乏致使各类微生物生长代谢缓慢、数量较少, 对CRI系统内氮素转化的贡献也相对较小.

图 3 AOB和NOB数量及空间分布变化
不同浓度羟胺持续添加至稳定运行后, CRI系统内AOB、NOB及AOB/NOB均发生了显著变化.由图 3b、c可知, 羟胺对微生物量的影响主要也集中在0~80 cm段内, 这与末段微生物量本身较少及随着吸附作用和化学反应的发生导致羟胺的浓度逐级递减有关.从全段平均数量来看, 第Ⅱ、Ⅲ阶段后C1和C2反应器内的AOB量与第Ⅰ阶段基本持平, 但是第Ⅱ阶段后的NOB量分别减少了26.3%、77.1%, AOB/NOB则分别由2.118、2.098上升至2.824、9.231, AOB的数量优势为实现CRI系统的短程硝化提供了基础, 同时表明了0.3~0.5 mmol·L-1羟胺持续添加一段时间后仅对NOB的生长代谢产生了抑制而对AOB的影响可以忽略, 在该范围内羟胺浓度越高对NOB的抑制效应越明显.停止加药一段时间后, C1内的NOB量回升至4.9×106个·g-1, 而C2的NOB量仅为1.6×106个·g-1、AOB/NOB为6.813, AOB依然占据较大优势, 分析认为, 使用羟胺为抑制剂时, 其对NOB的抑制作用具有一定的不可逆性, 这可能与羟胺作为一种还原剂, 在特定浓度下能对硝化细菌进行选择性杀灭有关(宋学起和彭永臻, 2005), 因而不再添加羟胺时硝化反应恢复较困难而亚硝化反应仍然继续, 徐光景、宋学起、葛丽萍等在研究氯或氯化物对短程硝化影响的过程中也发现了类似的现象(Xu et al., 2011a;宋学起和彭永臻, 2005;葛丽萍等, 2011).因此, 0.5 mmol·L-1羟胺可作为能促进CRI系统向短程硝化转化的有效NOB抑制浓度, 当羟胺浓度低于该值时, 对NOB的抑制作用将在经历一定时间的适应后减弱或消失.
阶段Ⅱ结束时, C3、C4反应器内的AOB和NOB均受到不同程度的抑制, 尤其是C4反应器中, 这两种菌的平均数量仅各为1.96×106、0.44×106个·g-1, 而AOB/NOB>4反映出该浓度下羟胺对NOB的抑制作用强于AOB, 因而NOB的消减速率更快, 由于两种功能菌数量均大幅下降, 氨氮去除率和亚硝氮积累率并没有随着AOB占比的增大而提高.经过阶段Ⅲ后C3、C4反应器的AOB量分别回升了3.8×106、1.5×106个·g-1, 这表明羟胺浓度越高, 受抑制后AOB活性的恢复速率也越慢.
3.2.2 比耗氧速率
氨氮的硝化过程属于好氧反应, 通过比耗氧速率(SOUR)的变化可以表征AOB和NOB的(亚)硝化活性强弱.试验将各CRI系统中不同层位的填料分别混合均匀后测试SOUR, 采用抑制系数Yi反映羟胺添加(阶段Ⅱ)对微生物活性的抑制程度, 计算式:Yi=(SOURI-SOURⅡ)/SOURI;采用解抑系数Yr反映羟胺停止添加(阶段Ⅲ)后微生物活性的恢复程度, 计算式:Yr=(SOURⅢ-SOURⅡ)/SOURⅢ.
从表 1可以看到, 抑制系数Yi与羟胺添加浓度之间具有较好的正相关性, 羟胺浓度为1.0 mmol·L-1时系统的受抑制程度最高, 而解抑系数Yr与羟胺添加浓度之间并没有表现出对应的负相关性, 解抑系数C1>C3>C4>C2, C2反应器停止添加羟胺后依然保持良好的亚硝化效果, 因此可以推测0.5 mmol·L-1羟胺抑制的主要是NOB的耗氧速率, 此时解抑系数仅为0.033, 表明受抑制的NOB活性难以恢复.类似地, 其他反应器内的SOUR变化情况与2.1节中氮素转化的规律及2.2.1节中AOB与NOB的数量关系也表现出较强的一致性.
表 1 不同阶段微生物的比耗氧速率及抑制/解抑系数
3.3 pH协同调控强化短程硝化
羟胺抑制虽然实现了CRI系统由全程硝化向短程硝化的快速启动, 但是亚硝氮积累率相对较低或存在波动, 为改善这一问题, 选择短程硝化效果最好的C2反应器在第Ⅲ阶段结束时, 调整进水pH值分别至7.2、7.5、7.8、8.1、8.4、8.7、9.0, 运行稳定后分析系统内氮素污染物的变化情况.
由图 4可知, 进水pH在7.2~7.5时氨氮去除率和亚硝氮积累率增长较缓慢, 当进水pH升至8.1时出现“跃点”, 亚硝氮积累率增幅达13%, 该点过后CRI系统的亚硝氮积累率一直保持在85%以上.当pH继续升高至8.4后, 氨氮去除率和亚硝氮积累率均超过90%, CRI系统短程硝化效果显著.此时继续提高进水pH, 氨氮去除率呈现下降趋势, 进水pH增至9.0时亚硝氮积累率出现“落点”, 较进水pH为8.7时降低了3.3%, 之后的亚硝氮积累率虽然仍保持在90%左右, 但是氨氮去除率仅为82%左右, CRI系统短程硝化效能开始逐渐下降.综合来看, 进水pH为8.1~8.4时最有利于CRI系统短程硝化效果的稳定与提高.

图 4不同进水pH下氨氮去除和亚硝氮积累的变化
4 讨论(Discussions)4.1 羟胺抑制机理分析
目前, 关于羟胺对(亚)硝化过程影响的报道相对较少, 对其抑制机理的研究也欠深入.Kindaichi T等在自养型硝化生物膜中加入羟胺后发现其能刺激部分亚硝化的发生, 而低浓度的盐酸羟胺(250 μmol·L-1)加入即可完全抑制NOB的生长(Kindaichi et al., 2004);Xu G J等研究了在pH为8.0左右时, 投加10 mg·L-1羟胺后SBR反应器中快速出现亚硝氮积累现象, 平均积累率高达99.8%, 并通过FISH检测证明了AOB远远高于NOB(Xu et al., 2012);Hu SS发现当羟胺浓度达到91 mg·L-1时, NOB的活性受抑制程度达到92%(Hu, 1990).本研究认为0.5 mmol·L-1羟胺能有效抑制NOB活性而对AOB影响较小, 该添加量下CRI系统的亚硝氮积累现象最为显著且稳定性较好, 虽然关于羟胺抑制浓度的结论不尽相同, 可能与反应器和反应条件的不同有关, 但相同的是都证明了羟胺对NOB具有选择性抑制作用.
从生物化学的角度看, 硝化过程并不仅仅是简单的从NH4+-N氧化成NO2--N再进一步氧化成NO3--N的过程, 它涉及多种酶和中间产物, 并伴随着复杂的电子(能量)传递, 其过程涉及的主要反应式如下(Ge et al., 2015):
氨转化成羟胺:
羟胺转化成亚硝酸:
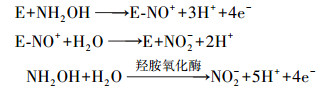
亚硝酸转化成硝酸:
由反应式(1)和(2) 可知, 在亚硝化反应过程中, AOB利用氨单加氧酶(AMO)将氨氧化生成NH2OH和H2O, NH2OH经羟胺氧化酶(HAO)的催化再被氧化生成NO2--N, 进入反应式(3) 由NOB在亚硝酸氧化酶(NOR)的作用下转化成NO3--N.因此, 羟胺作为硝化反应的关键中间产物, 对整个硝化过程的平衡起着“承上启下”的作用(Harper et al., 2015).本研究中, 外源羟胺的引入极有可能破坏了这种平衡关系, 当少量羟胺(0.3~0.5 mmol·L-1)添加时将刺激AMO和HAO酶活性, 有利于维系AOB的生长代谢进而促进氨氧化生成NO2--N, 而羟胺过量(0.7~1.0 mmol·L-1)时将同时对AMO、HAO和NOR产生毒性抑制, 由于NOR抵御羟胺毒性较AMO和HAO弱, 这种抑制作用随着羟胺浓度的增高而不断加强, NOR酶活性的降低使NO2--N氧化效率变低, NOB的种类和数量因营养供给不足而减少、整体活性下降, 导致NO2--N不断积累, 促成CRI系统内发生短程硝化, 这与Sinha和Annachhatre(2007)、Ge等(2015)的研究结论基本一致.
4.2 pH调控机理分析
AOB和NOB对环境酸碱度较为敏感, 进水pH是影响短程硝化效能的一个重要决定因素.这种影响主要体现在两个方面:①微生物需要在适宜的pH环境下进行新陈代谢, pH过高或过低都会影响细胞膜的通透性及表面带电性进而影响生长繁殖, 已报道的不同硝化菌在不同反应体系的适宜pH范围有所差异(Peng and Zhu, 2006;Park et al., 2007;Jiménez et al., 2011), 但基本上可以认为混合体系中AOB和NOB的最适pH分别在8和7附近, 该特性为控制这两类菌的优势增长提供了基础;② pH值还会影响溶液中游离氨(Free Ammonia, FA)的浓度, 计算公式(Ge et al., 2015)如下:
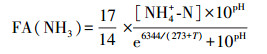
适宜浓度的FA可作为AOB的氨氧化基质加速亚硝氮积累, 而FA浓度偏高时又会抑制AOB和NOB的活性.目前, 关于FA抑制浓度的研究结论存在差异, Anthonisen等的早期研究发现FA对AOB和NOB的抑制浓度分别为10~150、0.1~1.0 mg·L-1(Anthonisen et al., 1976);Kim等发现NOB在FA为0.7 mg·L-1时活性降低50%(Kim et al., 2006);Christian等则认为AOB的FA抑制浓度>5 mg·L-1, 产生严重抑制的FA浓度约为40 mg·L-1, 而FA对NOB的完全抑制浓度仅为0.6 mg·L-1(Fux et al., 2002).虽然这些研究得出的FA抑制浓度不同, 但均反映出NOB对FA更敏感.
本研究中pH为7.2、7.5、7.8、8.1、8.4、8.7、9.0时对应的FA浓度均值分别为0.7、1.5、2.9、5.6、10.2、16.9、26.5 mg·L-1.当pH≤7.5时, FA处于较低值(≤1.5 mg·L-1), 不能满足AOB对氧化基质的需求, 不利于AOB生长, 因而亚硝氮积累率增长缓慢;FA浓度随着pH的提高而逐步提升, 亚硝化效果也随之提高, 第11d时FA浓度升至5.6 mg·L-1, 此时出现的“跃点”可认为是NOB活性在继羟胺抑制后进一步受到严重抑制的开始, FA浓度升至10.2 mg·L-1时亚硝化效果依然较好, 可见AOB在该FA浓度范围内表现出比NOB更强的适应性(Wu et al., 2012;Sun et al., 2015);但这并不意味着FA浓度越高CRI系统的亚硝化效果越好, 第26 d时亚硝氮积累率出现“落点”, 表明pH≥9.0时过高的FA浓度(≥26.5 mg·L-1)对AOB和NOB同时产生了显著抑制效应, 从而导致系统的短程硝化效果呈现下降趋势.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
5 结论(Conclusions)
1) 中低浓度(0.3~0.5 mmol·L-1)羟胺有利于氨氮去除和亚硝氮积累, 连续添加0.5 mmol·L-1羟胺13 d后可实现CRI系统短程硝化的快速启动, 高浓度(0.7~1.0 mmol·L-1)羟胺对硝化过程的抑制效应可逆性较弱, 0.7 mmol·L-1羟胺开始抑制氨氧化, 1.0 mmol·L-1羟胺对氨氧化和亚硝氮氧化均产生严重抑制.
2) 羟胺对AOB和NOB具有选择性抑制, 同浓度下对NOB的抑制作用强于AOB, 0.5 mmol·L-1羟胺能有效抑制NOB生长而对AOB影响较小, 微生物比耗氧速率随羟胺浓度的升高而降低, 抑制系数和解抑系数与各系统的氮素转化及硝化菌的变化具有一致性, 推测这种变化与酶活性密切相关.
3) 进水pH为8.1~8.4时有利于提高CRI系统短程硝化的运行效能及稳定性, pH≤7.5不利于AOB生长, pH=9.0时(FA浓度26.5 mg·L-1)对AOB产生明显抑制, pH=8.1时(FA浓度5.6 mg·L-1)对NOB产生明显抑制, AOB对FA的适应范围更宽、适应性更强.



