1 引言(Introduction)
近些年, 工业化的快速发展使得环境问题尤其是水污染问题日益严峻.其中, 重金属污染是引起水污染的最重要因素之一.水体中的重金属离子在痕量水平即表现出高的毒性及致癌性, 其可通过食物链的富集作用蓄积于动物体内造成持久性的危害, 并诱发多种疾病.而探究水体中重金属的去除是保障用水安全及提高水资源重复利用性的有效手段.
我国水体主要污染重金属离子包括镉(Cd)、铬(Cr)、铅(Pb)、砷(As)等, 其中, Cd(Ⅱ)和Cr(Ⅵ)具有极高的毒性.水体中重金属的去除方法主要有化学沉淀法、离子交换法、膜分离法、吸附法等, 其中, 吸附法由于高效、成本低、操作简便而倍受关注.Wu等(2000)和Zan等(2006)报道了利用液膜吸附重金属离子并同时合成纳米粒子, 去除重金属离子的同时“变废为宝”.Ge等(2013)研究发现, Al2O3纳米粒子对水溶液中的Cr(Ⅵ)具有良好的吸附性能, 吸附率可达90%.然而, 在吸附完成后, 微小尺寸的金属氧化物颗粒很难回收, 常会损失甚至带来新的污染.将Al2O3等纳米粒子固定化于羟磷灰石、蒙脱土、壳聚糖等材料上可有效解决上述问题, 但有机载体在吸附剂再生过程中容易发生不可逆分解而造成纳米粒子的损失, 这限制了这些材料的实际应用.316L多孔不锈钢(PSS, 022Cr17Ni12Mo2)是一种多孔、机械强度高的膜管, 是较为理想的金属氧化物纳米粒子固定化载体.本研究拟通过水热法合成Al2O3纳米粒子并利用悬浮粒子浸涂法将其固定于316L PSS上, 以制备多孔不锈钢基氧化铝膜.同时, 以该膜为吸附剂, 探讨其对水溶液中Cr(Ⅵ)和Cd(Ⅱ)的吸附性能.
2 试验部分(Experiment part)2.1 仪器与试剂
仪器:场发射扫描电镜(FESEM, JEOL S-4800, 日本日立公司), X射线衍射仪(D/MAX-3C, 日本理光公司), 中空纤维膜小试设备(HFM-0530, 厦门世达膜科技有限公司), 石墨炉原子吸收仪(AAS-9000, 江苏天瑞仪器股份有限公司), 高速离心机(ZONKIA, HC-3018, 安徽中科中佳公司).试验材料为自制的γ-Al2O3纳米粒子和316L多孔不锈钢(钢牌号:022Cr17Ni12Mo2, 孔径1 μm, 长30 cm, 内径8 mm, 外径12 mm).
试剂:偏铝酸钠(NaAlO2)、尿素(CON2H4)、硝酸钾(KNO3)、无水乙醇(C2H5OH)均为分析纯, 聚乙二醇(PEG 2000)、聚丙烯酸钠(PAAS 20M)均为化学纯, 所有试剂购自天津科密欧化学试剂厂;试验用水为去离子水.
2.2 试验方法
将316L PSS依次用0.1 mol·L-1 NaOH、HNO3溶液超声清洗10 min, 再用去离子水洗至中性, 最后用无水乙醇超声清洗5 min, 晾干后备用.按文献(Zhang et al., 2016)的方法制备γ-Al2O3粉体.具体方法为:将一定量的偏铝酸钠、尿素、聚丙烯酸钠依次加入50 mL去离子水中, 搅拌30 min后倒入不锈钢水热反应釜中于烘箱内140 ℃反应10 h, 结束后取出产物洗净并真空干燥12 h, 之后将干燥得到的白色粉末置于马弗炉中于500 ℃煅烧3 h获得γ-Al2O3粉体;其次, 取一定量聚乙二醇于1000 mL去离子水中, 配成分散液并加入2 g γ-Al2O3粉体(聚乙二醇与γ-Al2O3的质量比为1:7.9), 用KNO3调节溶液粒子强度为C(KNO3)=1 mmol·L-1, 再用0.1 mol·L-1的NaOH和0.1 mol·L-1的HNO3溶液调节悬浮液pH值为7.0.悬浮液于室温下超声分散15 min后通过悬浮粒子浸涂法涂覆在多孔不锈钢基体上, 最后于400 ℃烧结3 h.烧结程序为:250 ℃保温1 h, 400 ℃保温3 h, 为防止升温过快造成氧化铝膜开裂, 烧结升温过程的升温速率为1 ℃·min-1, 烧结完后随炉冷却.
2.3 吸附试验
利用经典批处理研究膜的吸附性能.将多孔不锈钢基氧化铝膜组件连接到中空纤维膜小试设备后, 于定压条件(0.1 MPa)下进行吸附操作.所有试验重复3次.
设定温度为室温, Cr(Ⅵ)、Cd(Ⅱ)的初始浓度均为5 mg·L-1, 吸附时间为8 h, 在此条件下探讨溶液初始pH对吸附量的影响, 其中, Cr(Ⅵ)的初始pH值为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0.Cd(Ⅱ)为3.0、4.0、5.0、6.0、7.0、8.0、9.0.设定Cr(Ⅵ)和Cd(Ⅱ)的初始浓度分别为2、5、10、20 mg·L-1、初始pH为最佳吸附pH, 探讨吸附时间(0、1、5、10、15、20、80、100、120、140、210、270、360、480 min)对吸附量的影响, 绘制动力学吸附曲线并获得拟合模型.在最佳吸附pH、室温、吸附时间8 h的条件下, 探讨Cr(Ⅵ)和Cd(Ⅱ)的初始浓度(0、5、10、15、20、25、30、40 mg·L-1)对吸附量的影响, 绘制吸附等温线并获得拟合模型.Cr(Ⅵ)和Cd(Ⅱ)的浓度采用石墨炉原子吸收法测定.所有试验重复3次.
吸附量采用式(1) 计算, 吸附百分率r采用式(2) 计算.吸附动力学数据利用准一级、准二级吸附动力学模型(Ho et al., 1999)进行拟合, 其方程见公式(3)、(4).吸附热力学数据利用Langmuir(Langmuir, 1918)、Freundlich(Freundlich et al., 1939)吸附等温线模型拟合, 其方程分别见式(5)、(6).
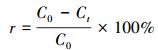
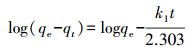
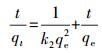

式中, C0及Ct分别为吸附前和吸附t时刻溶液中重金属的浓度(mg·L-1);V为溶液的体积(L);m为316L不锈钢Al2O3膜的质量(g);qt、qe分别为t时刻和吸附平衡时氧化铝膜对重金属离子的吸附量(mg·g-1);Qmax为膜对重金属离子的最大吸附量(mg·g-1);Ce为溶液中剩余重金属离子的浓度(mg·L-1);k1、k2 、KL 、Kf和1/n均为模型常数.
3 结果与讨论(Results and discussion)3.1 多孔不锈钢基氧化铝膜的表征
316L多孔不锈钢基体及氧化铝膜首先通过SEM形貌图来表征.由图 1a可知, 未经过处理的316L PSS表面呈现多孔结构且孔隙分布较均匀.利用氧化铝悬浮溶液涂膜后, 膜的表面形貌如图 1b所示.由图可知, 经过涂膜后所得氧化铝膜层连续性很好, 表面氧化铝分布均匀, 未出现局部覆盖不全的现象.图 1c为涂膜后氧化铝膜的断面形貌, 由图可知, 氧化铝颗粒均匀分布于膜表面, 根据图中标尺可知其厚度约20 μm, 未出现裂纹和分布不均的现象.图 1d为316L PSS涂膜前后的XRD图谱, 其中, 图谱e为涂膜前316L PSS的XRD图谱, 图谱f为涂膜后的XRD图谱.由衍射图谱f可知, 3个峰(311)、(400)、(440) 分别对应γ-Al2O3晶体的特征晶面(No.10-0425), 表明本试验所得氧化铝为γ相的Al2O3.与图谱e相比, 图谱f同时存在316L PSS和γ-Al2O3的特征峰, 表明氧化铝颗粒已通过悬浮粒子浸涂法成功固载于多孔不锈钢基体上.

图 1 316L多孔不锈钢基体表面(a, ×500)、氧化铝膜表面(b, ×500, 插图为氧化铝膜表面形貌, ×8000)、氧化铝膜断面(c, ×1000) 形貌及涂膜前后的316L不锈钢基XRD图谱(d)
3.2 多孔不锈钢基氧化铝膜对Cr(Ⅵ)和Cd(Ⅱ)的单一吸附性能3.2.1 吸附pH的影响
根据溶度积理论, Cd(Ⅱ)的Ksp(Cd(OH)2)=2.5×10-14, 高浓度和高pH值会使Cd(Ⅱ)在水溶液沉淀(Dong et al., 2010).因此, 试验将Cd(Ⅱ)和Cr(Ⅵ)的初始浓度均设定为5 mg·L-1, 分别在3.0~9.0和3.0~11.0范围内探讨pH对吸附的影响.
初始pH对Cr(Ⅵ)和Cd(Ⅱ)吸附率的影响如图 2所示.由图 2可知, Cr(Ⅵ)的吸附率在pH为3.0~4.0时较为稳定, pH=4.0时吸附率可达100%, 当pH>4.0时吸附率不断降低直至趋近于零.相反, Cr(Ⅵ)的吸附率随pH的增大不断增大, 最后达到最大吸附率100%.该结果显示, 初始pH对氧化铝膜吸附2种重金属离子均有较大影响, 这可能是不同pH影响多孔不锈钢基氧化铝膜的表面荷电性质及离子本身的电离态的原因.氧化铝膜对水溶液中单一存在的Cr(Ⅵ)的最佳吸附pH为3.0~4.0, 对Cd(Ⅱ)的最佳吸附pH为8.0~9.0.
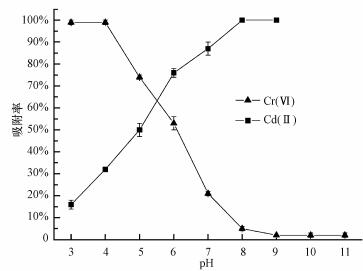
图 2溶液初始pH值对Cr(Ⅵ)和Cd(Ⅱ)吸附率的影响
3.2.2 吸附动力学
多孔不锈钢基氧化铝膜对水溶液中单一存在的不同浓度Cr(Ⅵ)和Cd(Ⅱ)的动力学吸附结果如图 3所示.由图 3可知, 氧化铝膜对Cr(Ⅵ)和Cd(Ⅱ)的吸附量均随着吸附时间的延长而快速增大, 最后均趋于吸附平衡, 此外, 膜对2种重金属离子的吸附量随着初始浓度的增大而增大.从图 3可以看出, Cr(Ⅵ)在0~50 min内吸附量急剧增加, 而Cd(Ⅱ)在0~30 min内的吸附速率较大, 这可能是因为大多数吸附位点位于膜表面, 更易于与水溶液中的重金属离子接触, 从而使吸附量在吸附前期快速增大.
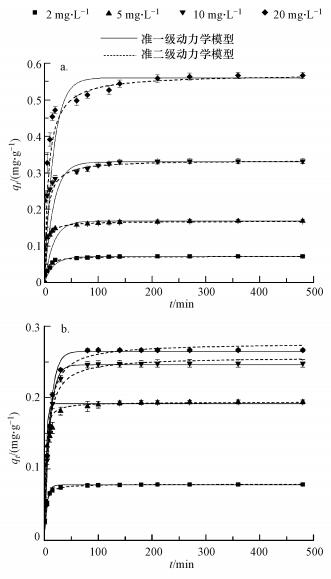
图 3 Cr(Ⅵ)(a)和Cd(Ⅱ)(b)的吸附动力学曲线
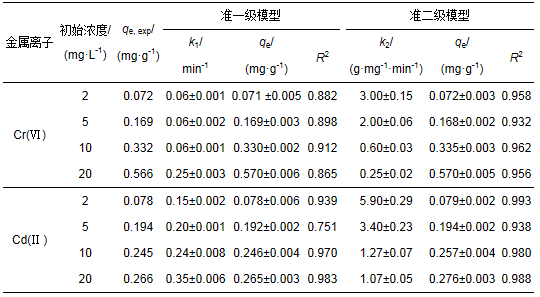
采用动力学准一级模型和准二级模型对Cr(Ⅵ)和Cd(Ⅱ)的吸附量数据进行拟合, 结果见表 1.由表 1知, 准二级模型对Cr(Ⅵ)和Cd(Ⅱ)拟合的决定系数R2均高于准一级模型, 说明准二级动力学模型能更好地解释氧化铝膜对水溶液中共存的Cr(Ⅵ)和Cd(Ⅱ)的吸附过程.可以推断, 氧化铝膜对水溶液中Cr(Ⅵ)和Cd(Ⅱ)的吸附包含了化学过程, 包括吸附质和吸附剂之间共用或转移电子产生的化合价变化(Hasan et al., 2008).此外, 吸附速率常数k2随Cr(Ⅵ)和Cd(Ⅱ)初始浓度的增加而减小, 说明重金属离子浓度越低, 吸附速率越高.
表 1 Cr(Ⅵ)和Cd(Ⅱ)的吸附动力学参数
3.2.3 吸附等温线
在室温下, 多孔不锈钢基氧化铝膜对Cr(Ⅵ)和Cd(Ⅱ)的吸附等温线如图 4所示.由图 4可知, 在相同温度下氧化铝膜对2种重金属离子的最大吸附量均随着初始浓度的增大而先增大后趋于稳定.随着Cr(Ⅵ)和Cd(Ⅱ)浓度的增大, 更多的氧化铝膜表面水化羟基等作用位点将与2种离子相结合, 当表面吸附位点饱和后, 将会有一些材料微结构内部的位点参与吸附过程, 最终使得吸附量增大.
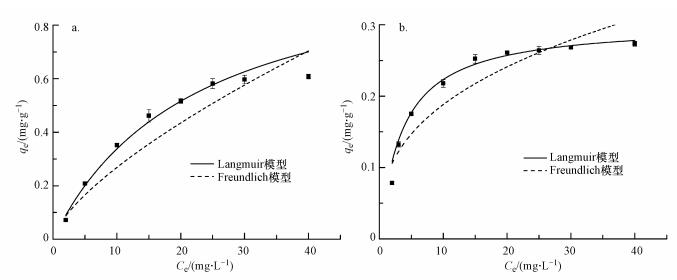
图 4 Cr(Ⅵ) (a)和Cd(Ⅱ) (b)的吸附等温线
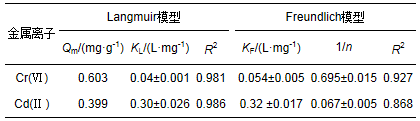
采用Langmuir和Freundlich模型分别对Cr(Ⅵ)和Cd(Ⅱ)等温吸附数据进行拟合, 结果见表 2.由表 2可知, Langmuir模型对Cr(Ⅵ)和Cd(Ⅱ)吸附拟合所得的决定系数R2最高.因此, Langmuir吸附等温线能更好地描述氧化铝膜对水溶液中单一Cr(Ⅵ)和Cd(Ⅱ)的吸附行为, 拟合得到膜对Cr(Ⅵ)和Cd(Ⅱ)的最大吸附量分别为0.603 mg·g-1和0.399 mg·g-1, 可以推测, 氧化铝膜表面的吸附位点是均匀的, 且膜对Cr(Ⅵ)和Cd(Ⅱ)的吸附是单层吸附.
表 2 室温下的Langmuir和Freundlich模型参数
4 结论(Conclusions)
通过悬浮粒子浸涂法将合成的γ-Al2O3纳米粒子固载于316L多孔不锈钢基体上, 以此作为膜组件用于水溶液中重金属离子Cr(Ⅵ)和Cd(Ⅱ)的吸附.结果表明, 经过悬浮粒子浸涂得到的膜层分布均匀, 氧化铝纳米粒子以一定的厚度覆在基体表面上, 使膜对水溶液中的重金属离子具有了良好的去除性能.氧化铝膜在不同pH下其表面荷电状态不同, 从而对正电性Cd(Ⅱ)和负电性Cr(Ⅵ)表现出了相反的吸附趋势.膜体对水溶液中Cr(Ⅵ)和Cd(Ⅱ)的吸附均符合动力学准二级模型和Langmuir吸附等温模型, 表明氧化铝膜对2种重金属离子的吸附是物理化学作用的结果, 属于均匀的单层吸附.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。