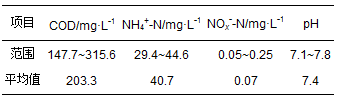序批式活性污泥法(SBR)工艺由于具有生化反应推动力大, 脱氮除磷效果好, 耐冲击负荷强, 工艺简单, 运行方式灵活和防止污泥膨胀等优点, 已成为污水生物脱氮的主流工艺之一.胞外聚合物(extracellular polymeric substance, EPS)是在一定环境条件下由微生物(主要是细菌), 分泌于体外的一些高分子聚合物.主要成分与微生物的胞内成分相似, 是一些高分子物质, 如蛋白质(PN)、多糖(PS)和核酸(DNA)等聚合物. EPS普遍存在于活性污泥絮体内部及表面, 具有重要的生理功能, 可将环境中的营养成分富集, 通过胞外酶降解成小分子后吸收到细胞内, 还可以抵御杀菌剂和有毒物质对细胞的危害[2, 3].根据EPS空间位置不同, 分为紧密附着在细胞壁上的孢囊聚合物——紧密型EPS(TB-EPS)和以胶体和溶解状态松散于液相主体中的黏性聚合物——松散型EPS(LB-EPS).国内外学者研究表明, 温度对生物脱氮效果和EPS产量均有重要影响, 该方面研究总结为以下3个方面:① 单一研究温度对生物脱氮效果的影响.汪志龙以合成废水为研究对象, 以丙酸钠作为单一碳源, 分别设置温度为5、15、25、35℃的4组序批式反应器考察了温度对单级好氧工艺生物脱氮除磷性能的影响. Guo等在5~30℃条件下, 研究了同时氮化和脱硝(SBR-SND)顺序间歇反应器的性能. Hendrickx等采用UASB, 以实际生活污水为研究对象, 探究了10℃和20℃条件下氮的去除. ② 单一考察了温度对EPS产量及组分的影响.张宝良等研究了3种温度(-20℃, 室温, 4℃)条件下, 市政污水污泥、可乐废水好氧污泥和可乐废水厌氧污泥3种污泥的EPS产量. Song等研究了常温(28℃)和低温(10℃)条件下EPS产量对活性污泥脱水性能的研究. Gao等研究了在30、20和10℃条件下, EPS在膜污染中的作用. ③ 同步研究了温度对生物脱氮效能及EPS的影响.张兰河等考察了4种温度(10±2)、(17±2)、(22±2)、(30±2)℃对A2O工艺脱氮速率及胞外聚合物的影响, 随着温度的升高, 总氮(TN)和COD去除速率逐渐上升, EPS质量浓度先降低后升高.宋成康等研究了温度降低对厌氧氨氧化脱氮效能及污泥EPS的影响, 在温度33℃→25℃→20℃→15℃范围内, EPS总含量及各组分均与温度成负相关.在生物脱氮过程中, 活性污泥是实现氮去除的功能主体, EPS是活性污泥的重要组成部分.因此, 同步考察温度对生物脱氮效能和EPS的影响, 可深入解析基于微生物EPS变化角度揭示生物脱氮本质.此外, 相关报道大多基于短期实验获得研究结果, 因此较难反映温度对EPS变化长期影响规律, 难以获得准确的EPS与生物脱氮相关性.
基于上述研究背景, 本文主要研究低温(15℃)、中温(25℃)和高温(35℃)这3种条件下, SBR生物动态脱氮效果、硝化反应类型、活性污泥中EPS及各组分的特性变化规律, 揭示温度对两者的长期同步影响, 并建立生物脱氮过程与EPS变化的相关性.
1 材料与方法 1.1 实验装置、废水特性及接种污泥
实验装置主要包括SBR反应器(内、外径分别为14 cm和15 cm, 有效容积为5 L)和自动控制系统(水温自动控制系统和过程控制系统)两部分组成.通过水温自动控系统以维持SBR反应器运行温度.借助于过程控制系统[以溶解氧(DO)、pH和氧化还原电位(ORP)为控制参数]准确指示生化反应进程.
实验用水采用人工模拟废水, 废水成分主要包括:NH4Cl(115 mg·L-1), CH3COONa(385 mg·L-1), KH2PO4(26 mg·L-1)和微量元素浓缩液.微量元素主要包括:MgSO4·7H2O(5.07 mg·L-1), MnSO4·4H2O(0.31 mg·L-1), FeSO4·7H2O(2.49 mg·L-1), CuSO4(0.25 mg·L-1), Na2MoO4·2H2O(1.26 mg·L-1), ZnSO4·7H2O(0.44 mg·L-1), NaCl(0.25 mg·L-1), CaSO4·2H2O(0.43 mg·L-1), CoCl2·6H2O(0.41 mg·L-1), EDTA(1.88 mg·L-1), 每升废水加入1mL微量元素, 废水水质见表 1.接种污泥取自甘肃省兰州市七里河安宁区污水处理厂生物循环曝气池工艺好氧段活性污泥, 该污水主要处理七里河区和安宁区的生活污水(60%~70%)和啤酒废水(30%~40%).
表 1 模拟废水水质
1.2 实验方案
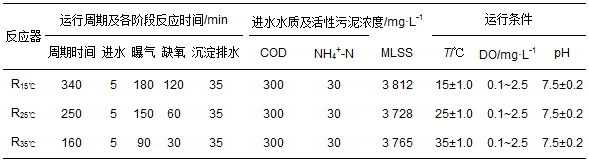
本实验开始前, 为强化接种污泥的脱氮性能, 对该接种污泥进行20 d培养驯化, 获得稳定脱氮效果后进行连续实验.污泥驯化结束后, 均分入3个运行温度分别为15、25和35℃的SBR反应器(分别表示为:R15℃、R25℃和R35℃).利用恒温循环水浴池维持反应器内混合液温度.反应器每个运行周期包括瞬时进水、曝气、缺氧搅拌、沉淀排水和闲置5个阶段.具体运行参数见表 2.
表 2 3个SBR反应器运行条件
1.3 检测项目与方法
氨氮(NH4+-N), 纳氏试剂比色法; 硝态氮(NO3--N), 麝香草酚法; 亚硝态氮(NO2--N), N-(1-萘基)-乙二胺分光光度法; COD, COD快速测定仪法.胞外聚合物(EPS):分光光度法.取10 mL泥水混合液, 采用改良型热提取法提取EPS, 其中蛋白质(PN)采用考马斯亮蓝法, 以牛血清白蛋白作为标准物质; 多糖(PS)采用苯酚-硫酸法, 以葡萄糖作为标准物质; 核酸(DNA)采用紫外吸收法.污泥浓度:混合液悬浮固体(MLSS)和混合液挥发性悬浮固体(MLVSS), 滤纸重量法.此外, pH值、DO和温度(T)采用WTW-Multi 3420测定仪监测.
2 结果与讨论 2.1 温度对SBR生物脱氮效能的影响
温度是生物脱氮过程重要的影响因素之一, 本质在于温度直接影响微生物的活性, 进而间接体现在生化反应速率、氮去除速率和硝化反应类型等方面的变化. 图 1表明3种温度条件下, 氨氮去除率, 硝化反应速率和亚硝积累率的变化规律.从图 1(a)可以看出, 整个实验过程中, 进水NH4+-N浓度维持25.6~37.2 mg·L-1之间(平均值为29.5 mg·L-1±2.8 mg·L-1). R15℃、R25℃和R35℃出水NH4+-N浓度分别为0~9.7 mg·L-1(平均值为0.9 mg·L-1±1.8 mg·L-1), 0~8.8 mg·L-1(平均值为0.7 mg·L-1±1.8 mg·L-1)和0~10.6 mg·L-1(平均值为1.0 mg·L-1±2.2 mg·L-1), 相应的去除率平均值分别为96.9%、98.3%和96.6%.实验3种温度条件下, SBR反应器均实现了较高的NH4+-N去除率, 获得了较充分的NH4+-N去除效果, 汪志龙的研究中, 15、25和35℃条件下SBR反应器NH4+-N平均去除率分别为98.9%、99.9%和99.5%, NH4+-N去除效果与本实验结果几乎一致.郭宁等研究结果显示15℃条件下, SBR反应器运行初期NH4+-N浓度为260.9 mg·L-1, 当反应进行至240 min, NH4+-N浓度降至176.5 mg·L-1, NH4+-N去除率仅为32%.笔者认为原因在于反应过程中每种温度条件下SBR系统提供了充足的反应时间, 因此, 本实验控制条件下, 在反应时间足够的前提下, 温度不会影响SBR系统NH4+-N去除率.
图 1

图 1 SBR反应器内氨氮去除效果、硝化速率和硝化反应类型的变化
硝化反应速率是衡量SBR系统脱氮效率的重要方面, 本实验研究过程中, R15℃、R25℃和R35℃系统的硝化反应速率分别为(3.2±0.26)、(4.3±0.47) 和(7.9±0.86) mg·(g·h)-1, 可见随着温度升高, 硝化反应速率显著增高[图 1(b)], 与高景峰等研究结果是一致的. 图 1(c)描述了SBR系统内亚硝态氮积累率(NiAR)的变化, 以此反映硝化过程中氮形态(NH4+-N、NO3--N、NO2--N)的转化规律.对于R15℃反应器, 硝化结束时, NiAR值为2.0%±2.98%, 表明该温度条件下, 硝化结束时, NO3--N是主要硝化产物, 也就是说, 98%以上的NH4+-N被氧化成NO3--N, 因此, NH4+-N通过全程生物脱氮途径去除.对于R25℃系统, 在第1~55周期内, 硝化结束时NiAR的平均值为1.3%±1.77%, 表明此阶段SBR系统为全程硝化.从第55周期开始, NiAR逐渐增加, 在第78周期时, NiAR达到了23.1%, 表明R25℃系统处于全程硝化向短程硝化逐步转化的过程.因此, 对于R25℃系统, NH4+-N去除基于全程生物脱氮和短程生物脱氮两种途径完成的.对于R35℃系统, 从第9周期以后, NiAR开始逐渐增加, 到第55周期时, NiAR达到了97.0%, 此后始终稳定在96.4%左右, 表明系统已经实现了稳定的短程硝化.所以, 对于R35℃系统, NH4+-N通过短程生物脱氮途径实现去除.
通过R15℃、R25℃和R35℃系统硝化类型的转变可以发现, 温度对硝化类型具有明显影响.通常认为20℃是实现短程硝化的临界温度.然而, 也有一些学者在低温( < 20℃)条件下实现了短程生物脱氮.针对短程硝化, 虽然目前尚未形成统一规范的温度界限, 但普遍的共识是, 高温是实现和维持短程硝化强有力因素.原理在于:高温条件下( > 20℃), 氨氧化细菌(AOB)增殖速率高于亚硝酸盐氧化细菌(NOB)增殖速率, AOB成为系统内优势硝化菌属, 导致亚硝酸盐积累.
2.2 温度对EPS, LB-EPS和TB-EPS含量影响
EPS是微生物在生长过程中分泌的黏性物质, 是微生物的新陈代谢产物.因此, 对于活性污泥生物脱氮系统, 温度是影响微生物生长过程的重要环境条件, 显著影响微生物的新陈代谢过程, 因而温度会对微生物EPS产量及其组分产生影响.本部分实验主要考察了温度对活性污泥中EPS含量影响. 图 2为R15℃、R25℃和R35℃系统硝化过程EPS、LB-EPS和TB-EPS的变化规律(其中EPS为LB-EPS和TB-EPS加和).从图 2(a)~2(c)可以看出, 每种温度条件下, EPS, LB-EPS和TB-EPS含量均呈现出一定的波动性.在15℃、25℃和35℃条件下, TB-EPS分别占EPS总量的79.0%±6.7%、77.9%±5.9%、70.7%±8.9%, LB-EPS占EPS总量的20.9%±6.7%、22.1%±5.9%、29.3%±8.9%, 且TB-EPS为LB-EPS的4.4±2.4、4.0±2.2、2.8±1.8倍, 因此, TB-EPS是EPS重要的组成部分. 图 2(d)反映了3种温度条件下, EPS, LB-EPS和TB-EPS含量的对比.当温度由15℃上升至35℃时, 随着温度的升高, EPS和TB-EPS含量均呈现下降趋势, 而LB-EPS含量逐渐升高.由于EPS主要来源于微生物细胞新陈代谢过程中产生或污水中携带的PS和PN, 以及微生物细胞自溶产生的DNA.结合了相关研究及实验数据两方面, 推断得到本实验15℃低温条件下(低于微生物正常生长的20℃), 微生物增殖速率较低, 大量细胞出现自溶, 释放出大量的EPS, 导致EPS含量增加.另一方面, 本实验长期低温条件, 使得微生物产生持久应激反应, 在生长过程中分泌大量代谢产物, 引起EPS含量增加.对于较高温度(25℃和35℃)条件下, EPS含量降低的原因主要在于:① 温度升高使得微生物获得了适宜的生长环境条件, 生长速率加快, 新陈代谢活动增强, 细胞分泌的高分子聚合物增多, 导致EPS含量增加; ② 温度升高也使得细胞自溶数量减少, 由细胞自溶释放出的EPS减少; 基于实验数据和文献资料, 笔者推测, 此过程中细胞自溶产生的EPS含量占主导地位, 总体表现为EPS含量减少.
图 2

图 2 不同温度条件下, EPS, LB-EPS和TB-EPS含量的变化规律
关于温度对EPS含量的影响, 研究者获得的结论也不尽相同, 主要包括以下几方面:① 随着温度的升高, EPS含量先降低, 后升高.张兰河等[11]采用A2O工艺处理模拟生活污水, 当温度从10℃±2.0℃上升至22℃±2.0℃时, EPS及其组分的含量逐渐降低.当温度从22℃±2.0℃继续增加到30℃±2.0℃时, EPS及其组分的含量逐渐升高.周健等[22]的研究发现, 当温度由10℃升至15℃时, EPS, DNA及PN含量均降低, 当温度由15℃继续升高到30℃时, EPS和PS含量明显增加, 但DNA和PN的增加量不显著. ② 温度与EPS的产量无显著的相关性. Tseng等[24]的研究认为温度与EPS的产量无显著的相关性. ③ EPS含量与温度呈负相关. Wilén等[25]发现实际活性污泥处理工艺, 在冬季, 活性污泥EPS含量高于夏季, 并且EPS、PS、PN和腐殖酸的产量均与温度呈负相关.宋成康等[7]研究了厌氧氨氧化污泥EPS与温度的关系, 在33~15℃温度范围内, 随着温度的降低, EPS及其组分的含量均升高, 表现出与温度呈负相关的趋势.
这里需要指出的是:本实验过程中, 随着温度升高, EPS和TB-EPS与温度呈负相关, 与宋成康等[7]和Wilén等[25]的研究结果是一致的, 且拟合方程为:y=-1.31x+80.19和y=-2.05x+65.12, 而LB-EPS与温度呈正相关, 与文献[7, 25]的研究结果是相反的, 且拟合方程为:y=0.75x+15.07[图 2(d)和表 3].

表 3 温度对EPS, TB-EPS和LB-EPS含量影响拟合曲线
2.3 温度对EPS, TB-EPS和LB-EPS中各组分含量影响
图 3和表 4为3种温度条件下, EPS, TB-EPS和LB-EPS中的PN, PS和DNA含量.可以清楚地反映出两方面实验现象:① 3种温度条件下, EPS[图 3(a)], TB-EPS[图 3(b)]和LB-EPS[图 3(c)]中的PN、DNA含量变化趋势几乎相同, 即15℃和25℃条件下, PN和DNA在EPS, TB-EPS和LB-EPS含量几乎保持不变, 但当温度升高至35℃时, PN和DNA含量显著降低. ② 对于PS, 其在EPS和LB-EPS含量变化趋势相似, 即15℃和25℃条件下, PS含量略微降低, 在35℃时, PS含量明显增加. PS在TB-EPS的含量随着温度的升高逐渐降低, 即27.3 mg·g-1(15℃)→25.4 mg·g-1(25℃)→24.3 mg·g-1(35℃).基于上述2方面实验结果, 笔者发现35℃是EPS, TB-EPS和LB-EPS中各组分含量的重要折点, 主要原因可能在于:在15℃和25℃温度条件下, SBR系统处于全程生物脱氮过程[图 1(c)], 异养菌、氨氧化菌和亚硝酸盐氧化菌共存于活性污泥体系.在35℃条件下的SBR系统, 为短程生物脱氮过程[图 1(c)], 异养菌和氨氧化菌是活性污泥中的主导微生物.因此, 不同温度条件引起微生物菌群差异, 进而导致活性污泥中的PN, PS和DNA含量有所不同. 图 3(d)和表 4反映了3种温度条件下, EPS, TB-EPS和LB-EPS中各组分的比例大小.可以看出, 在15℃和25℃时, PN是EPS, TB-EPS和LB-EPS中的主要成分, 其次为PS, DNA最少, 尤其在LB-EPS中, PN占LB-EPS总量的80%左右.而在35℃时, PS是EPS和TB-EPS中的主要成分(占51%和48%), 其次为PN(占43%和44%), DNA最少(占6%和8%), 在LB-EPS中, PS和PN作为主要成分, 比例均为49%, DNA仅仅占2%.实验过程中发现, 随着温度的改变, PN和PS在反应过程中变化较大, DNA含量始终维持在2%~10%相对稳定的范围内.在EPS组分中, 较容易被微生物利用的PN和PS在反应过程中被微生物降解利用, 同时细胞代谢不断产生, 两种组分共占EPS、TB-EPS和LB-EPS总量的90%~98%, 是EPS的重要成分.
图 3

图 3 EPS组分含量变化规律
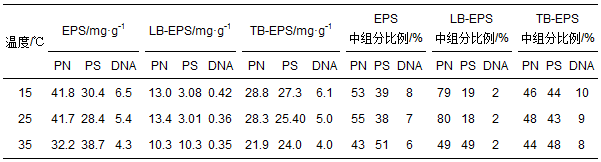
表 4 EPS组分的含量及所占比例(mg·g-1)
2.4 有机物、氮、EPS及其组分在SBR典型周期内的变化规律
图 4表明了3种温度条件下, SBR系统典型周期内有机物、氮、EPS及其各组分的变化规律.硝化反应过程, 随着反应进行, COD和NH4+-N浓度逐渐降低, NOx--N浓度逐渐升高.反硝化反应过程, COD作为电子供体被利用, NOx--N被还原成氮气, 两者浓度均逐渐降低.从EPS及其各组分浓度变化曲线可以看出, 15℃时硝化反应过程EPS、TB-EPS、PN、PS和DNA均随着反应进行不断升高, 反硝化反应过程各指标逐渐降低, 反硝化结束后, 系统进入厌氧阶段, EPS及其各组分由于细胞自溶导致浓度升高. 25℃时硝化反应过程EPS及其各组分均表现出显著降低, 后明显升高的趋势.反硝化反应过程EPS、LB-EPS、PN、PS和DNA逐渐降低, TB-EPS逐渐增加, 进入厌氧阶段后, EPS及其各组分浓度升高. 35℃时硝化反应过程EPS及其各组分略微降低, 而后增加.而TB-EPS浓度先降低, 后增加, 再降低的变化趋势.反硝化反应过程, EPS、TB-EPS及其各组分均呈现轻微增加的趋势. 3种温度条件下, 反应过程中EPS及其组分的变化规律具有一定的差异, 分析原因可能在于不同温度导致微生物活性、种类、新陈代谢过程、细胞分泌物和细胞自溶程度的差异引起的.需要指出的是, PN和PS在反应过程中浓度不断变化, 被微生物降解或细胞代谢产生.表明PN和PS更容易被微生物利用, 而DNA浓度始终维持相对稳定, 较难被微生物利用.
图 4

图 4 SBR典型周期内有机物、氮、EPS及其组分的变化规律
3 结论
(1) 温度对生物脱氮硝化类型和反应速率具有重要影响.高温条件有利于短程硝化的实现, 并获得较高的硝化速率.
(2) 温度对EPS、LB-EPS和TB-EPS含量具有一定影响.随着温度升高, 三者均呈现逐渐降低趋势.此外, EPS以TB-EPS为主(占69.0%~79.5%), 随着温度升高, TB-EPS含量逐渐降低, LB-EPS含量却逐渐上升(20.5%~31%), 导致TB-EPS/LB-EPS比值逐渐减小, 介于2.2~3.8之间.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
(3) 温度对EPS中PN、DNA和PS含量产生明显影响. PN和DNA在EPS、TB-EPS和LB-EPS中含量随温度升高而降低. PS在EPS和LB-EPS中含量随着温度升高而增加, 在TB-EPS中含量逐渐降低.此外, 15℃和25℃时, PN是EPS、TB-EPS和LB-EPS的主要成分. 35℃时, EPS和TB-EPS主要成分是PS, LB-EPS主要成分是PS和PN, 比例均为49%.
(4) 不同温度条件下, EPS及其各组分在生物脱氮过程的变化规律表现出一定差异性. 15℃时, EPS及其各组分呈现逐渐增加(硝化反应过程), 而后逐渐降低的趋势(反硝化过程). 25℃和35℃时, EPS及其各组分呈现先降低、后升高(硝化反应过程), 再轻微升高的趋势.