1 引言(Introduction)
氟是一种天然存在于土壤、水和空气中且人体必需的微量元素, 然而过量摄入氟会对牙齿和骨骼造成损害, 阻碍儿童生长和发育, 并导致多器官病变, 世卫组织建议饮用水中氟离子浓度为0.5~1.5 mg·L-1.现代工业的快速发展, 加剧了水源中氟污染, 严重威胁着人类健康.国内外对含氟污水的处理技术主要有吸附、沉淀、离子交换、膜分离和电凝结等方法,生物吸附法由于对氟化物的高去除效率和环境友好性被广泛研究。
壳聚糖是一种碱性多糖聚合物, 分子量大, 结构中的羟基和氨基对氟离子均具有较好的吸附性。羧甲基壳聚糖(Carboxymethyl chitosan, CMCTS)是壳聚糖通过化学改性得到的水溶性多糖衍生物, 正价铵离子的电荷吸附及羟基的偶极配位, 提升了对氟离子吸附能力。葡聚糖是仅由α-D-吡喃葡萄糖单体聚合而成的一种多糖, 其独特的三维空间结构, 使其具有对生物毒素、有害元素等的高吸附特性等(2015)将壳聚糖和纤维素两种物质进行复合, 并将制备的磁性微球用于污水中重金属的脱除, 提高了对重金属的脱除率, 同时材料的再生性好, 符合可持续发展的要求.这表明多糖复合物可以形成协同增效作用, 作为新型吸附材料具有良好的吸附性能和应用前景.
基于此, 本文采用两种具有高效吸附性能的羧甲基壳聚糖和葡聚糖制备复合微球, 研究协同性下复合微球对水中氟离子的吸附作用, 探讨复合微球吸附氟离子的动力学和热力学特征, 以期为污染水体中氟的脱除提供新思路.
2 材料与方法(Materials and methods)2.1 材料与试剂
羧甲基壳聚糖(食品级, 含量≥95%, 取代度85%)由江苏南通绿神生物工程有限公司提供;葡聚糖是以酵母细胞壁为原料, 以微波辅助碱-酶法提取(杨锡洪等, 2016);其它试剂均为分析纯.
2.2 仪器与设备
TGA/SDTA851e热重/同步差热分析仪(梅特勒-托利多仪器有限公司);PF-1-01氟离子选择电极(上海雷磁仪器厂);TMS-PRO质构仪(美国FTC公司);S-4800扫描电镜(日立公司);NICOLET NEXUS 470傅立叶变换红外光谱仪(美国Thermo公司).
2.3 实验方法2.3.1 羧甲基壳聚糖-葡聚糖复合微球的制备
称取羧甲基壳聚糖2.50 g于50 mL纯水中, 搅拌至完全溶解, 加入葡聚糖0.50 g, 搅拌均匀, 配制成羧甲基壳聚糖-葡聚糖混合溶液.用恒流泵以50滴·min-1的速度滴入200 mL 0.1 mol·L-1盐酸溶液中并不断搅拌呈球形颗粒, 滴完后继续搅拌5 min.用纯水洗至中性(pH试纸检测)后, 配制5%混合交联剂(2.5%戊二醛、2.5%甲醛), 以交联剂:微球=1:1(mL/g)混合后, 在40 ℃水浴加热1 h, 再于60 ℃水浴加热2 h进行交联.用纯水洗涤至中性, 4 ℃保藏备用(Xie et al., 2016).
2.3.2 羧甲基壳聚糖和葡聚糖添加量优化
羧甲基壳聚糖添加量:固定葡聚糖的添加量为1%, 分别添加4.0%、4.5%、5.0%、5.5%、6.0%的羧甲基壳聚糖, 测定微球的硬度、弹性及对氟离子的吸附率.
葡聚糖添加量:固定上述优化的羧甲基壳聚糖添加量, 分别添加0、0.5%、1.0%、1.5%、2.0%、2.5%的葡聚糖, 测定微球的硬度、弹性及对氟离子的吸附率.
2.3.3 微球结构红外表征
分别将羧甲基壳聚糖、葡聚糖和粉碎的复合微球各取1 mg, 加入0.1~0.2 g干燥的KBr混合均匀后压片, 利用红外光谱仪在400~4000 cm-1范围内扫描透光度, 扫描次数32次.
2.3.4 复合微球质构及稳定性检测
电镜扫描(SEM)检测:将复合微球真空冷冻干燥后, 在加速电压为1.00 kV的条件下电镜扫描.
质构测定:取10颗微球平铺于质构仪测量托盘上, 用压缩探头(D=35 mm)对微球样品进行连续2次挤压.仪器设置参数:测试速度为60 mm·min-1, 形变百分量50%, 触发力0.5 N, 停留2 s, 数据采集速率200 pps (packet per second).
pH稳定性:将微球分别置于H2SO4或NaOH配制的不同pH水溶液中, 浸泡1~24 h, 观察微球的表观特征及溶胀情况.
热稳定性检测:取真空冷冻干燥后的复合微球, 采用热重分析/同步差热分析仪, 在流量为100 mL·min-1的空气气氛下, 以10 ℃·min-1的升温速率由常温升温至600 ℃, 测试微球样品的热重曲线和差热分析曲线.
2.3.5 复合微球对氟离子的吸附作用
氟离子的测定:准确吸取NaF标准溶液于5个50 mL容量瓶中, 加入25 mL总离子强度缓冲液, 10 mL稀盐酸(1+11), 加水定容, 倒入聚乙烯烧杯中.用去离子水调稳电位仪, 待电极电位仪读数达到370 mV以上, 从低浓度到高浓度测定系列标准溶液电位(盛晓风等, 2013).
吸附率和吸附容量的测定:取40 mL NaF溶液(1 mg·mL-1), 用0.1 mol·L-1 HCl溶液和0.1 mol·L-1 NaOH溶液调节pH为5.0, 定容至50 mL, 加入3%(干重)的微球, 在50 ℃恒温摇床中, 以150 r·min-1的速度反应2 h.取反应溶液1 mL, 加入25 mL总离子强度缓冲溶液, 加入10 mL稀盐酸(1+11), 于50 mL容量瓶中定容, 进行测量.吸附率和吸附容量的计算公式如下:
式中, η为吸附率, C0为吸附前溶液中氟离子浓度(mg·mL-1), C为吸附结束时溶液中氟离子浓度(mg·mL-1), Q为吸附容量(mg·g-1), V为氟离子溶液体积(mL), M为吸附剂质量(g).
吸附动力学:量取7份40 mL、1 mg·mL-1的NaF溶液, 置于一系列锥形瓶中, 吸附时间分别为1、2、4、6、8、10和12 h, 测定吸附容量, 绘制吸附曲线.
吸附热力学:量取7份各40 mL、质量浓度分别为0.5、1.0、1.5、2.0、2.5、3.0和3.5 mg·mL-1的NaF溶液置于锥形瓶中, 测定吸附平衡时的吸附容量.以平衡时的F-浓度Ce为横坐标, 饱和吸附容量Qe为纵坐标作图, 可得到F-的热力学吸附等温曲线.
3 结果与讨论(Results and discussion)3.1 复合微球的制备3.1.1 羧甲基壳聚糖添加量的优化
不同羧甲基壳聚糖添加量下制备的复合微球的弹性和硬度及对氟离子的吸附率见图 1.由图 1可知, 随着羧甲基壳聚糖添加量的增加, 微球的弹性和硬度都呈上升趋势, 对溶液氟离子的吸附率也呈上升趋势.但在添加量达到5%之后, 吸附率无明显上升, 呈平缓趋势, 并且混合溶液粘度增强, 在制备微球时有拖尾现象, 因此, 选取羧甲基壳聚糖的添加量为5%.
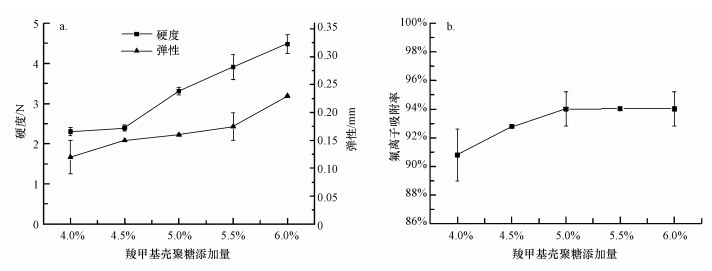
图 1羧甲基壳聚糖添加量对微球弹性和硬度(a)及对氟离子吸附率(b)的影响
3.1.2 葡聚糖添加量的优化
不同葡聚糖添加量下制备的复合微球的硬度和弹性及对氟离子吸附率见图 2.由图 2可知, 随着葡聚糖添加量的增加, 羧甲基壳聚糖-葡聚糖复合微球的硬度呈下降趋势, 弹性则先下降后缓慢上升;对氟离子的吸附率呈先上升后下降的趋势, 在1%添加量时吸附率最大, 达到96%.综合硬度、弹性和氟离子吸附率的比较, 取葡聚糖的添加量为1%, 此时微球对氟离子的吸附率达到最大, 弹性和硬度也相对较好.
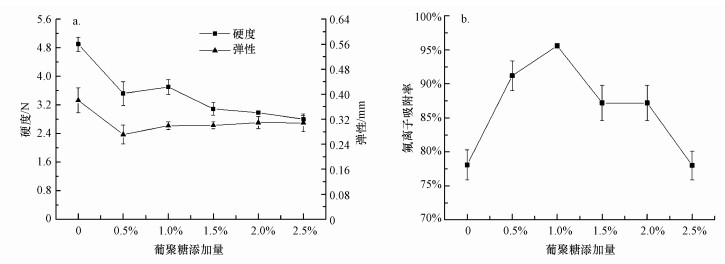
图 2不同葡聚糖添加量对微球的质构(a)及对氟离子吸附性(b)的影响
3.2 复合微球基本性质3.2.1 复合微球的红外光谱表征
羧甲基壳聚糖、葡聚糖和复合微球的红外图谱见图 3.从图 3可知, 在3282.68 cm-1附近的较强、较宽的吸收峰是糖类O—H键, 2883.77 cm-1处为C—H伸缩振动吸收峰, 1713.21 cm-1、1652.85 cm-1处是羧酸中的C=O双键的伸缩振动峰, 这说明样品中含有羧基, 该峰是羧甲基壳聚糖区别壳聚糖的重要标志;1373.75 cm-1附近是β-1, 3键的特征吸收峰, 896.03 cm-1附近出现吸收峰, 说明样品为β-D-吡喃糖, 表明微球中含有β-D-1, 3-葡聚糖.戊二醛交联羧甲基壳聚糖后, 在1548.12 cm-1附近的N—H弯曲振动吸收峰明显减弱, 而2883.77 cm-1处—C—H伸缩振动吸收峰有所增强(王聪等, 2010), 说明羧甲基壳聚糖与葡聚糖复配, 再经戊二醛交联, 制备了复合微球.
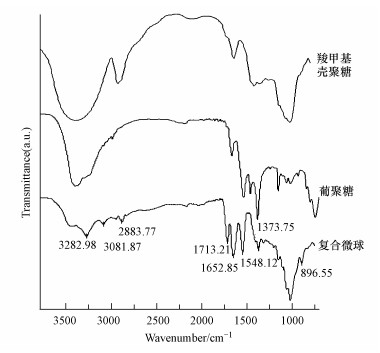
图 3不同微球的红外谱图
3.2.2 复合微球的微观结构
复合微球的外观及SEM见图 4.由图 4可见, 微球内部呈多孔状, 是羧甲基壳聚糖和葡聚糖混合粘稠溶液在酸性分散剂中形成的特有结构.经混合交联剂交联和冷冻干燥后, 形成立体网孔结构, 增强了吸附的接触面积, 有利于提高吸附效率.

图 4复合微球(a)及扫描电镜图(b)
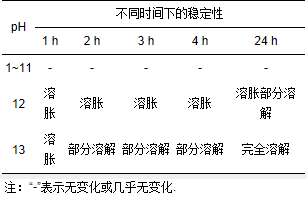
3.2.3 复合微球对不同pH的稳定性研究
羧甲基壳聚糖-葡聚糖复合微球在不同pH的水溶液中浸泡不同时间后, 微球的表观特征及溶胀情况如表 1所示.从表 1可见, 羧甲基壳聚糖-葡聚糖复合微球在pH=1~11的水溶液中浸泡, 都没有发生溶胀或溶解, 表明微球在酸性和弱碱条件下稳定, 因此, 羧甲基壳聚糖-葡聚糖复合微球使用时pH应低于11.
表 1 复合微球对pH的稳定性
3.2.4 TGA/DTA检测热稳定性
复合微球在室温约600 ℃的热重-差热分析结果如图 5所示.由图 5可知, TGA曲线大致分为3个阶段:第一阶段在270 ℃之前有微量质量损失, 第二阶段在270~400 ℃时微球质量迅速下降, 第三阶段在400 ℃以后微球质量下降速度减慢.结合DTA曲线分析可知, 100 ℃附近的小吸热峰是复合微球吸附的自由水脱除, 导致质量下降.在100~270 ℃, 质量仅下降了7%, 在250 ℃出现了一个吸热峰, 是复合微球中结合水造成的失重.在270~400 ℃, 微球快速分解, 最大分解峰出现在340 ℃左右;在400~600 ℃, 主要发生的是碳化反应, 微球质量下降到初始质量的18%, 失重主要是N、H、O元素的脱除.已有对羧甲基壳聚糖热稳定性的研究表明, 260 ℃开始失重(曹佐英等, 2008), 本实验结果与之基本一致, 本实验结果为270 ℃, 葡聚糖的添加提高了热稳定性.
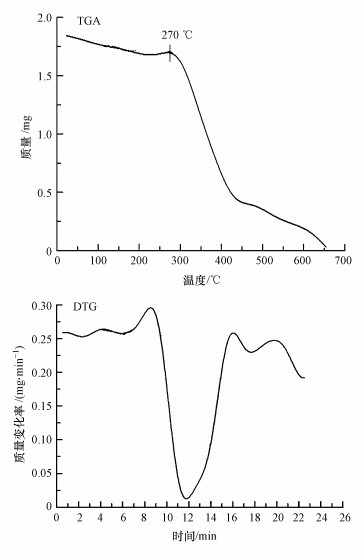
图 5羧甲基壳聚糖-葡聚糖复合微球的热重-差热分析图
3.3 复合微球对氟离子吸附性质3.3.1 吸附动力学
复合微球对氟离子的吸附曲线如图 6所示.由图 6可知, 吸附容量在8 h时趋于平衡.由式(2)计算可得, 复合微球对氟离子的吸附容量为50.99 mg·g-1.
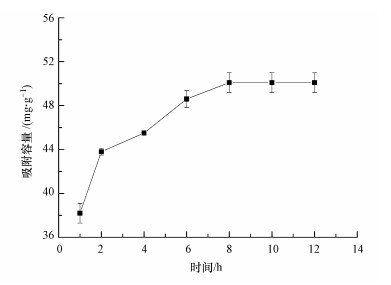
图 6复合微球的吸附曲线
分别采用拟一级动力学(式(3))和拟二级动力学方程(式(4))对数据进行拟合(Viswanathan et al., 2009), 结果见图 7.结合式(3)和式(4), 分别计算拟一级速率方程的k1和Qe′和拟二级速率方程的k2和Qe′, 动力学参数见表 2.由表 2可知, 相对于一级吸附模型, 微球吸附氟离子的二级动力学模型的Qe′与实验值Qe更接近, 且R2大于0.999, 说明二级吸附机制起主要作用, 在一定浓度范围内, 吸附速度受吸附剂和底物浓度的影响.
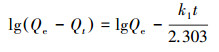
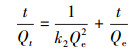

图 7线性吸附动力学(a.一级动力学,b.二级动力学)
表 2 复合微球吸附F-的动力学参数
式中, t为吸附时间(min), Qt为吸附时间为t时的吸附容量(mg·g-1), Qe为吸附平衡时的吸附容量(mg·g-1), k1为一级反应速率常数(min-1), k2是二级反应速率常数(g·mg-1·min-1).
3.3.2 平衡吸附模型
复合微球吸附氟离子的Langmuir吸附等温线(式(5)和Freundlich吸附等温线(式(6)见图 8.随F-浓度增加, 平衡时的吸附容量也在增加, 当F-起始浓度相对较低时吸附主要发生在与微球充分接触的表面, 随着F-起始浓度的增大, 离子不断向微球内部扩散, 吸附反应推动力增大, 吸附容量增大.对图 8a的数据拟合后得到图 8b和图 8c, 计算式(5)中的常数Kb和Qm, 以及式(6)中KF和1/n, 结果见表 3.
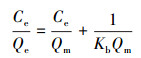

图 8复合微球对F-的吸附等温线(a)、Langmuir吸附等温线(b)及Freundlich吸附等温线(c)
表 3 复合微球对F-等温吸附常数
式中, Ce为吸附平衡时氟离子浓度(μg·mL-1), Qe为吸附平衡时微球吸附容量(mg·g-1), Qm为单分子层饱和吸附量(mg·g-1), Kb为Langmuir常数(L·mg-1), 1/ n为无量纲的系数, 与吸附强度有关, kF为Freundlich吸附平衡常数.
由表 3可见, 该吸附过程很好地符合Langmuir模型, 表明F-与微球之间首先发生单层分子吸附, 具有最大的吸附容量.基本符合Freundich模型, 其中n>1, 具有以物理吸附为主的表面吸附特性.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
4 结论(Conclusions)
以羧甲基壳聚糖复配葡聚糖制备了生物吸附剂微球, 通过测定微球弹性、硬度及对氟离子的吸附率, 得到制备微球最佳配比为羧甲基壳聚糖5%和葡聚糖1%.扫描电镜显示, 复合微球具有多空网络结构, 提高了吸附面积.复合微球可稳定存在于pH低于11的水溶液中, 在温度270 ℃以下时较稳定.复合微球对氟离子的吸附为二级动力学机制, 微球与氟离子发生单层分子之间的吸附, 且是具有物理吸附特性的表面吸附, 吸附率可达到96%.