1 引言(Introduction)
随着印染、化妆品、医药、食品等行业的快速发展,越来越多的商业染料通过各种方式被排入水体中.据不完全统计,我国目前染料年产量达到895×103 t,占到了世界总产量的60%,而在生产和使用染料的过程中,有10%~20%是以废水形式排放的,其排放量在3×106~4×106 t·d-1,占全国工业废水总排放量的35%左右(吴建通, 2017).染料废水具有色度高、氨氮高、TOC高、成分复杂的特点,会严重抑制水生生物的生长,甚至会对人体的皮肤、眼睛、胃肠道和呼吸道产生强烈的刺激作用,造成严重的环境污染问题(Su et al., 2013).由于多数染料都具有较为复杂的芳环结构,在自然情况下难以进行生物降解,因此,使用传统方法处理染料废水将很难达到行业规定的排放标准(王炜亮等, 2016).
罗丹明B(RhB)是一种艳红色的、由人工合成的阳离子型碱性染料,是一种重要的水溶性氧杂蒽染料,作为着色剂被广泛应用于纺织印染和食品行业,同时它也是一种常用的示踪荧光剂(王春英等, 2015).RhB进入水体后会严重污染水质,降低水生植物的光合作用,且具有致癌效应.目前,对RhB的处理方法主要有吸附(Gad et al., 2009)、生物降解(陈若冰, 2007)、过滤(Dzior et al., 2009)和高级氧化技术(Hou et al., 2011)等.吸附技术操作简便、去除效率高,但仅能将污染物从液相转移至固相,并未彻底去除,会造成二次污染.由于RhB自身所具有的复合结构,使其化学性质十分稳定且难以被生化降解或光降解,因此,使用高级氧化技术处理含有RhB废水的方法在近年来受到了广泛的关注(杨梅梅等, 2012).
近年来,通过活化过硫酸盐而产生硫酸根自由基(SO4·-)的高级氧化技术,在降解水中有机污染物方面受到广泛关注(Zou et al., 2013).过硫酸盐包括过一硫酸盐(HSO5-)和过二硫酸盐(S2O82-),在一般状态下,其对有机物的降解效果并不明显,但在特定的条件(热、超声、紫外光、盐类、过渡金属离子、酸碱及活性炭)(Gu et al., 2017; Wang et al., 2014)下活化后,即会产生大量的具有强氧化性的SO4·-.相比于传统高级氧化工艺所生产的羟基自由基(·OH),SO4·-具有更高的标准还原电位(E0=2.5~3.1 V)和对目标污染物更强的选择性,其反应条件更加温和、矿化能力更强(韩强等, 2012).Oxone是由3种硫酸钾盐(2KHSO5·KHSO4·K2SO4)复合而成,其主要活性物质为过硫酸氢钾(PMS,KHSO5),属于过氧化氢的衍生物,是一种较强的氧化剂.当对反应体系外加紫外激活后,Oxone可以产生强氧化性的SO4·-和·OH降解水体中存在的有机污染物(邓靖等, 2015).
由于PMS自身的不对称结构特征,使其极易被紫外光(248~351 nm)活化而产生SO4·-(陈晓旸等, 2010; 时鹏辉, 2013).而SO4·-能够有效地将污染物转化为低毒、易被生物降解的小分子物质(Yuan et al., 2011),故应用UV/PMS体系处理染料废水有着实际意义.因此,本文以RhB为目标污染物,研究UV/PMS体系下RhB的降解效果,系统考察RhB初始浓度、PMS投加量、pH值、天然有机物(Natural Organic Matter, NOM)和水体中常见阴离子等不同反应条件对污染物去除效果的影响,并探讨RhB在UV/PMS体系中的降解机理,以期为有机染料废水的治理提供理论依据.
2 材料与方法(Materials and methods)2.1 试剂
实验所用药品及溶剂均为分析纯及以上级别.罗丹明B(分析纯)购自国药集团化学试剂有限公司,相对分子质量为479.01,分子式为C28H31ClN2O3,结构式如图 1所示;叔丁醇(ACS reagent)购自Sigma-Aldrich公司;甲醇、硫酸亚铁(分析纯)购自天津市致远化学试剂有限公司;硫代硫酸钠(分析纯)购自天津博迪化工有限公司;硝酸钠(分析纯)购自天津市光复精细化工研究所;草酸钠、甲酸钠、乳酸钠、乙酸钠、磷酸二氢钾、草酸钠、硫酸、氢氧化钠(分析纯)购自国药集团;NOM(疏水性酸组分,分离自Suwannee River)购自Georgia(USA);实验中配置溶液所使用的超纯水(电导率为18.25 MΩ·cm)均通过英国Pall公司的Cascada(TM)BIO净水系统制备.
图 1

图 1罗丹明B的化学结构式
2.2 实验方法
实验在BL-GHX-V型光化学反应仪(西安比朗生物科技有限公司)中进行,光源为300 W高压汞灯.为保证每次实验的紫外光稳定,紫外灯需要提前预热至少20 min,同时开启循环冷凝水,保持光化学反应装置内维持室温(20 ℃).配制浓度为1 mmol·L-1的RhB作为实验储备液.实验按批式进行反应,在实验前取一定量的RhB储备液加入到50 mL的石英反应管中,用超纯水配制成一定浓度的模拟染料废水.根据实验设定,向模拟废水中加入不同的影响因子,并将反应溶液定容至50 mL,在磁力搅拌器上搅拌均匀后,放入光化学反应仪装置中并迅速加入氧化剂(PMS)进行反应,同时开始计时,在固定的时间点上准时取样并迅速加入一定量的硫代硫酸钠进行淬灭.将淬灭后的溶液转入比色皿中,对其进行吸光度的检测.本研究中所采用的实验数据均取2次(或3次)平行实验后的平均结果.
2.3 分析方法
脱色降解后的RhB,采用UV-1801紫外可见分光光度计(北京瑞利分析仪器公司)于其最大吸收波长554 nm处测定吸光度,通过标准曲线计算其浓度值.
RhB降解生成的离子及小分子有机酸的种类和浓度采用Dionex IC-1500离子色谱仪(IC)测定.阴离子测定使用Dionex公司生产的IonPac AS19阴离子色谱柱(4 mm×250 mm)及IonPac AG19阴离子保护柱(4 mm×50 mm),洗脱液为18 mmol·L-1的KOH溶液,流速1.0 mL·min-1.采用梯度淋洗法测定小分子有机酸,色谱柱及保护柱同上.具体方法为:先用1 mmol·L-1的KOH溶液淋洗5 min,再在28 min内将KOH溶液浓度从1 mmol·L-1逐渐增至35 mmol·L-1,最后用1 mmol·L-1的KOH溶液淋洗5 min.阳离子测定使用Dionex公司生产的IonPac CS12A阳离子色谱柱(4 mm×250 mm)及IonPac CG12A阳离子保护柱(4 mm×50 mm),洗脱液为20 mmol·L-1的甲基磺酸(MAS)溶液,流速1.0 mL·min-1.
反应后溶液中剩余的总有机碳浓度(TOC)采用680 ℃催化燃烧氧化-非色散红外吸收法,在SHIMADZU(岛津)公司所生产的TOC-LCPH分析仪上测定.实验采用METTLER TOLEDO公司FE20型号pH计测量溶液的pH.
3 结果与讨论(Results and discussion)3.1 不同反应体系的对比
实验比较了单独UV、单独PMS、UV/PMS 3种不同体系下RhB的降解效果,实验中RhB的初始浓度为10 μmol·L-1,PMS初始浓度为50 μmol·L-1,溶液pH为7.19,结果如图 2a所示.实验结果表明,只添加PMS时,RhB溶液几乎不降解,这是因为室温下PMS自身稳定性较高,在未被外部因子活化的情况几乎不产生活性自由基,对污染物的降解效果不显著.在单独UV照射下,反应15 min后RhB的去除率为77.6%.相对于单独UV,体系中添加PMS后,RhB的降解速率和去除率都有所提高,在3 min左右时降解率即达到50%,反应15 min后,RhB的去除率约为90%,这是由于PMS在UV照射下可分解产生大量的强氧化性自由基SO4·-和·OH,从而加速了RhB的降解.采用准一级动力学对其进行拟合,得出不同反应体系下ln(c/c0)与反应时间的关系(图 2b),可知RhB的降解遵循准一级动力学模型,且R2≥0.99.RhB在单独PMS、单独UV、UV/PMS体系中的准一级动力学速率常数(kobs)分别为0.001、0.092、0.135 min-1,UV/PMS体系表现出最佳的RhB去除效果.
图 2
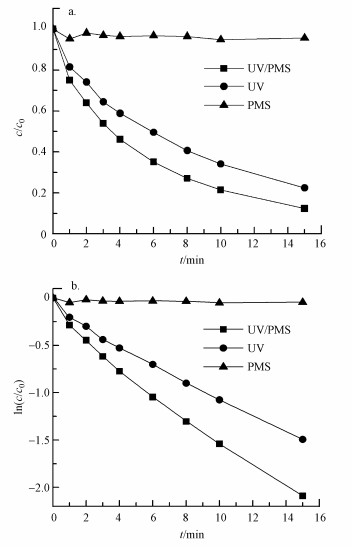
图 2不同体系下RhB的降解效果(a)和RhB降解的准一级拟合曲线(b)([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=7.19)
3.2 pH对RhB降解效率的影响
实验考察了溶液初始pH在2~12范围内对UV/PMS系统RhB降解效果的影响.由图 3可见,溶液初始pH对体系中RhB的降解具有显著影响.在pH为2时,降解速率最快,反应15 min后,RhB的去除率接近100%,随溶液pH的升高,RhB的降解有所降低;中性条件下,RhB降解最慢,然而当溶液pH由9增加到12时,降解效果略有提高,这很可能是由不同pH条件下系统中生成自由基的种类、活性及RhB所存在的形态不同造成的.当溶液pH < 4时,RhB大部分是带正电的质子化形态,更容易受到带负电的SO4·-的攻击,故酸性条件有利于RhB的降解.在强碱性条件下,由于碱活化PMS促进强氧化性自由基的生成,同样会提高RhB的去除效果.但在碱性条件下,SO4·-则会与H2O或OH-发生式(1)和(2)反应,生成大量的·OH(苏跃涵等, 2016).由于在酸性状态下SO4·-的氧化还原电位为2.6~3.1 V,明显大于碱性条件下·OH的电位(1.8 V)(陈晓旸等, 2010; 郭洪光等, 2015),且SO4·-更趋向于通过电子转移的方式发生降解反应,相比于·OH而言,其对有机物的降解更具有选择性(Buxton, 1988),故RhB在酸性条件下降解效果相对碱性条件下更好.
图 3(Fig. 3)

图 3 UV/PMS系统中不同溶液初始pH对RhB降解效率的影响([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1)
![]()
3.3 PMS浓度的影响
PMS投加量对RhB降解的影响如图 4所示,结果表明,增大PMS的浓度可加快RhB的降解速度.当PMS的浓度从10 μmol·L-1增加到200 μmol·L-1时,反应15 min后,RhB的降解率从78.2%提高到99.3%.这是由于在UV/PMS体系中,随着PMS初始浓度的增加,反应系统中活化形成的强氧化性自由基增多,进而使RhB的降解速率加快.在PMS浓度较低的情况下RhB降解符合准一级反应动力学.但当PMS的浓度增加到75 μmol·L-1后,RhB的降解表现出在反应的第1 min浓度骤降及随后反应速率开始逐渐减缓的两个阶段.这是由于当体系中PMS浓度过大时,会发生如式(3)和(4)的反应,即溶液中过多的SO4·-还来不及与RhB反应,就与HSO5-发生反应或彼此之间相互发生淬灭反应,从而消耗高活性自由基,进而导致目标污染物的降解速率变缓甚至终止反应(Liang et al., 2009),因此,氧化剂的投加量要控制在合理范围内.
图 4

图 4 PMS投加量对UV/PMS体系降解RhB的影响([RhB]=10 μmol·L-1,pH=7.19)
![]()
3.4 RhB初始浓度的影响
在pH值不变且PMS浓度和UV光照一定的条件下,RhB的降解速率和去除率还与其在水体中的初始浓度有关.固定PMS投加量为50 μmol·L-1,研究了不同的RhB初始浓度(2.5~20 μmol·L-1)对UV/PMS体系中RhB降解效果的影响,实验结果如图 5所示.由图可见,反应速率和降解率因底物初始浓度的升高而受到显著的抑制.当RhB浓度≤5 μmol·L-1时,15 min内几乎被完全降解;当RhB初始浓度由10 μmol·L-1提高至20 μmol·L-1时,RhB的最终降解率从89.9%下降至69.8%.采用准一级动力学对其进行拟合,发现RhB在不同的初始浓度下,其在UV/PMS体系中的降解均符合准一级反应动力学模型,R2>0.98.随着RhB初始浓度的增加,反应表观速率常数kobs逐渐降低,且经拟合发现其与RhB初始浓度呈负线性关系(R2>0.91).经过计算,当RhB投加量从2.5 μmol·L-1增加至20 μmol·L-1时,kobs从0.325 min-1减小到0.078 min-1.这可能来自两方面的原因:一是在相同紫外辐射及固定氧化剂投加量的情况下,体系中产生的活性自由基是相同的,但当目标污染物浓度升高时,单位时间、单位体积内底物被自由基进攻的概率会降低,从而降低了底物的降解速率;二是在紫外辐射剂量保持不变的情况下,当底物浓度过高时,单位时间、单位体积内RhB获得的紫外辐射量减少,因此,在相同条件下RhB的去除率会随着其浓度的升高而降低.
图 5

图 5 RhB初始浓度对其在UV/PMS体系中降解的影响([PMS]=50 μmol·L-1,pH=7.19)
3.5 水体中常见阴离子和NOM的影响
印染工艺中会用到大量的添加剂、媒染剂,包含各种无机盐,导致染料废水成分非常复杂,对高级氧化过程有较大影响.本实验研究了水体中常见阴离子对UV/PMS体系降解RhB的影响,当向反应体系中分别加入10 μmol·L-1的H2PO4-、C2O42-、NO3-和Cl-时,RhB的降解如图 6所示.
图 6
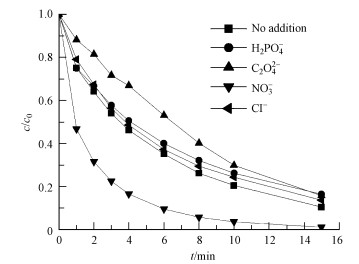
图 6水体中各种无机阴离子对UV/PMS系统降解RhB的影响([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=7.19)
由图可见,NO3-对反应具有明显的促进作用,与未添加阴离子的体系相比,当加入10 μmol·L-1 NO3-时,RhB的去除率由89.9%提高到98.9%,这是由于NO3-在紫外照射下会生成·OH(郭洪光等, 2011),如式(5)~(8)所示,提高了体系的氧化能力,对RhB的降解产生促进作用.
而Cl-、H2PO4-、C2O42-的加入则对反应起着不同程度的抑制作用,其抑制程度为Cl- 天然有机物(NOM)广泛存在于水体中,其对高级氧化过程的影响不可忽略.不同NOM浓度下,RhB在UV/PMS体系中的去除如图 7所示.由图可见,在本研究浓度范围内NOM的加入对RhB的降解有明显的抑制作用.当体系中NOM浓度从1 mg·L-1增加到100 mg·L-1时,RhB的去除率由85.9%降低到10.0%,同时经计算,相应的准一级反应速率常数kobs由0.121 min-1迅速减小到0.0081 min-1.水体中的NOM对体系目标有机物的降解抑制作用主要有两方面的原因:一是NOM通过吸收、屏蔽紫外辐射降低RhB的直接光降解;二是NOM可捕获反应体系中的强氧化性自由基起到淬灭剂的作用,即其可与体系中的RhB进行自由基竞争,从而抑制了RhB溶液的降解(Liu et al., 2017).具体联系污水宝或参见http://www.dowater.com更多相关技术文档 图 7 图 7 NOM浓度对UV/PMS体系降解RhB的影响([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=7.19) 3.6 Fe2+对UV/PMS去除RhB影响 过渡金属可活化PMS产生强氧化性的SO4·-,从而使有机污染物得到降解.实验考察了过渡金属Fe2+存在时对UV/PMS体系降解RhB的影响.在UV/PMS体系下,RhB初始浓度为10 μmol·L-1,PMS初始浓度为50 μmol·L-1,初始pH为3时,Fe2+浓度对RhB降解的影响如图 8a所示.同时,以相同条件下无UV辐射时、不同浓度Fe2+活化PMS降解RhB的反应作为对照实验,结果如图 8b所示.由图可知,在仅添加PMS的体系中,RhB的降解呈现出在反应后的1 min内浓度迅速下降随后反应趋于平缓甚至停止的两个阶段,这是由于反应开始时,Fe2+一接触PMS即可迅速发生如式(9)所示的反应,产生大量SO4·-,使得PMS/Fe2+体系中RhB浓度急剧下降.但反应后生成的Fe3+被还原为Fe2+的速度非常缓慢,故随后PMS被活化为活性自由基的速度变缓,使RhB的降解停滞.当Fe2+浓度从2.5 μmol·L-1增加到50 μmol·L-1时,反应15 min后,RhB去除率由12.2%提高到70.4%,但当Fe2+浓度进一步增加到100 μmol·L-1时,RhB的降解率反而迅速下降到33.6%,这是由于过量的Fe2+会与生成的SO4·-发生如式(10)所示反应,导致体系中活性自由基的耗损. 图 8 图 8 Fe2+浓度对RhB的降解影响(a.UV/PMS/ Fe2+体系,b.PMS/ Fe2+体系;[RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=3) 实验结果表明,在UV/PMS体系中,Fe2+的加入可显著促进RhB的降解,且随着Fe2+浓度的不断增大,RhB的降解速率不断加快,在反应10 min后,RhB的降解率几乎达到了100%,但当Fe2+浓度超过25 μmol·L-1后,RhB的降解速率无显著变化.UV/PMS/Fe2+体系中活性自由基通过紫外活化PMS及过渡金属Fe2+活化PMS两种方式产生,因此,与UV/PMS体系相比,RhB的降解速率有显著提高.此外,在紫外辐射下,Fe2+由Fe3+还原再生的速度加快,同时还可以产生额外的·OH,这也是RhB在UV/PMS/Fe2+体系内降解加速的原因之一.但与PMS/Fe2+体系类似,过量的Fe2+也会造成UV/PMS/Fe2+体系中活性自由基的消耗,不利于RhB降解. 3.7 自由基的鉴定 为鉴定反应中起主要作用的活性自由基,向体系中加入2种常见的自由基清除剂甲醇(MeOH)和叔丁醇(TBA)进行淬灭研究.由于含有α-氢的醇(如MeOH)与SO4·-和·OH都具有较高的反应速率,可同时作为SO4·-和·OH的清除剂;而没有α-氢的醇(如TBA)与·OH的反应速率比其与SO4·-的快约1000倍(Chen et al., 2012),故可选择性清除·OH,因此,本研究选用MeOH和TBA作为自由基清除剂,用于鉴定体系中起主要作用的自由基.实验选择MeOH和TBA与PMS的物质的量比分别为3000:1、1000:1在体系中进行反应,结果如图 9所示,15 min后,添加MeOH的两组反应中RhB的最终降解率分别为18.2%、22.2%,添加TBA的两组反应中RhB的最终降解率均为46.6%.可以看出,在中性条件下,MeOH、TBA对RhB的降解均具有明显的抑制作用,且在相同条件下,MeOH对反应的抑制程度明显强于TBA,说明反应体系中同时存在SO4·-和·OH两种强氧化性自由基.但抑制作用随MeOH和TBA浓度的增加变化不显著,说明自由基清除剂与氧化剂物质的量比在1000:1时,即可达到几乎完全淬灭相应活性自由基的效果.当TBA与PMS的物质的量比为1000:1时,体系中RhB仍有46.6%的去除率,但与未添TBA相比,RhB的降解率降低了43.9%,这种降低缘于TBA的投加淬灭了反应体系中的·OH,说明UV/MS体系中SO4·-和·OH两种自由基对RhB的降解贡献相当. 图 9 图 9自由基对UV/PMS体系降解RhB的影响([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=7.19) 3.8 RhB的降解机理 实验考察了RhB在UV/PMS体系中降解过程的UV-Vis谱图变化,结果如图 10所示.RhB的降解主要通过2个竞争过程:一是N-位脱乙基作用,另一个是共轭结构(发色基团)的破坏.由图可见,RhB在位于可见光区的554 nm处有主要吸收带,另外在位于紫外光区的259 nm处也有特征吸收带.RhB在554 nm的吸收主要源自于其共轭结构中的C=N和C=O结构,其在紫外光区的吸收主要来自RhB的苯环结构.实验结果表明,随着反应的进行,RhB在可见光区的最大吸收峰迅速降低,并且伴随有蓝移现象,溶液颜色从也红色逐渐变为无色,说明发色基团逐渐被破坏并且有可能通过N-位脱乙基形成了一些中间产物;同时,其在259 nm处的吸收亦逐渐降低,说明降解过程中RhB的苯环结构受到破坏.因此,可以得出RhB在UV/PMS体系中的降解主要是通过共轭结构的破坏、N-位脱乙基并伴有苯环结构的破坏进行的. 图 10 图 10 UV/PMS系统中RhB降解过程的UV-Vis图([RhB]=10 μmol·L-1,[PMS]=50 μmol·L-1,pH=7.19) 为进一步研究RhB在UV/PMS体系中的降解机理,实验将RhB和PMS的初始浓度分别提高到200和1000 μmol·L-1,利用TOC和IC分别对RhB在降解过程中的矿化度和产物进行了鉴定,结果如图 11所示.由图可见,反应进行4 h后,溶液中RhB的浓度由最初的200 μmol·L-1降至0.62 μmol·L-1,降解率几乎为100%,TOC去除率约为60%.随着RhB浓度的下降,体系中检测到草酸根、甲酸根、乳酸根和乙酸根这4种有机酸根离子,且其浓度均随反应的进行逐渐增加,4 h后其生成浓度分别为10.17、251.93、41.74和214.80 μmol·L-1.可知生成的甲酸和乙酸的浓度较大、生成速率较快,而草酸和乳酸的浓度较低,生成速率也较低.说明UV/PMS体系下产生的强氧化性自由基能够攻击RhB分子的共轭结构(发色基团)将其打开,并在自由基进一步攻击下,苯环结构破坏开环形成小分子物质,如本研究中检测到的甲酸、乙酸等小分子有机酸,有机酸在进一步氧化下可矿化生成H2O和CO2.同时,体系中还检测到有无机阳离子NH4+的存在,反应4 h后生成浓度为31.96 μmol·L-1,推测是由于有机氮发生氧化反应生成无机氮NH4+. 图 11 图 11 UV/PMS体系下罗丹明B的降解产物分析([RhB]=200 μmol·L-1,[PMS]=1000 μmol·L-1,pH=7.19) 4 结论(Conclusions) 本研究采用紫外活化Oxone产生SO4·-和·OH的方法降解水体中的染料罗丹明B,研究了溶液初始pH、氧化剂剂量、RhB初始浓度、天然有机物(NOM)、Fe2+浓度、自由基淬灭剂(甲醇和叔丁醇)及水体中常见阴离子对降解效果的影响,结果发现,RhB的降解反应符合准一级反应动力学,其降解受到溶液pH值的显著影响,当溶液酸性越强或碱性越强时,RhB的降解效果越好,且酸性条件下降解效果优于碱性条件.在中性条件下,反应15 min后,RhB的去除率可达约90%.氧化剂剂量的加大及底物浓度的降低也会对RhB的降解起促进作用,体系中投加过渡金属Fe2+可显著促进RhB的降解效果.水体中的NO3-对RhB的降解有着显著的促进作用,而H2PO4-、C2O42-、Cl-和NOM则对RhB的降解有抑制作用.自由基鉴定实验发现,在中性条件下对RhB降解反应起主要作用的为SO4·-和·OH.实验结果表明,RhB的降解机理可能是通过强氧化性自由基攻击RhB分子的发色基团并使苯环结构破坏开环形成小分子有机酸(如甲酸、乳酸、乙酸和草酸),最后矿化为H2O和CO2及无机离子(如NH4+).本研究表明,UV/ PMS体系能够有效去除水体中的RhB,减轻环境污染,为有机废水特别是染料废水的治理提供一种切实可行的方法.(来源:环境科学学报 作者:田东凡)

![]()
![]()





