1 引言(Introduction)
砷是一种半金属元素, 无臭无味, 普遍存在于天然水体和工业废水中, 并且被认为是毒性最大的无机污染物(Pena et al., 2005).无机状态下的砷元素主要以亚砷酸根和砷酸根两种形式存在于水体中, 且亚砷酸根的毒性比砷酸根高10倍(Katsoyiannis et al., 2007).长期暴露于高砷环境中会对人体产生重大危害(Pontius et al., 1994;Guha et al., 2003).世界卫生组织(WHO)规定饮用水中砷的最高限度为10 μg·L-1(Zhang et al., 2013), 我国的《生活饮用水卫生标准》也采用了这一标准(Nordstrom et al., 2002).因此高效的除砷技术成为了各国研究人员的研究热点.目前, 饮用水处理中的除砷方法主要包括:化学沉淀(Dodd et al., 2006)、离子交换(Wang et al., 2000)、膜过滤(Teychene et al., 2013)、电混凝(Hansen et al., 2006)和吸附法(Sun et al., 2017;Gupta et al., 2010)等.其中, 吸附法由于简单易行、处理效率高、成本低廉, 已成为当前最有应用前景的饮用水除砷方法之一(李定龙等, 2007).
近年来, 国内外研究者研制出了活性铝(Lin et al., 2001)、铁氧化物/氢氧化物(Feng et al., 2012)、二氧化钛(Tang et al., 2012)、氧化镁(Mohan et al., 2007)、二氧化铈(Zhang et al., 2005)及还原性金属(Mohan et al., 2007)等多种新型纳米除砷吸附剂.其中, 铁及其氧化物与砷离子具有更强的亲和力(Lafferty et al., 2005), 且制备方法简单, 原材料来源广泛, 现已被广泛研究.然而, 单一组份铁氧化物与As(Ⅲ)的亲和力大大弱于As(Ⅴ) (Sun et al., 2017;Zhang et al., 2007), 导致其难以高效去除水中的三价砷, 限制了其广泛应用.为此, 利用双组份吸附材料中两种组份能产生协同效应的优势, 研究者开发了一系列Fe-Mn(Shan et al., 2013;Zhao et al., 2012)、Fe-Ti(汪赛奇等, 2014)等铁基纳米复合材料.其中, TiO2由于颗粒小、比表面积大、光催化活性高、造价低廉且富含亲水性的表面羟基, 可将其直接负载于磁性载体上(Liu et al., 2014).Yu等(2014)制备了γ-Fe2O3-TiO2纳米吸附剂, 在紫外光下, 复合光催化吸附剂产生的羟基自由基能将As(Ⅲ)氧化为As(Ⅴ), 并将其进一步吸附于铁氧化物表面, 达到除砷的目的.但由于TiO2与γ-Fe2O3复合掩盖了铁材料表面的活性吸附点位, 再加上另一组份TiO2材料对砷的吸附能力较低, 导致其整体除砷效能并不高.Rao等(2015)采用共沉淀法合成了Fe-Ti双组份氧化物, 在最优条件下, 其对砷的饱和吸附量仅有31.42 mg·g-1.因此, 亟待寻求兼具良好光催化性能的同时对水中的砷离子有良好的吸附性能的材料, 与Fe3O4合成复合材料, 作为光催化剂和吸附剂用于高效处理水中砷污染.
CeO2作为稀土材料中一种高效经济的光催化成分, 现已应用于光催化领域(Arul et al., 2013).同时, 由于对水中砷离子具有较强的亲和力, 铈基氧化物还被用于高效吸附去除水中砷离子(Gupta et al., 2012).鉴于此, 本研究利用CeO2半导体的光催化活性及CeO2和Fe3O4对As(Ⅴ)的强亲和力, 合成铁铈双组份磁性纳米吸附除砷材料, 从而利用光催化作用将As(Ⅲ)氧化为As(Ⅴ), 进而考察水中As(Ⅲ)的去除效果及吸附除砷的影响因素, 在此基础上, 研究了铁铈复合物的吸附特性.
2 材料与方法(Materials and methods)2.1 实验材料
亚砷酸钠(分析纯)作为三价砷源, 购自北京化学试剂厂.硝酸铈、尿素、氯化铁、氯化亚铁、氢氧化钠、六亚甲基四胺等均为分析纯(国药集团化学试剂有限公司).所有的储备液及溶液均采用超纯水配制, As(Ⅲ)储备液的浓度为1 g·L-1, 放于4 ℃冰箱中储存备用.
2.2 Fe-Ce复合材料的制备
将4.34 g硝酸铈和4.80 g尿素溶于150 mL超纯水中, 放置于90 ℃恒温水浴中, 持续搅拌12 h.反应后, 生成白色沉淀, 将白色悬浊液冷却至室温, 离心分离, 用超纯水洗涤5次, 80 ℃真空干燥后, 置于马弗炉中300 ℃焙烧2 h, 研磨成粉末, 即得二氧化铈.
将1.99 g氯化亚铁溶液和4.61 g氯化铁溶液按摩尔比1:1.7加入400 mL超纯水中, 搅拌使其完全溶解.再将1.72 g二氧化铈和1 g六亚甲基四胺加入上述溶液, 并将其放置于80 ℃恒温水浴, 持续磁力搅拌同时滴加0.1 mol·L-1的NaOH溶液, 直至溶液pH =10, 继续搅拌2 h, 得到黑色沉淀, 陈化8 h, 过滤后用超纯水洗涤至中性, 80 ℃真空干燥, 研磨后放入无水乙醇中保存备用.
2.3 材料表征
采用X射线衍射仪(Shimadzu XRD-6100, 日本)分析复合材料的晶型结构;采用扫描电子显微镜(Hitachi S-3500N, 日本)表征材料的表观形貌;复合材料的比表面积、孔容和孔径分布由比表面积测定仪(Micromeritics ASAP 2020, 美国)测定;采用振动样品磁强计(JDM-13, 中国)对复合材料进行磁特性分析.
2.4 光催化/吸附实验
Fe-Ce复合材料的光催化/吸附除砷实验在常温常压下进行.以300 W紫外灯作为光源, 批量试验的As(Ⅲ)浓度为10 mg·L-1, 吸附剂浓度为200 mg·L-1, 离子强度(以NaNO3计)为0.01 mol·L-1, 反应液初始pH为7.0.在石英管中加入50 mL 10 mg·L-1的As(Ⅲ)溶液和10 mg Fe-Ce复合材料, 将石英管置于光催化反应器(OCRS-IV TYPE)中, 在紫外光照射下, 以转速为150 r·min-1持续磁力搅拌, 光反应30 min后, 关闭紫外光源, 继续搅拌690 min, 以保证达到吸附平衡.定时取样, 用0.45 μm微孔滤膜器分离去除水中纳米颗粒, 用电感等离子体发射光谱(ICP-AES)测定滤液中的总砷浓度, 滤液中三价砷和五价砷的浓度采用离子色谱法测定.
3 结果与讨论(Results and discussion)3.1 材料表征3.1.1 微观形貌与晶体结构
利用扫描电子显微镜(SEM)观察了Fe-Ce复合材料的微观形貌.从图 1中可以看出, Fe-Ce复合材料表面粗糙并呈现孔道结构, 复合材料颗粒为纳米级非均匀粒子, 粒径约为10~30 nm.X射线衍射分析(XRD)常用于材料的晶体结构分析, 如图 2所示, 2θ在10°~80°范围内, 呈现一系列特征衍射峰.其中一些衍射峰属于Fe3O4 (JCPDs 88-0315)的(220)、(311)、(400)、(422)、(511)和(110)晶面.在33.4°、47.1°、51.7°、59.1°、69.7°和77.1°处的衍射峰均属于CeO2 (JCPDs 65-5923), 这说明该合成材料由Fe3O4和CeO2组成, 即为CeO2-Fe3O4复合材料.
图 1

图 1 CeO2-Fe3O4复合材料的扫描电镜图
图 2

图 2 CeO2-Fe3O4复合材料的X射线衍射图谱
3.1.2 材料的理化性质
CeO2-Fe3O4复合材料的氮气吸附脱附曲线与孔径分布分析结果如图 3所示.CeO2-Fe3O4复合材料的BET比表面积、孔体积和平均孔径分别为174.69 m2·g-1、0.27 cm3·g-1和15.03 nm.根据国际纯粹与应用化学联合会(IUPAC)分类(Ryoo et al., 2001), 该复合物的氮气吸附脱附等温线属于Langmuir Ⅳ型, 为典型的介孔材料吸附曲线, 其孔径分布曲线属于H3型, 进一步表明该复合物属于介孔材料.
图 3
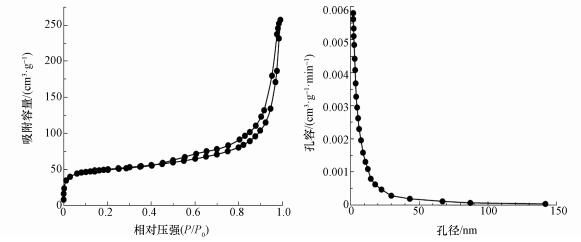
图 3 CeO2-Fe3O4复合材料的比表面积及孔径分布 (a.CeO2-Fe3O4的氮气吸附脱附曲线; b.CeO2-Fe3O4的孔径分布)
为了探究CeO2-Fe3O4复合材料的磁特性, 室温下复合材料的磁滞回线如图 4所示.材料的饱和磁化强度为51.26 emu·g-1, 表明该材料具有弱铁磁性, 可通过外加磁场进行分离回收.同时通过图 4的宏观磁分离内图可以看出, CeO2-Fe3O4复合材料在溶液中的分散效果较好, 颗粒分布均匀.在外加磁场的作用下, 材料能快速实现固液分离, 这为该材料的回收再利用提供的保障, 也具有更广泛的应用前景.
图 4

图 4 CeO2-Fe3O4复合材料的磁滞曲线
3.2 CeO2-Fe3O4复合材料光催化/吸附除As(Ⅲ)效果研究
在单独紫外光照射和黑暗条件下仅加入复合材料分别进行对比试验, 考察不同实验条件下, 体系中总砷和五价砷浓度随反应时间的变化, 结果分别如图 5a和5b所示.仅在紫外光照射下, 体系中总砷浓度没有发生变化.这说明在紫外照射, 不加入CeO2-Fe3O4复合材料的情况下, As(Ⅲ)不能被有效去除.由于光催化作用仅发生催化剂表面, 因此催化剂具有良好的吸附性能尤为重要.在黑暗条件下, 吸附60 min, CeO2-Fe3O4复合材料对As(Ⅲ)的吸附去除效率约为52.62%, 这说明在短时间内CeO2-Fe3O4对As(Ⅲ)具有较好的吸附效果.尽管As(Ⅲ)可以通过直接吸附作用去除, 但由于吸附剂对As(Ⅲ)的亲和力远低于As(Ⅴ)(Sun et al., 2017), 达到吸附平衡时, As(Ⅲ)的吸附去除效率仅为61.23%.为了进一步提高As(Ⅲ)的去除效果, 在紫外作用下, 体系中加入CeO2-Fe3O4复合材料, 形成UV/ CeO2-Fe3O4体系, 并分别以UV/ Fe3O4、UV/ CeO2体系作对比.在CeO2-Fe3O4光催化作用下, As(Ⅲ)先被氧化为As(Ⅴ), 而后被吸附于CeO2-Fe3O4表面, 该体系中反应4 h, 砷的去除效果可达到98%.这表明在紫外照射下, CeO2-Fe3O4复合材料具有良好的光催化/吸附除砷能力.
图 5
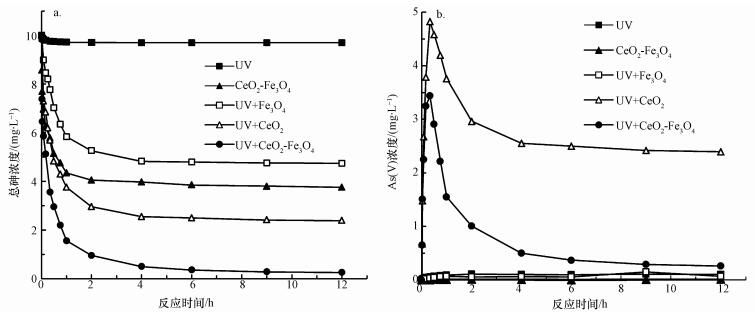
图 5不同条件下反应时间对总砷(a)和As(Ⅴ)(b)去除效果的影响
由图 5b可知, 单独紫外光或CeO2-Fe3O4存在下, 溶液中几乎检测不到As(Ⅴ)的存在, 这说明氧气和紫外辐射不能直接将As(Ⅲ)氧化为As(Ⅴ).此外, UV/ Fe3O4体系中同样检测不到As(Ⅴ)的存在, 由于Fe3O4没有紫外光催化活性, 在紫外光照下, UV/ Fe3O4体系不能将As(Ⅲ)氧化为As(Ⅴ).在CeO2或CeO2-Fe3O4紫外催化作用下, 溶液中As(Ⅴ)的浓度先升高后降低.这是由于As(Ⅴ)的浓度由As(Ⅲ)的氧化和As(Ⅴ)的吸附两部分决定.As(Ⅲ)氧化为As(Ⅴ)使溶液中As(Ⅴ)的浓度升高, 而As(Ⅴ)吸附于CeO2-Fe3O4表面使溶液中As(Ⅴ)的浓度降低.由此可见, 在反应开始时, As(Ⅲ)的氧化作用占主导地位.从图 6中可以看出, 反应20 min, 溶液中总砷浓度和As(Ⅴ)的浓度相同, As(Ⅲ)的浓度几乎为零, 即在CeO2或CeO2-Fe3O4光催化氧化作用下, As(Ⅲ)完全被氧化为低毒的As(Ⅴ), 这说明CeO2和CeO2-Fe3O4材料均具有较好的紫外光催化活性, 进一步证实了CeO2为CeO2-Fe3O4材料中的光催化活性组份.随后, As(Ⅴ)被吸附于CeO2-Fe3O4表面, 得到最终去除, 体系中的总砷浓度和As(Ⅴ)浓度随之降低.
图 6
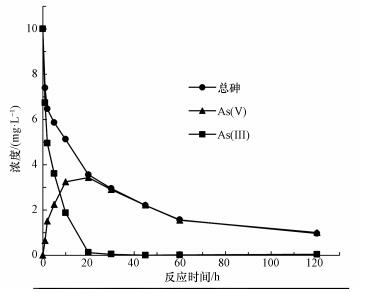
图 6 CeO2-Fe3O4复合材料光催化/吸附过程中不同种类砷浓度变化
3.3 CeO2-Fe3O4复合材料吸附特性研究3.3.1 吸附动力学
吸附动力学常作为描述吸附速率和吸附动态平衡的指标.从图 7中可以看出, 整个吸附过程可以分为两个阶段, 第一阶段是快速吸附过程, 所需时间较短, 反应2 h吸附容量已达到吸附平衡容量的80%以上.这是由于CeO2-Fe3O4复合材料对砷的吸附主要为孔道扩散吸附, 在最初阶段, 固液界面的传质扩散过程较快.第二阶段是吸附平衡过程, 以粒子内扩散为主, 吸附速率下降, 所需时间较长.当砷浓度为10 mg·L-1时, 达到吸附平衡所需时间为4 h.因此, 后续试验反应接触时间为12 h, 以确保吸附平衡.
图 7
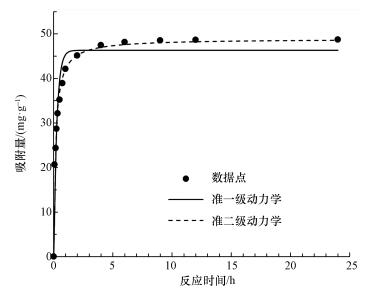
图 7 CeO2-Fe3O4复合物吸附除砷的吸附动力学模拟
吸附动力学模型在一定程度上能够解释吸附机理, 确定吸附速率的控制步骤, 分别用准一级动力学和准二级动力学模型对数据进行动力学拟合, 方程如式(1)和(2)所示.
式中, qe为吸附平衡时的吸附量(mg·g-1);qt为任意时刻的吸附量(mg·g-1);t为反应时间(min);k1为准一级动力学吸附速率常数(min-1);k2为准二级动力学吸附速率常数(g·mg-1·min-1).
动力学非线性拟合结果如表 1所示, 两种动力学模型对吸附过程的拟合度都达到了0.93以上, 但准二级动力学模型的拟合度更高, 可达到0.99, 这说明吸附过程更符合准二级动力学模型.这表明吸附过程主要由化学吸附为主导, 吸附质和吸附剂之间存在电子转移过程(Sun et al., 2017).具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
3.3.2 吸附等温线
吸附等温线常用于评价吸附剂的吸附能力.本研究选用三价砷的初始浓度范围为1~50 mg·L-1, 进行光催化/吸附除砷实验, 并分别采用Langmuir和Freundlich吸附等温线对数据进行拟合, Langmuir和Freundlich吸附等温模型方程如式(3)和(4)所示.
式中, ce为吸附平衡时溶液中砷离子的浓度(mg·L-1);qe为吸附平衡时的吸附量(mg·g-1);qm为饱和吸附量(mg·g-1);KL为Langmuir常数;n, KF为Freundlich常数.
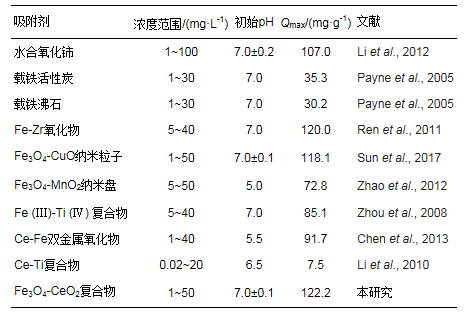
由图 8可知, 随着As(Ⅲ)初始浓度的增加, 吸附平衡容量随之增大.当初始浓度增大到一定程度时, 吸附等温曲线增长速率缓慢, 吸附趋于饱和.此外, 分别采用Langmuir和Freundlich吸附等温模型进行非线性拟合, 相关参数如表 2所示.拟合结果表明, Langmuir和Freundlich吸附等温模型的拟合结果都良好, 拟合度R2都达到了0.95以上.但比较而言, Freundlich模型的拟合度更高(R2= 0.99).这是由于Langmuir吸附等温模型基于单层吸附理论推导, 而Freundlich吸附等温模型的理论基础为多相吸附.在光催化/吸附过程中, 三价砷的吸附过程伴随着氧化还原反应的发生, 这是一种非均相吸附过程, 所以三价砷的吸附过程更适用于Freundlich吸附等温模型描述.在Freundlich吸附等温式中, n是一个与温度等因素有关的常数, 通常用来评价吸附剂表面吸附点位的不均匀性和吸附结合力的大小, 它的值越大表明吸附剂表面越不均匀, 吸附结合力越大(Shan et al., 2013;Ren et al., 2011).从拟合的结果可以看出n=2.61, 进一步说明CeO2-Fe3O4吸附剂的表面的不均匀性, 吸附结合力比较大, 具有一定的吸附能力.此外由Langmuir吸附等温模型拟合结果得出, CeO2-Fe3O4纳米粒子的吸附饱和量为122.19 mg·g-1, 其明显高于其他吸附剂的饱和吸附量(表 3).可见, CeO2-Fe3O4纳米粒子能够高效的去除水中的砷污染物, 具有广阔的应用前景.
图 8
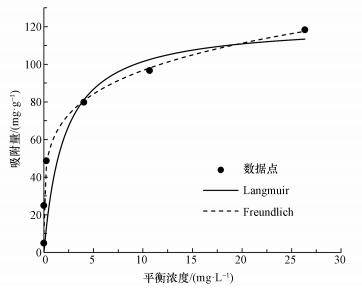
图 8 CeO2-Fe3O4复合物吸附除砷的吸附等温线模拟
表 2 砷吸附的吸附等温线模型参数
表 3 不同吸附剂对砷的最大饱和量比较
3.4 CeO2-Fe3O4复合材料光催化/吸附影响因素3.4.1 初始pH的影响
分别采用0.1 mol·L-1 HNO3和0.1 mol·L-1 NaOH调节初始pH值, 考察初始pH对CeO2-Fe3O4复合物光催化/吸附除砷效果的影响.从图 9b中可以看出, pH在4~8范围内, 溶液中砷的去除率保持在98%左右, 这表明在中性或酸性条件下, CeO2-Fe3O4复合粒子对砷具有较高的去除效果.然而, pH在9~12范围内, 砷的去除率迅速减小至不足35%.有研究人员发现五价砷的吸附受pH的影响较大, 尤其是在pH>7的条件下, 并且随着pH的增大受影响的程度也越来越大(Zhang et al., 2007).这是因为五价砷在pH < 6.8的时候在水中以H2AsO4-的形式存在, 在更高pH溶液中以HAsO42-的形式存在.当溶液的pH小于吸附剂的等电点的时候, 吸附剂表面的羟基会质子化变成OH2+, 并增强吸附剂表面对五价砷的吸附力.随着pH的增大, 吸附剂表面逐渐变为带负电, 这种吸附力也就越来越弱, 导致吸附剂的吸附能力下降.由图 9a可知, CeO2-Fe3O4纳米粒子的等电点为8.5, 所以当pH < 8.5时, 吸附剂表面带正电荷, 此时五价砷在水中是以H2AsO4-和HAsO42-的形式存在的, 通过静电引力作用可以提高吸附剂对五价砷的吸附能力, 从而提高了砷的去除率.在碱性条件下(pH>8.5), 吸附剂表面带负电荷, 而五价砷自身带有更多的负电荷, 主要由AsO43-的形式存在.由于静电斥力的作用降低了吸附剂对砷的吸附能力, 导致了砷去除率的降低.
图 9
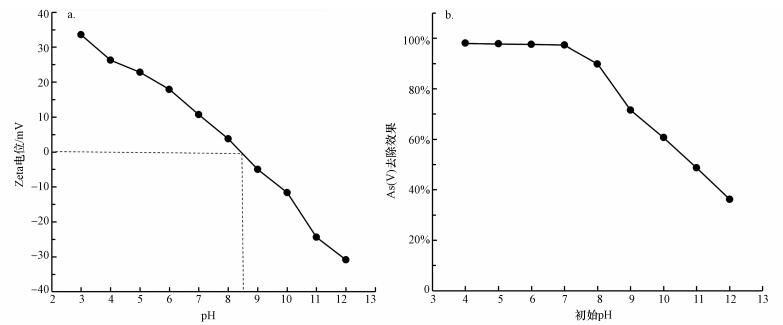
图 9 Zeta(a)及初始pH对CeO2-Fe3O4复合物光催化/吸附除砷效果的影响(b)
3.4.2 共存离子的影响
在自然水体中, 共存离子和砷酸根之间形成竞争关系, 降低吸附剂对砷的去除能力.因此本研究考察了Cl-、SO42-、CO32-、SiO32-和PO43-5种常见阴离子对砷去除效果的影响, 结果如图 10所示.Cl-和SO42-的存在对As(Ⅴ)的吸附几乎没有影响, 而CO32-、SiO32-和PO43-的存在对砷的吸附有抑制作用, 且随着竞争离子浓度的增加, 砷的吸附效果显著降低.通常情况下, Cl-只能和铁的氧化物或氢氧化物形成外层配合物(Zhang et al., 2007).SO42-和铁氧化物之间形成内层或外层配合物取决于溶液pH, 在pH>6时, SO42-主要是通过外配位作用吸附到吸附剂表面(Shan et al., 2013).相反地, AsO43-则通过配位体交换的机制与吸附剂之间形成牢固的内层配合物(Zhang et al., 2007).因此, Cl-和SO42-的存在对砷的吸附效果没有明显影响.然而, 共存的SiO32-、PO43-和铁氧化物或氢氧化物之间形成内层配合物(Zhang et al., 2009), 从而与AsO43-竞争吸附点位, 导致砷的去除效果降低.此外, 磷与砷元素属于同一主族, 化学性质相似, 对砷的竞争能力最强.对于CO32-来说, 即使CO32-和AsO43-均可以与铁的氧化物或氢氧化物之间产生内配位作用, 形成内层配合物, 但碳酸盐的亲和力要大大低于砷酸盐, 使其对砷的吸附影响相对较小(Brechbühl et al., 2012).
图 10
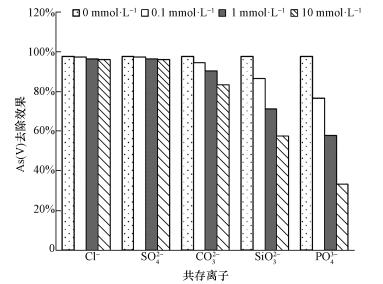
图 10共存离子对CeO2-Fe3O4复合物光催化/吸附除砷效果的影响
3.5 CeO2-Fe3O4复合材料的重复利用性
经济简单的再生方法和良好的重复利用性是吸附材料在实际应用中的关键.采用0.5 mol·L-1 NaOH和0.1 mol·L-1 NaCl作为再生剂, 通过循环利用5次复合材料的光催化/吸附、脱附效率变化, 考察CeO2-Fe3O4复合材料的重复利用性.由图 11可知, 经过每次循环实验后, 砷的去除效果均有些许下降, 但降低率均在3%之内.循环利用5次后, 光催化/吸附除砷效率仍可达到90%以上, 再生脱附效率可到达84%.可见, 多次循环使用后, 材料经过再生处理仍能保持较好的催化/吸附能力, 这说明CeO2-Fe3O4复合材料具有良好的重复利用性能.
图 11
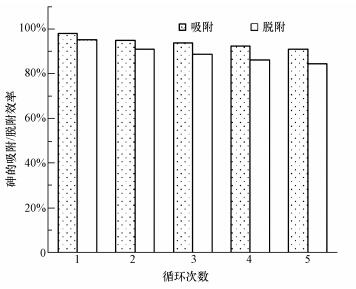
图 11 CeO2-Fe3O4复合物的重复利用性
3.6 CeO2-Fe3O4复合材料光催化/吸附除As(Ⅲ)的机理研究
为了确定光催化氧化过程中的氧化活性物种, 在UV/ CeO2-Fe3O4体系中加入捕捉剂进行研究, 实验结果如图 12所示.分别选取叔丁醇(t-BuOH), 氮气(N2)和甲酸(FA)作为羟基自由基(·OH)、超氧自由基(· O2-)和光生空穴的捕捉剂.在甲酸存在条件下, As(Ⅲ)的氧化效率没有明显降低, 这说明在As(Ⅲ)氧化过程中, 光生空穴不是氧化活性物种.而加入叔丁醇或通入氮气后, As(Ⅲ)的氧化效率明显降低, 这说明光生·OH和·O2-是As(Ⅲ)氧化的主要活性物种.
图
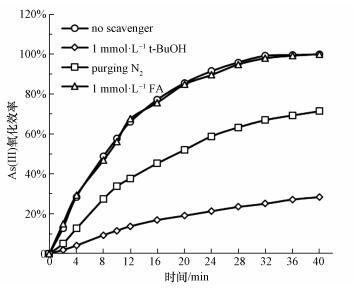
图 12自由基捕捉剂对As(Ⅲ)氧化效率的影响
CeO2-Fe3O4复合材料光催化/吸附除As(Ⅲ)的机理如图 13所示.光催化过程产的羟基自由基和超氧自由基在As(Ⅲ)的氧化过程中起重要作用.在紫外光照射下, 体系中的水和溶解氧在CeO2-Fe3O4复合材料的光催化作用下, 分别产生具有强氧化性的·OH和·O2-, 具体反应式见式(5)~(7).
图 13
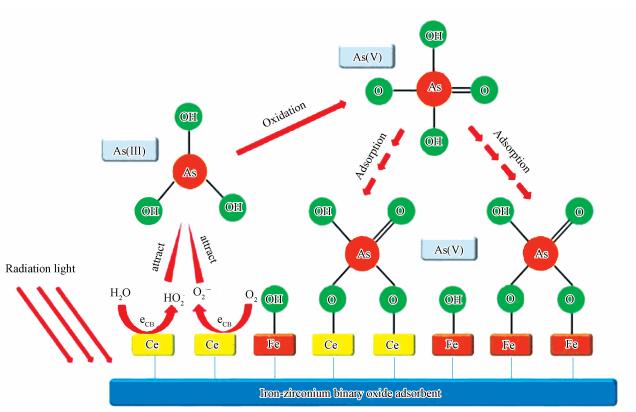
图 13 CeO2-Fe3O4复合材料光催化/吸附除As(Ⅲ)的机理图
![]()
由于生成的自由基的寿命很短, 光催化氧化反应多发生在光催化剂表面或附近.基于上述分析, CeO2-Fe3O4复合材料光催化/吸附除As(Ⅲ)的过程主要分为3个阶段.首先, 由于CeO2-Fe3O4复合材料对砷具有良好的吸附性能, 水中As(Ⅲ)快速吸附于复合材料表面.紧接着, 吸附于材料表面和附近的As(Ⅲ)被光生自由基氧化为As(Ⅴ).由于光催化氧化过程反应迅速, 在此过程中As(Ⅲ)的氧化速率远高于As(Ⅴ)的吸附速率.最终, 溶液中的As(Ⅲ)被完全氧化为As(Ⅴ), As(Ⅴ)被吸附于CeO2-Fe3O4复合材料表面得以去除.此光催化/吸附除As(Ⅲ)机理能够很好的解释上述实验结果, 证实了CeO2-Fe3O4复合材料兼具良好的光催化活性和吸附性能.
4 结论(Conclusions)
1) 磁性CeO2-Fe3O4复合物为介孔材料, 比表面积、平均孔径分别为174.69 m2·g-1和15.03 nm;并具有稳定的弱铁磁性, 饱和磁化强度为51.26 emu·g-1.
2) 在紫外作用下, As(Ⅲ)能完全被氧化为毒性较低的As(Ⅴ), 同时将As(Ⅴ)高效吸附于CeO2-Fe3O4粒子表面.
3) 在中性条件下, CeO2-Fe3O4粒子对As(Ⅴ)的饱和吸附量为122.19 mg·g-1, 其对As(Ⅴ)的吸附过程以化学吸附为主导.
4) 共存离子Cl-和SO42-对As(Ⅴ)的吸附没有显著影响, 而CO32-、SiO32-和PO43-与As(Ⅴ)存在明显的竞争吸附, 使As(Ⅴ)的吸附去除效果明显降低.
5) CeO2-Fe3O4复合吸附剂可快速实现固液分离, 容易再生且重复利用性较好, 具有一定的实际应用价值.(来源:环境科学学报 作者:孙天一)