缺氧/好氧(AO)工艺是最常用于高浓度含氮有机废水处理工艺之一,AO工艺反硝化前置,脱氮效率较高,但出水中仍含有一定浓度的硝酸盐,需要进一步处理,此时,经AO工艺处理后的出水中有机物浓度较原进水浓度已大大降低,呈现出低C/N比的特点。在实际工程应用中,往往不得不外加碳源来深度脱氮。
在外加碳源时,碳源种类、C/N比是影响反硝化效果的2个重要因素。在碳源种类上,之前甲醇被认为是理想的碳源,但由于其属于危化品,应用受到了限制。乙酸钠和葡萄糖作为无毒、价格低廉的外加碳源,应用越来越广泛。在C/N比方面,确定一个适当的C/N比非常重要,因为过量添加碳源不仅增加成本,还可能给反硝化脱氮带来负面影响,此外,过量的碳源还会造成出水有机物含量超标。AKUNNA等以葡萄糖作为唯一碳源,采用连续流厌氧反应器,水力停留时间(HRT)保持为10 d,实验发现:在C/N>19.9时,硝酸盐异化还原成铵(DNRA)是硝酸盐还原的主要途径,此外,还同时产甲烷;在3.3≤C/N≤19.99时,反硝化和DNRA会同时发生;当C/N<3.3时,只有反硝化发生。RUIZ等[4]以乙酸钠为碳源,HRT保持为6.4 h,采用上流式污泥床反应器(USB),发现低C/N会提高反硝化活性,而高C/N会提高产甲烷活性。当C/N为0.375时,会出现严重的亚硝酸积累,硝酸盐去除很少;C/N>1.875时,硝酸盐可被全部去除;C/N≤3.75时,有机碳源主要被反硝化菌利用;当C/N达到37.5时,有机碳源97%以上用于产甲烷。CHIU等以乙酸钠为碳源,采用半连续流反应器,保持HRT<50 h,运用改进的BERNET模型法对实验结果进行分析,得出:初始硝酸盐浓度越低,相应的最优C/N比越大,25、50、100和200 mg·L−1的初始硝酸盐浓度对应的最优C/N比分别为2.1、1.7、1.5和0.9。前期研究表明,以乙酸钠作碳源,即使C/N低至1.5,仍可以取得较好的厌氧反硝化效果。
总的来说,当废水生物处理反应器中同时存在硝酸盐和有机物时,除同化作用外,反硝化、产甲烷和DNRA这3个反应都可能发生。反硝化脱氮效果跟C/N比、碳源种类、HRT都有关系。然而,已有研究主要关注的是碳源种类和C/N比,而重点关注HRT对反硝化影响的研究还鲜有报道。
本研究采用UASB作为厌氧反硝化反应器,选定C/N比为1.5,主要研究HRT对以葡萄糖和乙酸钠作外加碳源时反硝化效果的影响,以期为HRT的优化选择提供依据。
1 材料与方法
1.1 装置与运行方式
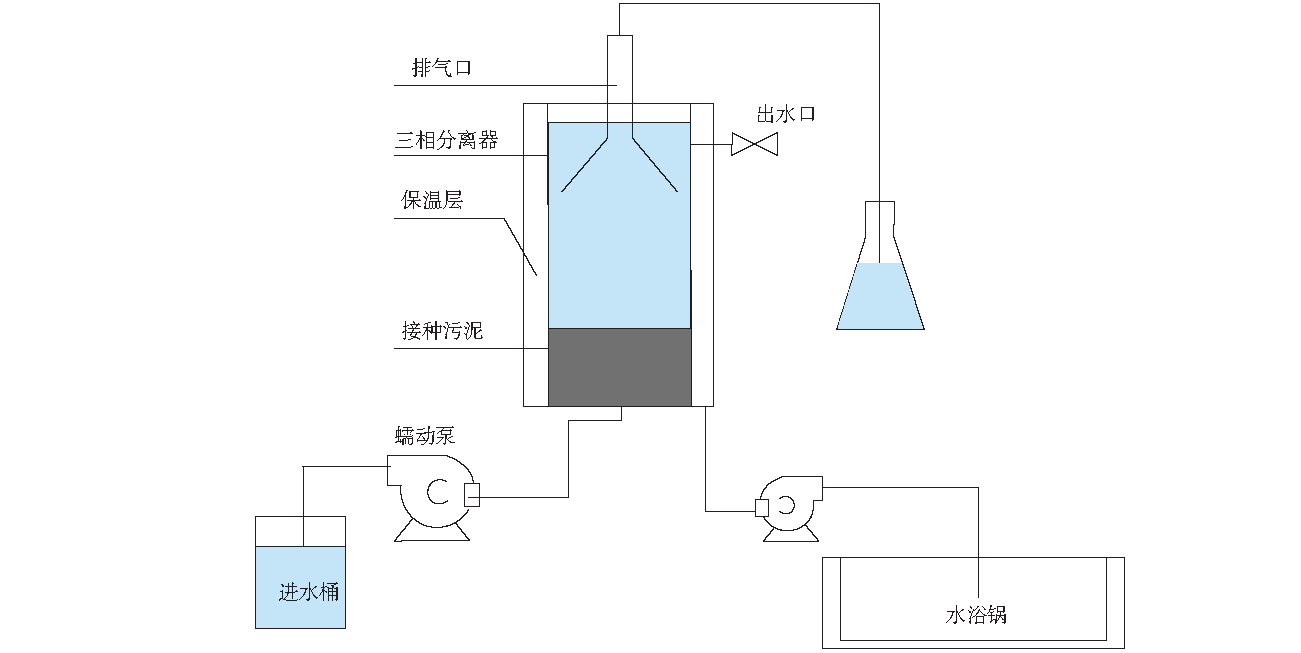
实验采用有机玻璃材质的上流式厌氧污泥床反应器(UASB),反应器的有效容积为1 L,高280 mm,内径70 mm,如图1所示。装置在(35±1)℃恒温水浴下运行,反应器底部进水,上部出水,采用蠕动泵调节进水流量。分别设置R1(外加碳源为葡萄糖)和R2(外加碳源为乙酸钠)2组反应器。
在进水NO3−-N(以N计)浓度为50 mg·L−1、C/N比为3、HRT为8 h、温度为(35±1)℃的条件下以连续运行模式启动,运行6 d后,NO3−-N去除率基本达到100%,再逐次降低C/N比(3→2→1.5),每个C/N比下连续运行6 d。之后,保持进水NO3−-N浓度不变、C/N比为1.5不变,逐步改变HRT(8 h→6 h→4 h→2 h),每个HRT下连续运行15 d,在后6 d(即第9~15天)取样分析。
图1 实验装置示意图
1.2 污泥特性及模拟处理水质
实验接种污泥取自成都市某污水处理厂污泥贮存池,该污泥MLSS浓度为9 860 mg·L−1,污泥含固率为1.9%,MLVSS/MLSS为0.67,呈暗黑色。为R1和R2接种污泥,驯化开始前初始污泥MLSS浓度为3 000 mg·L−1,经过18 d的驯化后,R1和R2中驯化污泥MLSS浓度分别为3 674和3 250 mg·L−1,含水率均为99.0%,MLVSS/MLSS均为0.70,呈深黑色。
进水采用人工模拟废水,主要成分是葡萄糖或乙酸钠、硝酸钠和磷酸二氢钠,分别做碳源、氮源和磷源。每1 L自来水中溶入187.5 mg葡萄糖或256.25 mg无水乙酸钠、303.6 mg硝酸钠、3.5 mg磷酸二氢钾,另外,加入1 mL微量元素(每1 L微量元素溶液含30 mg MnCl2·4H2O、10 mg CuCl2·H2O、70 mg ZnSO4·7H2O、300 mg H3BO3、600 mg CoCl2·6H2O、20 mg NiCl2·6H2O、1 000 mg EDTA)。
1.3 分析方法
NO3−-N、NO2−-N、NH4+-N、MLSS、MLVSS按标准方法测定,TOC和TN采用岛津TOC-V分析仪测定。各项指标测定时均重复3次。
1.4 硝酸盐转化为亚硝酸盐的转化率
硝酸盐转化成亚硝酸盐的转化率[8]可根据式(1)计算:
R = (C(NO2−-Ne) - C(NO2−-Ni))/(C(NO3−-Ni) –C(NO3−-Ne))×100% (1)
式中:R为硝酸盐转化成亚硝酸盐的转化率,%; C(NO2−-Ni)为进水亚硝态氮的浓度,mg·L−1;C(NO3−-Ni)为进水硝态氮的浓度,mg·L−1;C(NO2−-Ne)为出水亚硝态氮的浓度,mg·L−1;C(NO3−-Ne)为出水硝态氮的浓度,mg·L−1。
1.5 反硝化速率
反硝化速率(Kde)[9]可根据式(2)计算:
Kde = ΔNO3−-N/(VXV) (2)
式中:ΔNO3−-N 为反硝化去除的硝态氮的量,mg;V为反应器容积,L;XV为反应器内的MLVSS浓度,mg·L−1。
2 结果与分析
2.1 HRT对NO3−-N去除的影响
在反应器连续运行模式下,考察不同HRT(8、6、4和2 h)对NO3−-N去除的影响,实验结果如图2所示。
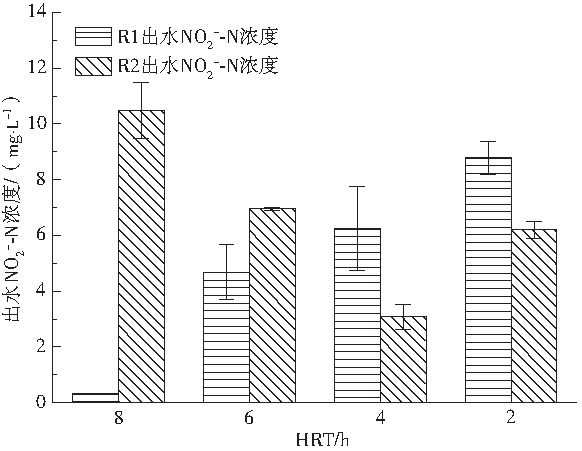
图2 不同HRT下出水NO3−-N浓度
如图2所示,对R1,外加碳源为葡萄糖,C/N比为1.5时,当HRT从8 h→6 h→4 h→2 h,R1出水NO3−-N浓度从17.99 mg·L−1→10.26 mg·L−1→13.26 mg·L−1→16.60 mg·L−1,相应NO3−-N去除率从64.0%→79.5%→73.5%→66.8%。在R1中,有机碳源不仅被反硝化菌所利用,也会被发酵细菌等其他异养菌所利用。当HRT从8 h降至6 h时,NO3−-N去除率升高,说明有更多的碳源被反硝化菌所利用。然而,当HRT从6 h进一步下降时,R1出水NO3−-N浓度出现一定的回升,相应NO3−-N去除率也有所下降。这表明过短的HRT会给反硝化菌带来负面影响。就本实验而言,当采用葡萄糖作为外加碳源时,HRT过短,部分葡萄糖还处于酸化发酵阶段就被水流带出,进而不能为反硝化提供足够的电子。
对R2,外加碳源为乙酸钠,C/N比为1.5时,当HRT从8 h→6 h→4 h→2 h,R2出水NO3−-N浓度从0.96 mg·L−1→0.92 mg·L−1→0.51 mg·L−1→1.27 mg·L−1,相应NO3−-N去除率从98.1%→98.2%→99.0%→97.5%。总体来看,即使HRT从8 h降至2 h,NO3−-N去除率仍维持在很高的水平,出水NO3−-N浓度很低。这说明即使HRT缩短至2 h,反硝化仍能顺利地进行。殷芳芳等指出,以乙酸钠为碳源时,2 h就能完成反硝化反应。曹相生等以乙酸钠为碳源采用序批式反应器研究污水的反硝化规律时发现,当C/N比为1时,NO3−-N在155 min内反应完全;当C/N比为1.8时,NO3−-N在90 min内即反应完全。这与本实验中R2对NO3−-N的去除效果基本相符。
对比R1和R2来看,就NO3−-N的去除效果而言,以乙酸钠为碳源明显优于葡萄糖。一个合理的解释是乙酸钠属于简单碳源,易于被反硝化菌直接利用,而葡萄糖相对复杂,需先经过酸化发酵,才能被反硝化菌有效利用。GUO等发现,以剩余活性污泥的酸化液作为碳源进行反硝化,去除的COD主要被反硝化菌所利用,而碳源换成剩余活性污泥的水解液,则去除的COD不仅被反硝化菌所利用,也会被其他异养菌所利用。其原因在于,剩余活性污泥的酸化液含有更多的乙酸等挥发性脂肪酸(VFAs)成分,更有利于被反硝化菌所利用。此外,就乙酸钠作为碳源而言,NO3−-N通过异养反硝化完全还原为N2所需的C/N比为1.5,计算依据见式(3):
0.125CH3COO− + 0.143 8NO3− + 0.143 8H+→0.012 2C5H7O2N + 0.065 8N2 +
0.125HCO3−+ 0.063 9CO2 +0.154 2H2O (3)
若以葡萄糖作为碳源,所需的C/N比则增大至1.56[13],计算依据见式(4):
C6H12O6 + 2.8NO3− + 0.5NH4+ + 2.3H+ → 0.5C5H7O2N + 3.5CO2 +6.4H2O + 1.4N2(4)
换言之,在相同的C/N比条件下,葡萄糖还原的硝酸盐更少。MATEJU等研究表明,用乙酸进行反硝化时的污泥产率系数为0.07,而用葡萄糖进行反硝化时的污泥产率系数为0.18,说明葡萄糖作碳源时,有更多的COD用于了合成代谢,异养反硝化消耗的COD比例相对有所降低。具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2.2 HRT对NO2−-N累积、NH4+-N生成的影响
在反应器连续运行模式下,考察不同HRT对NO2−-N累积和NH4+-N生成的影响,结果如图3所示。
图3 不同HRT下出水NO2−-N浓度
如图3所示,对R1,在C/N比为1.5时,当HRT时间从8 h→6 h→4 h→2 h,R1出水NO2−-N浓度不断升高,从0.31 mg·L−1→4.69 mg·L−1→6.24 mg·L−1→8.79 mg·L−1,相应地,硝酸盐转化为亚硝酸盐的转化率不断升高,NTR值从1.0%→11.8%→17.0%→26.3%。这一结果可从反硝化过程来解释,根据简化的生物反硝化过程:
NO − 3 −N− → − − − − 硝酸盐还原酶 NO − 2 −N− → − − − − − 亚硝酸盐还原酶 N 2 NO3−−N→硝酸盐还原酶NO2−−N→亚硝酸盐还原酶N2(5)
亚硝酸盐还原酶和硝酸盐还原酶要竞争基质电子,且前者的活性低于后者。从反应能耗角度看,NO3−-N还原成NO2−-N的反应能耗Ea为3.68~4.88 kJ,而NO2−-N还原成N2的反应能耗Ej为13.86~20.08 kJ,后者明显大于前者,因此,NO3−-N转换为NO2−-N比NO2−-N转换为N2更容易。在低C/N下,碳源提供的能量和电子不足,NO2−-N容易积累。此外,本实验中R1外加碳源为葡萄糖,HRT缩短,对葡萄糖的酸化不利,使得易被反硝化利用的碳源更紧缺,尤其对反硝化后阶段的亚硝酸盐还原不利,因此,NTR值随之增大。譬如,HRT为8 h时,R1的NTR值为1.0%,当HRT降至2 h时,NTR值显著升高至26.3%。
对R2,当HRT从8 h→6 h→4 h→2 h,R2出水NO2−-N浓度从10.47 mg·L−1→6.95 mg·L−1→3.08 mg·L−1→6.20 mg·L−1,从结果看,HRT从8 h降至4 h时,出水NO2−-N浓度明显降低,这说明有更多的碳源被反硝化菌所利用。值得注意的是,当HRT进一步降至2 h时,出水NO2−-N浓度出现了回升,推测原因是,由于HRT过短,积累的NO2−-N未及时被彻底反硝化就被水流带出。有研究表明,在序批式反应器进行反硝化实验,NO2−-N浓度有先升高后降低的趋势,NO2−-N需要一定时间累积达到峰值而后再降低,这一结果表明HRT对NO2−-N的积累有重要的影响。
不同HRT对NH4+-N生成的影响结果如图4所示。
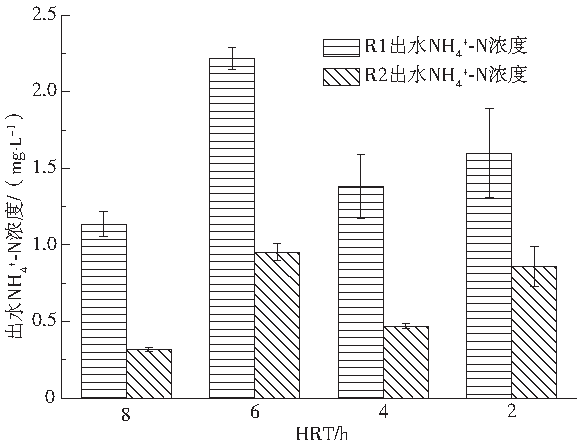
图4 不同HRT下出水NH4+ -N浓度
从图4可以看出,R1和R2中均有NH4+-N生成,但本实验中并未在进水中加入NH4+-N,这说明反应器中发生了DNRA的反应。AKUNNA等[3]研究发现,以葡萄糖作为碳源时,有利于NO3−-N还原为NH4+-N,而以VFA作为碳源时,则有利于NO3−-N反硝化转换为N2。这与本实验中R1出水NH4+-N浓度普遍高于R2的结果相符合。一般认为,反硝化过程是DNRA过程的主要竞争者,DNRA现象常在较高的C/N比下出现。但共培养实验显示,无论哪类细菌数量占优,都共同利用环境中的氮源和碳源,不抑制对方生长。这也解释了为什么本实验中C/N比较低,但仍然有DNRA发生的现象。当HRT从8 h→6 h→4 h→2 h,R1出水NH4+-N浓度从1.14 mg·L−1→2.22 mg·L−1→1.38 mg·L−1→1.60 mg·L−1;R2出水NH4+-N浓度从0.32 mg·L−1→0.95 mg·L−1→0.47 mg·L−1→0.86 mg·L−1。R1和R2的NH4+-N生成量表现出相同的趋势(先升高再降低而后再升高)。以R1为例,当HRT为8 h时,出水NH4+-N浓度为1.14 mg·L−1,而当HRT缩短至6 h,出水NH4+-N浓度升高至2.22 mg·L−1。这说明HRT从8 h缩短为6 h,DNRA细菌跟反硝化菌之间的平衡发生了更有利于前者的变化。然而当HRT缩短至4 h,出水NH4+-N浓度随之下降至1.38 mg·L−1。推测原因,当HRT为4 h,DNRA产生的氨氮可能更多地成为了其他微生物(特别是反硝化菌)的氮源参与了合成代谢,至于是否发生了厌氧氨氧化过程导致NH4+-N浓度降低,需要进一步深入研究。值得注意的是,当HRT进一步降至2 h时,出水NH4+-N浓度出现了一定程度的回升,这可能是因为HRT过短,生成的NH4+-N来不及被合成代谢过程消耗就进入到出水中。
2.3 HRT对TOC、TN去除效果的影响
从图5可见,当HRT从8 h→6 h→4 h→2 h,R1出水TOC浓度从27.77 mg·L−1→ 14.81 mg·L−1→ 11.77 mg·L−1→15.93 mg·L−1,TOC去除率从63.0%→80.2%→84.3%→78.8%;R2出水TOC浓度从20.32 mg·L−1→11.87 mg·L−1→3.96 mg·L−1→8.99 mg·L−1,TOC去除率从72.9%→84.2%→94.7%→88.0%。总的来看,R1和R2出水TOC随HRT变化趋势是一致的。值得注意的是,当HRT从8 h缩短至4 h时,R1和R2的TOC去除率不降反升。分析原因,废水中TOC主要可能通过有机碳源参与反硝化生成二氧化碳、同化作用合成新的细胞体以及甲烷化3种途径去除,本实验中未观测到有甲烷气体产生,因此,在R1和R2中,前2种应是TOC去除的主要途径。本实验中废水C/N仅为1.5,属低C/N比废水,有机碳源主要用于反硝化,这与RUIZ等的研究结论一致。就R1而言,当HRT较长时(如8 h和6 h),发酵细菌会跟反硝化菌争夺碳源,但发酵过程主要生成一些酸类、醇类等中间产物,并未直接将有机物全部转化成CO2和甲烷,相应的TOC去除并不多。对R2,相对较长的HRT可能有利于其他异养菌(发酵细菌以外)同反硝化菌竞争有限的碳源,而反硝化又在去除TOC上有相对较大的贡献。此外,HRT缩短(从8 h→4 h),UASB反应器内的上升流速增加,强化了反应器内的泥水混合,提高了传质效率,这也是R1和R2中TOC去除率不降反升的重要原因。当HRT从4 h进一步缩短至2 h时,R1和R2的TOC去除率均下降,这是因为,在过短的HRT下,一方面,反硝化消耗的碳源会减少;另一方面,溶解性微生物产物的洗出效应增强,导致出水TOC升高。
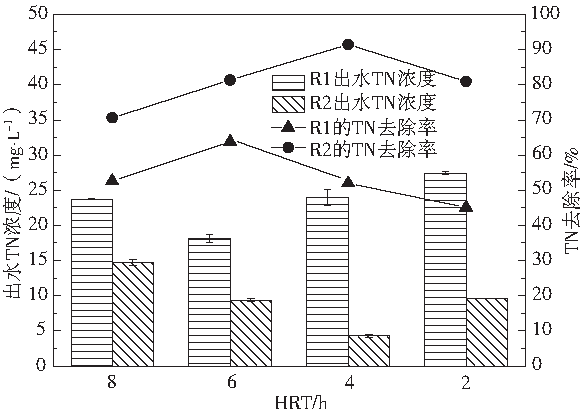
图6 不同HRT下TN去除情况
从图6可见,当HRT从8 h→6 h→4 h→2 h,R1出水TN浓度从23.70 mg·L−1→18.11 mg·L−1→24.01 mg·L−1→27.44 mg·L−1,相应地,TN去除率从52.6%→65.8%→52.0%→45.1%;R2出水TN浓度从14.69 mg·L−1→9.35 mg·L−1→4.28 mg·L−1→9.54 mg·L−1,相应地,TN去除率从70.6%→81.3%→91.4%→80.9%。总的来看,R1和R2出水TN浓度随HRT变化趋势是一致的。就R1而言,当HRT为6 h时,TN去除效果最佳。当HRT较长(如8 h)时,在葡萄糖发酵过程中,反硝化菌以外的异养菌会消耗部分碳源,对TN去除不利。而当HRT较短(<6 h),葡萄糖未能完全转化成易被反硝化菌利用的乙醇,对TN去除也不利。对R2,HRT为4 h时最佳,分析原因,R2以乙酸钠为碳源,易于被反硝化菌所利用,HRT为4 h可以兼顾硝酸盐还原和亚硝酸盐还原过程。苑泉等[18]亦得出了相似的结论。
从图5、图6来看,R2出水TN和TOC浓度均低于R1。事实上,硝态氮还原成亚硝态氮、DNRA都只不过是不同氮素形态之间的转化,不会导致TN减少,去除TN只能通过异化反硝化生成气态物质(主要为N2)以及同化作用来实现,其中,异化反硝化占主导。本实验中,R1的反硝化速率为1.23×10−3~5.14×10−3 h−1,而R2的反硝化速率为2.70×10−3~1.07×10−2 h−1,同样的HRT条件下,R2的反硝化速率是R1的1.76~2.19倍。因此,就异化反硝化而言,乙酸钠是比葡萄糖更优质的碳源。
3 结论
1)在采用外加碳源进行UASB厌氧反硝化深度脱氮时,HRT对反硝化效果有显著影响,且跟碳源种类有关。
2)进水NO3−-N浓度为50 mg⋅L−1,C/N比固定为1.5,当外加碳源为葡萄糖时,最佳HRT为6 h,此时NO3−-N和TN的去除效果最好,去除率分别为79.5%和63.8%;当外加碳源为乙酸钠时,最佳HRT为4 h,对应的NO3−-N和TN去除率分别为99.0%和91.4%。
3)HRT会影响反硝化菌、DNRA菌和其他异养菌之间的平衡。(来源:环境工程学报 作者:吴姣姣)