厌氧氨氧化(anaerobic ammonia oxidation, ANAMMOX)是指厌氧条件下, 厌氧氨氧化菌以氨(NH4+)为电子供体, 以亚硝酸盐(NO2-)为电子受体进行反应直接生成氮气(N2)的一种新型生物处理技术.由于其无需外加有机碳源且无需曝气充氧, 运行费用可比传统脱氮工艺节省近40%.厌氧氨氧化是微生物和环境领域的重大发现, 已经成为当前生物脱氮领域的研究热点, 也为节能降耗的污水脱氮提供了可能.
随着我国经济的发展, 水资源需求量急剧增加的同时, 水污染情况也越来越严重, 大量含氨且高盐度废水难以处理.我国《污水综合排放标准(GB 8978-1996)》中并未对氯化物进行限定, 一般工业生产为减少管道腐蚀, 通常限定Cl-排放浓度低于10 000 mg·L-1.工业生产产生的废水中如湿式石灰-石膏烟气脱硫脱硝工艺废水、榨菜加工企业废水、石油加工废水等, 高浓度的Cl-和NH4+-N往往是这类废水的共性.
研究人员从海洋污泥样品中发现厌氧氨氧化菌株, 表明一些厌氧氨氧化菌具有耐盐性.但是, 目前直接从海洋底层分离耐盐厌氧氨氧化菌难以实现, 逐步地盐度驯化是淡水厌氧氨氧化适应高盐度废水的最佳途径.迄今为止, 国内外研究学者对含盐废水的研究全部集中在小试阶段, 且多为短期影响, 如Chen等通过分批实验考察了小试反应器中不同离子种类盐度对厌氧氨氧化反应器脱氮的影响; Kartal等在小试反应器中采用淡水系统污泥菌种, 以逐步适应盐度的方式实现反应器对盐度废水的脱氮处理.然而, 有关中试规模厌氧氨氧化的长期盐度驯化研究未见报道.
本研究采用中试规模的厌氧序批式反应器(ASBR), 通过考察不同盐度(Cl-浓度)对厌氧氨氧化脱氮性能的影响, 探索了ANAMMOX-ASBR系统处理高盐度含氮废水的可行性及其在高盐度条件下的恢复特性, 以期为厌氧氨氧化技术处理含盐废水的实际工程应用提供实验数据支撑与理论依据.
1 材料与方法1.1 实验装置
本实验采用一座ASBR反应器, 结构如图 1所示.反应器由有机玻璃制成, 总体积700 L, 有效体积530 L.人工配置废水从上端进水口由增压泵泵入反应器.反应器内置电动搅拌器与恒温加热器, 反应器表面以黑布包裹, 防止光线对厌氧氨氧化污泥造成负面影响.反应器内恒温35℃±1℃, 进水pH值为7.4±0.2.反应器每天运行1个周期, 运行一个周期时间为24 h, 包括进水30 min, 反应20 h, 静置沉淀3 h, 排水30 min.
图 1
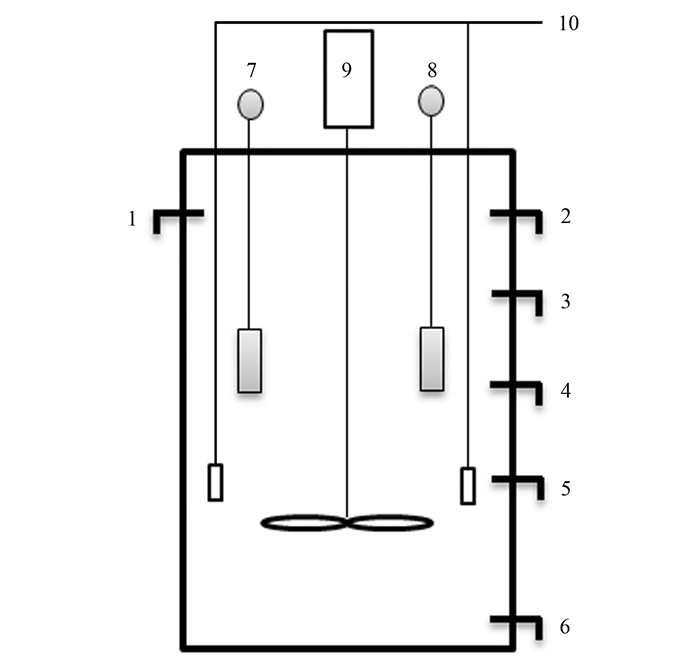
1.2 接种污泥
接种污泥取自本实验室成功启动的中试厌氧氨氧化ASBR反应器, 其已具备较好的脱氮性能, NH4+-N和NO2--N去除率分别高达97.1%和99.0%.接种后反应器内混合液悬浮固体浓度(MLSS)为1.80 g·L, 污泥沉降比(SV%)为9.0%.
1.3 实验废水
本实验采用人工配制的模拟废水, 主要成分(mg·L-1)为:KH2PO4 20, CaCl2·2H2O 107, KHCO3 1 250, MgSO4·7H2O 45.微量元素[11]浓缩液Ⅰ (1 mL·L-1):EDTA 5 g·L-1, FeSO4·7H2O 5 g·L-1, 微量元素Ⅱ(1 mL·L-1):EDTA 15 g·L-1, H3BO3 0.014 g·L-1, MnCl2·4H2O 0.99 g·L-1, CuSO4·5H2O 0.25 g·L-1, ZnSO4·7H2O 0.43 g·L-1, NiCl2·6H2O 0.19 g·L-1, Na2MoO4·2H2O 0.22 g·L-1, CoCl2·6H2O 0.24 g·L-1, NaSeO4·10H2O 0.21 g·L-1.
NH4+-N和NO2--N分别由NH4Cl和NaNO2-按需提供, Cl-以NaCl提供.进水NH4+-N和NO2--N的浓度按照1: 1.32的比例, 将初始NH4+-N浓度设定为50 mg·L-1, 初始NO2--N浓度设定为65 mg·L-1.为了提供厌氧环境, 人工配制的模拟废水使用高纯氮气(纯度为99.99%)吹脱约15 min, 使溶解氧降至0.4 mg·L-1以下.
1.4 分析项目和方法
水样分析项目的测定按照标准方法进行[12], NH4+-N:纳氏试剂法; NO2--N:N-(1-萘基)-乙二胺分光光度法; NO3--N:麝香草酚分光光度法; MLSS:重量法; pH值:雷磁pHS-25;紫外/可见分光光度计:UV-5200;分子生物学分析方法:16S rRNA高通量测序技术.
1.5 恢复动力学模型
动力学模型被广泛采用来描述和模拟微生物反应过程和性能.适用于ASBR厌氧氨氧化反应器的恢复动力学模型主要有修正的Logistic模型[13][式(1)], 修正的Boltzmann模型[14][式(2)]和修正的Gompertz模型[13][式(3)].修正的Logistic模型曾被用来描述批次实验中以葡萄糖为基质的产氢过程; 修正的Boltzmann模型广泛应用于厌氧氨氧化菌的活性再恢复过程; 修正的Gompertz模型最早被用来描述发酵产氢底物降解和产氢细菌(HPB)的生长, 近来被用来描述厌氧氨氧化菌受到苯酚、硫化物等抑制后脱氮性能的恢复过程.
修正的Logistic模型:

修正的Boltzmann模型:
修正的Gompertz模型:

式中, NRR为容积氮去除负荷, kg·(m3·d)-1; NRRmin为最小容积氮去除负荷, kg·(m3·d)-1; NRRmax为最大容积氮去除负荷, kg·(m3·d)-1; Rmax为运行周期的NRR最大恢复速率, kg·(m3·d)-1; λ为恢复延迟时间, d; t为运行时间, d; tc为恢复时间中间值, 即NRRmin+(NRRmax-NRRmin)/2, d; td为恢复时间常数, d.
2 结果与讨论2.1 盐度驯化期间反应器脱氮性能
图 2为中试厌氧氨氧化反应器在盐度驯化期间脱氮性能的变化情况.本实验过程中为防止Cl-浓度对厌氧氨氧化菌产生较大的盐度冲击, 以初始Cl-浓度为1 000 mg·L-1且Cl-浓度1 000 mg·L-1为一个盐度梯度(每个盐度梯度运行约1周)进行盐度驯化实验.
图 2

阶段a(1~33 d), 反应器Cl-浓度由1 000 mg·L-1逐步提升至5 000 mg·L-1, 厌氧氨氧化系统的脱氮性能几乎未受影响.在该阶段, 反应器出水水质稳定, 出水NH4+-N、NO2--N及NO3--N浓度分别平均为0.92、0.81和11.7 mg·L-1, TN去除率保持在90%以上.
阶段b(34~129 d), 反应器内Cl-浓度保持6 000 mg·L-1, 该阶段系统的脱氮性能受到极大影响, 系统脱氮性能呈先下降后上升的趋势.其中, 第34~62 d, 出水NH4+-N和NO2--N浓度逐渐上升, 呈小幅度波动, 盐度对厌氧氨氧化菌的抑制明显.第62 d出水浓度达到最高, NH4+-N、NO2--N及NO3--N的出水浓度分别为41.6、46.1和5.6 mg·L-1, 总氮去除率降至23.4%.第63~90 d, 该时期反应器的氮去除率一直处于较低水平, 脱氮性能既没有持续下降也没有大幅上升.该时期NH4+-N、NO2--N及NO3--N的平均出水浓度分别为40.1、51.3和5.5 mg·L-1, NH4+-N和NO2--N平均去除率为24.6%和24.5%.第91~129 d, 反应器脱氮性能开始转好, 第129 d时NH4+-N、NO2--N及NO3--N的出水浓度分别0、0.5、12.8 mg·L-1, NH4+-N、NO2--N去除率分别为100%和99.1%, TN去除率达89.1%, 出水浓度恢复至阶段a时期的出水水质条件.
阶段c(130~163 d), Cl-浓度由6 500 mg·L-1逐步提高至9 500 mg·L-1.考虑到反应器受盐度抑制程度的加大, Cl-提升梯度改为500 mg·L-1.第130~146 d, Cl-浓度从6 500 mg·L-1逐步提至8 500 mg·L-1, 由图 2可知反应器脱氮性能未受到抑制, 在该时期NH4+-N和NO2--N平均去除率为99.5%和97.9%, 出水NH4+-N和NO2--N接近于0 mg·L-1.可以看出, 反应器中厌氧氨氧化菌已经对盐度有了一定程度的适应性和抵抗能力.第147~163 d, Cl-浓度由8 500 mg·L-1逐步提高至9 500 mg·L-1, 反应器出水水质出现略有波动, 出水NH4+-N和NO2--N浓度最低分别达到20.0 mg·L-1和20.9 mg·L-1.但通过适当延长驯化时间的策略, 反应器在第163 d, NH4+-N、NO2--N和NO3--N出水水质分别为1.4、3.1和10.0 mg·L-1, NH4+-N和NO2--N的去除率为97.4%和94.8%, TN去除率88.7%.
阶段d(164~220 d), Cl-浓度保持在10 000 mg·L-1.第164 d由于反应器盐度的提高, NH4+-N和NO2--N出水浓度迅速提高至22.6 mg·L-1和21.0 mg·L-1, 去除率分别下降至57.0%和67.4%.但随着驯化的进行, 反应器的脱氮效率整体保持逐步提高的趋势.并且, 当反应器进水氨氮和亚硝酸盐氮浓度分别提高至约80 mg·L-1和100 mg·L-1后, 反应器脱氮性能仍保持良好.第220 d, 反应器NH4+-N、NO2--N和NO3--N的出水浓度分别为0、0.7和13.1 mg·L-1, NH4+-N和NO2--N去除率分别达100%和99.3%, 总氮去除率达到92.3%.说明本实验条件下, 中试ANAMMOX-ASBR系统可用于高盐(Cl-浓度10 000 mg·L-1)废水的高效脱氮.
2.2 中试ANAMMOX基质转换特性
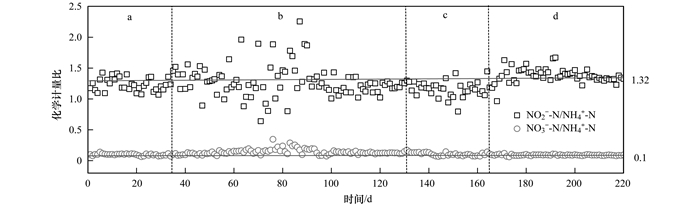
NH4+-N和NO2--N按比例稳定地去除是ANAMMOX工艺稳定运行的关键.通过比较反应器内氮去除的化学计量比变化情况, 考察盐度对厌氧氨氧化菌活性的影响程度.
由图 3可知, 反应器中硝酸盐氮的生成一直处于偏低水平, 低于理论值0.26, 推测反应器中存在反硝化反应.由化学计量关系(1: 1.32: 0.1)推测反应器中存在的反硝化过程主要为全程反硝化(NO3--N N2), 并且反硝化受盐度影响较小.通过对反应器进出水COD的测定, 测得实际化学需氧量减少值ΔCOD为31.2 mg·L-1, 本化学计量比中反硝化理论消耗COD值为: 80 mg·L-1×(0.26-0.1)×2.86=36.6 mg·L-1(80 mg·L-1为初始NH4+-N浓度, 2.86为单位NO3--N反硝化为N2所需的COD量, 以N/COD计, mg·mg-1), 数值较为接近, 证实了系统中反硝化反应的存在.另外, 在阶段a, NO2--N/NH4+-N稳定在1.32左右.从图 3可以发现, 在阶段b, 随着反应器脱氮性能的逐步下降, NO2--N/NH4+-N的值波动较大, 尤其在该过程的中期(第80 d左右)波动最大; 但随着反应器脱氮性能的逐步恢复, NO2--N/NH4+-N的比值趋于稳定, 并接近1.32.阶段c反应器脱氮性能受影响较小, 化学计量比波动也较小.阶段d, 该阶段前期虽影响较大, 但反应比例变化较小, 略高于1.32, 随着反应的逐步稳定, NO2--N/NH4+-N比值逐渐趋于1.32.
图 3
图 3 反应器内氮去除化学计量比由此可见, 反应器在盐度驯化过程中, 反应过程的化学计量比也随着不同盐度的影响而发生变化.尤其在阶段b, 化学计量比波动最大.这可能是由于在Cl-浓度6 000 mg·L-1时, 厌氧氨氧化菌活性受到盐度强烈抑制, 而其他厌氧菌(如反硝化菌等)受影响程度各不相同, 导致反应器内菌群结构稳定性差, 氮去除比例波动大.然后, 随着驯化的持续进行, NO2--N/NH4+-N比值逐步趋于1.32, 该现象也可作为判断盐度驯化的恢复过程的一项指示.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2.3 盐度抑制的恢复动力学
盐度驯化过程中, 在Cl-浓度6 000 mg·L-1和10 000 mg·L-1这2个盐度梯度内厌氧氨氧化菌受影响程度较大, 从常用的恢复动力学模型中选出最适的动力学模型并比较两个不同盐度条件下的恢复特性. 6 000 mg·L-1和10 000 mg·L-1两个盐度的恢复过程分别为83~130 d和164~220 d.
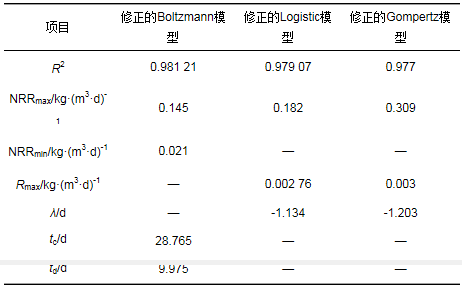
分别运用修正的Boltzmann模型、修正的Logistic模型和修正的Gompertz模型对Cl- 6 000 mg·L-1时受到抑制的厌氧氨氧化菌的NRR恢复过程进行拟合, 结果如表 1所示.从中可知, 3个模型都具有较高的相关系数R2, 基本参数符合实际意义, 但是修正的Boltzmann模型NRRmax与真实值相对误差最小, 误差为8.2%.所以修正的Boltzmann模型较另外两者拟合程度更高, 更适合该盐度条件抑制下的NRR恢复过程.另外, 恢复中间值tc为28.765 d, 常数td为9.975 d.
表 1 Cl-浓度6 000 mg·L-1时动力学模型拟合参数
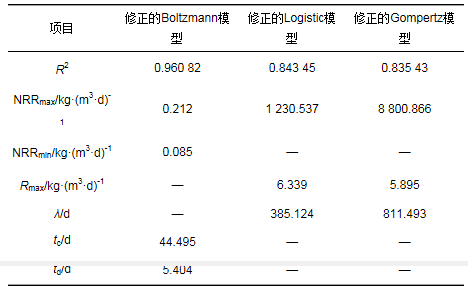
同样运用修正的Boltzmann模型、修正的Logistic模型和修正的Gompertz模型对Cl- 10 000 mg·L-1时受到抑制的厌氧氨氧化菌的NRR恢复过程进行拟合, 结果如表 2所示.从相关系数R2可以明显地看出此时修正的Boltzmann模型比另外两个动力学模型具有更好的拟合效果.此外, 修正的Logistic模型和修正的Gompertz模型不具有实际意义, 所以在Cl- 10 000 mg·L-1时受到抑制的厌氧氨氧化菌恢复过程中, 修正的Boltzmann模型较为适用.修正的Boltzmann模型拟合的NRRmax为0.212 kg·(m3·d)-1, NRRmin为0.085 kg·(m3·d)-1, 恢复时间中间值tc为44.495 d, td为5.404 d.
表 2 Cl-浓度10 000 mg·L-1时动力学模型拟合参数
从图 4中两个不同盐度条件下厌氧氨氧化菌受抑制后的恢复过程动力学可以看出, 修正的Boltzmann模型在两个不同的盐度恢复条件下均适用, 但是在两者的恢复时间中间值tc相差了15.73 d.其原因可能是因为驯化前反应器中的厌氧氨氧化菌是淡水菌, 在极端的高盐条件下可以通过胞内合成相容性物质或产生更多的胞外聚合物的机制来抵抗环境渗透压, 细胞的这一系列反应过程中需要消耗大量的能量, 导致在Cl-浓度6 000 mg·L-1和10 000 mg·L-1的盐度提升的初期细胞扩增缓慢, 反应器脱氮性能低.比较6 000 mg·L-1和10 000 mg·L-1这两个不同梯度可以看出, 更高的盐度环境下, 盐度提升初期需要更长的适应时间, 因为在高盐度环境下, 渗透压对非嗜盐性的厌氧氨氧化菌的影响更大, 细菌生长增殖速率降低, 需要更长的适应期才能恢复细胞活性.
图 4
图 4 Cl-浓度6 000 mg·L-1和10 000 mg·L-1时恢复动力学模拟曲线2.4 盐度驯化过程污泥性状变化
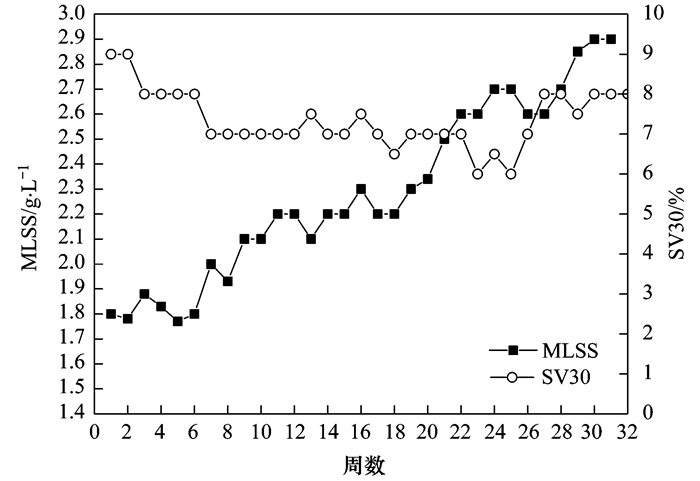
通过每周检测反应器中污泥浓度, 考察盐度驯化过程对污泥生长的影响, 如图 5所示.从中可以看出, 第1~4周(阶段a), 反应器中污泥浓度略有提高.有研究表明低浓度盐度可以促进厌氧氨氧化反应, 提高厌氧氨氧化菌细胞内某种酶的活性, 从而可以提高其反应活性, 促进厌氧氨氧化菌生长代谢, 本研究的污泥增长情况与相关研究类似.第5~18周(阶段c), 在该阶段前期污泥浓度稍有提高, 随后保持约2.2 g·L-1不变.这可能是由于此阶段总氮去除率较低, 多数厌氧氨氧化菌处于盐度适应期, 菌体倍增时间大大延长.第19~31周(阶段c、d), 随着盐度的持续提高以及脱氮性能的逐步稳定, 污泥浓度整体也呈上升趋势, 并在最终Cl-浓度10 000 mg·L-1时达到2.9 g·L-1.但是, 值得注意的是, 在污泥浓度逐步提高的过程中, 污泥沉降比(SV30)却并未有大幅度变化, 仍保持约8%左右.说明该盐度驯化过程中, 厌氧氨氧化菌可能主要进行胞内相容性物质的吸收、合成, 以抵抗盐度胁迫作用.
图 5
图 5 盐度驯化过程中污泥浓度变化对比污泥驯化的不同时期(图 6)污泥颗粒可以发现, 驯化完成后厌氧氨氧化颗粒更加饱满.这一方面可能是由于盐度环境下增强了颗粒污泥的聚集能力, 另一方面可能是长期驯化过程中, 厌氧氨氧化菌吸收合成了大量的相容性物质(如甜菜碱、海藻糖等), 提高了菌体密度.另外, 从图 6可以看出, 驯化完成的厌氧氨氧化颗粒污泥颜色呈红褐色, 与驯化前的砖红色污泥有明显区别.这可能是盐度环境降低了菌体内的细胞色素C含量, 该现象与其他国内外相关研究学者的厌氧氨氧化盐度驯化结果相似.
图 6
(a)驯化前Cl- 0 mg·L-1; (b)驯化中期Cl- 6 000 mg·L-1; (c)驯化完成Cl- 10 000 mg·L-1图 6 不同盐度驯化时期的污泥性状2.5 反应器菌群结构变化
已经检测出的厌氧氨氧化菌主要有6个属[19, 20], 分别为Candidatus Anammoximicrobium、Candidatus Brocadia、Candidatus Kuenenia、Candidatus Scalindua、Candidatus Jettenia、Candidatus Anammoxoglobus, 其中只有Candidatus Scalindua是海洋性厌氧氨氧化菌.本反应器盐度驯化实验前的优势厌氧氨氧化菌为主要菌属Candidatus Brocadia和Candidatus Jettenia, 丰度分别为10.56%和0.6%.在经历长期的盐度驯化后, 第220 d对反应器内细菌进行分子生物学检测, 优势菌群仍为Candidatus Brocadia和Candidatus Jettenia, 其丰度分别是14.76%和2.7%(图 7), 较驯化前的菌种丰度有所升高.其中厌氧绳菌科(Anaerolineaceae)占总丰度的14.77%、丝状菌占总丰度的13.08%, 外硫红螺旋菌科、酸杆菌门、绿弯菌门及不可培养的细菌占总丰度的20%~30%.因此, 在Cl-浓度10 000 mg·L-1进水条件下, 可以实现中试规模ASBR厌氧氨氧化的盐度驯化和稳定运行, 厌氧氨氧化细菌和其它异养细菌共同存在于反应器中, 厌氧氨氧化表现为优势菌群.此外, 反应器中并未检测出海洋环境中独有的厌氧氨氧化菌菌属Candidatus Scalindua, 说明本反应器中的厌氧氨氧化菌主要是通过吸收、合成相容性物质以对抗渗透压, 并逐步在高盐度下提高自身活性.
图 7
图 7 盐度驯化后反应器中细菌种类及含量分布3 讨论3.1 盐度对ASBR反应器脱氮性能的影响
较低的盐度条件下(Cl-浓度≤5 000 mg·L-1), 盐度的提升对厌氧氨氧化反应器的脱氮性能影响较小, 有研究指出较低的盐度有利于厌氧氨氧化菌的生长.早在1940年Ingram发现, NaCl浓度低于10 g·L-1(Cl-浓度6 000 mg·L-1)时, 添加盐可以增大内源呼吸速率, 但高于10 g·L-1时则减小呼吸速率.本研究中, 6 000 mg·L-1的Cl-浓度在整个盐度驯化的过程中耗时最长, 抑制程度最大.该阶段反应器脱氮性能逐步下降, 随后缓慢地升高, 前后共耗时96 d.齐泮晴等在海水驯化过程中, 50%的海水浓度阶段与本实验有类似变化趋势, 均出现了活性下降期、适应期和活性恢复期.由于此阶段(Cl-浓度6 000 mg·L-1)正处于非嗜盐菌最佳生长盐浓度临界附近, 所以极有可能是厌氧氨氧化菌低盐度环境向中高盐度环境适应的临界盐度值.
Dapena-Mora等的批次实验表明, 厌氧氨氧化菌在盐度为20 g·L-1时表现出活性下降现象, 本研究在Cl-浓度10 000 mg·L-1(NaCl浓度16.7 g·L-1)时即出现了活性下降现象, 这可能与反应器中厌氧氨氧化菌比例高低以及反应器容量大小等因素有关.
3.2 盐度驯化的微生物学机理
本研究实验菌属为淡水厌氧氨氧化菌, 而在淡水微生物的耐盐度方面, 一般细胞遇到盐冲击的应激行为分为5步[26]:①细胞质外流, 细胞皱缩, 体积减小; ②在渗透压的作用下外界溶液进入细胞, 体积恢复; ③排出钠离子, 吸收钾离子; ④合成相容性溶质; ⑤排出钾离子, 积累相容性溶质.细胞在适应盐度的过程中需要消耗大量的ATP, 以及细胞内参与反应的酶受盐度刺激的影响, 会造成氮处理率降低, 但随着微生物对环境的逐步适应以及细胞积累足够的相容性溶质以抵抗渗透压, 其脱氮性能可以逐渐恢复.有研究认为反应器对盐度冲击大体可分为3个阶段[27]:敏感期、过度稳定器和恢复期.本研究在Cl-浓度6 000 mg·L-1和10 000 mg·L-1的两个抑制阶段内, 均经历了长期的过渡期和恢复期, 但是对于敏感期, 显然10 000 mg·L-1比6 000 mg·L-1影响更小, 前者较小的影响可能也得益于长期的驯化过程提高了反应器中微生物对盐度的适应能力.
4 结论
(1) 厌氧氨氧化菌可以通过逐步驯化的方式适应高盐度环境.通过220 d的驯化, ANAMMOX-ASBR系统可在Cl-浓度10 000 mg·L-1环境下完成深度脱氮, 总氮去除率达92.8%.
(2) 通过对比修正的Boltzmann模型、修正的Logistic模型和修正的Gompertz模型这3个恢复动力学模型, 发现修正的Boltzmann模型能够较好地拟合不同盐度抑制后的恢复过程.在Cl-浓度6 000 mg·L-1和10 000 mg·L-1的盐度条件下, 恢复中间值tc分别为28.765 d和44.495 d.
(3) 盐度驯化完成后反应器内优势菌种为Candidatus Brocadia, 污泥密度大大提高, 厌氧氨氧化菌颗粒感加强.(来源:环境科学 作者:唐佳佳)