硝酸盐是污水处理厂尾水中氮的主要形式, 15 mg·L-1的总氮含量能够满足城镇污水处理厂污染物排放的一级A标准, 但仍远超2 mg·L-1的地表水环境V类水标准.硝酸盐的积累导致水体富营养化, 对环境造成极大的危害.另外, 饮用水中硝酸盐含量过高还可能会引发癌症, 危害人体健康.因此, 对低浓度硝酸盐水体的深度处理也日益受到重视.
生物脱氮是一种高效、经济、环保的脱氮方法, 在水体修复过程中经常利用反硝化细菌进行硝酸盐的脱除.但是反硝化细菌活性受环境影响较大, 如碳源、硝酸盐浓度、pH和温度等.有研究表明, 低温能够抑制酶的活性, 减缓微生物的生长, 导致反硝化作用明显减弱.反硝化细菌生长的最佳温度为25~35℃, 而我国冬季气温通常低于20℃, 低温成为冬季微生物反硝化脱氮的限制性因素.目前关于反硝化细菌的研究主要集中于对硝酸盐去除能力的提高, 对低温限制下低浓度硝酸盐水体中反硝化作用的研究仍然较少. Huang等报道Acinetobacter sp. Y16在实验室低温条件下能够取得良好的去除效果, 但没有进一步考察其在水体修复长期应用过程中的稳定性.
本研究分离得到1株低温反硝化菌——施氏假单胞菌, 命名为N3.在此基础上, 考察了初始硝酸盐浓度、温度, 特别是低温对N3反硝化性能的影响.由于水体中C/N普遍较低, 碳源缺少对微生物脱氮产生抑制, 因此本研究分析了不同C/N对硝酸盐去除性能的影响.
1 材料与方法1.1 培养基
溴百里酚蓝培养基(BTB, g·L-1):L-天冬氨酸10; KNO3 10; KH2PO4 10; FeCl2·6H2O 0.5; CaCl2 1.5; MgSO4·7H2O 10. BTB(1%乙醇溶液)10 mL; pH 7.0~7.3.
反硝化培养基(g·L-1):柠檬酸钠5; KH2PO4 1; K2HPO4 1; KNO32; MgSO4·7H2O 0.2. pH 7.2~7.5.
亚硝酸盐培养基(g·L-1):柠檬酸钠5; KH2PO4 1; K2HPO4 1; NaNO22(过滤除菌); MgSO4·7H2O 0.2. pH 7.2~7.5.
1.2 菌株的分离和鉴定
将10 mL泥水混合物转移到100 mL反硝化培养基中, 15℃下连续富集培养.将富集培养后的菌液系列稀释, 分别取10-4、10-5、10-6、10-7浓度下菌液200 μL, 均匀涂布到BTB平板上, 反复分离纯化后挑取蓝色单菌落, 进行后续研究.
基于菌株的16S rDNA序列进行菌种鉴定.菌体总DNA参照EasyPure Genomic DNA Kit(北京全式金生物工程有限公司)的方法进行提取.采用细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492r(5′-GGTTACCTTGTTACGACTT-3′)进行扩增, PCR反应体系(50 μL): 10×Buffer 5.0 μL, dNTPs 4.0 μL, 上游引物和下游引物各1.0 μL, 重蒸水38 μL, 离心混匀后加入DNA模板0.5 μL, Taq酶0.5 μL. PCR反应条件:① 94℃预变性5 min; ② 94℃变性50 s; ③ 52℃退火60 s; ④ 72℃延伸90 s; ⑤ 72℃, 10 min; ②~④步骤循环30次. PCR产物纯化后交由上海生工生物有限公司进行测序.
将获得的细菌16S rDNA序列(MF521886)提交到NCBI(http://www.ncbi.nlm.nih.gov), 利用Blast进行比对, 并结合已有研究中得到验证的相关反硝化细菌序列, 进行同源性比较.利用MEGA7.0软件进行多序列比对分析, 并用Neighbor-Joining法构建系统发育树.
1.3 理化指标分析方法
亚硝酸盐、硝酸盐、总氮的浓度分别按照N-(1-萘基)-乙二胺光度法、紫外分光光度法、过硫酸钾氧化-紫外分光光度法测定, 仪器采用UV 5200紫外/可见分光光度计.去除率按照以下公式计算:
式中, ci代表初始氮浓度(mg·L-1), ct代表终态氮浓度(mg·L-1).
1.4 NarG、nirS和nosZ基因的扩增
反硝化功能基因narG、nirS和nosZ的扩增引物和条件见表 1, 得到的PCR产物用2.0%的琼脂糖凝胶电泳进行检测.
表 1 PCR扩增过程中的引物和程序设计
1.5 环境条件对反硝化功能的影响
分别调节C/N为4、8和12, 温度为4、10、20、30、40、50和60℃, 初始硝酸盐浓度为15、30、40、50、60、70、80、90和100 mg·L-1, 研究不同C/N、温度、硝酸盐浓度对反硝化过程的影响.每个实验均设3个平行, 同时设空白实验作对照.除上述单因素影响实验外, 硝酸盐初始浓度为15 mg·L-1, 反应温度为30℃, C/N=8.
1.6 低温对反硝化功能及基因表达的影响
分别于4、10和15℃下, 定时检测硝酸盐的去除情况.在4、10和30℃条件下, 分别在反应36 h时取一定量的菌液, 6 000 r·min-1离心5 min, 弃上清, 用适量无菌生理盐水重悬, 调节D600为1.各自吸取2 mL菌液, 用Trizol法(北京全式金生物有限公司)提取基因组RNA, 用PrimeScriptTMRT reagent Kit(大连宝生物工程有限公司)进行反转录, 随后利用SYBR Premix Ex TaqⅡ(大连宝生物工程有限公司)进行定量PCR, 对narG、nirS基因的表达活性进行检测.实验中用到的引物和反应条件详见表 1.
1.7 低温下固定化反硝化菌的运行稳定性实验
用10 mL菌体含量为0.2 g的湿菌体与10%的PVA和1%的SA溶液混合均匀, 缓慢滴入1% CaCl2饱和硼酸溶液中, 4℃交联24 h进行固定化, 制备得到直径为0.5 cm左右的均匀小球.将固定化后的N3投加到垂直流装置中, 采用人工配制的低污染水(水质指标见表 2), 以2~3 d为一个进水周期, 在10℃下进行半连续实验.初始C/N=8, 稳定运行4个周期后, C/N调为4.每12 h定时取样, 检测硝酸盐的去除.
表 2 人工配制的低污染水基本水质指标
2 结果与讨论2.1 菌株的分离和鉴定
在15℃时, 采用反硝化培养基经连续富集培养、BTB平板筛选, 得到1株反硝化细菌.它能够在36 h内将硝酸盐完全去除, 且没有亚硝酸盐的积累, 命名为N3.
菌株N3在富集培养基平板上培养24 h, 菌落呈圆形, 淡黄色, 半透明状, 边缘光滑.细胞为短杆状, 大小为(1.5~2.0 μm)×(0.8~1.5 μm), 革兰氏染色呈阴性.系统发育树如图 1所示, 菌株N3与施氏假单胞菌(Pseudomonas stutzeri)在同一分支, 同源性达99%, 可初步鉴定为施氏假单胞菌.
图 1

为进一步验证N3的反硝化能力, 对N3进行了反硝化功能基因的检测.由图 2可见, 反硝化功能基因narG、nirS和nosZ均成功地从N3基因组中得到扩增.
图 2

NarG基因编码膜结合硝酸盐还原酶, 能够在缺氧条件下催化硝酸盐还原为亚硝酸盐, 是反硝化过程的第一步.生成的亚硝酸盐进一步被还原为NO, 这是反硝化过程中的限速步骤, 因此编码亚硝酸盐还原酶的基因nirS和nirK被认为是区分反硝化和其它氮还原过程的关键基因. Heylen等的研究表明, 相比nirK, 由nirS编码的亚硝酸盐还原酶更容易接受电子, 进行反硝化. N3中nirS的存在部分解释了菌株N3所具有的高效反硝化能力.尤其重要的是N3中含有nosZ基因, 其编码的氧化亚氮还原酶能够催化N2O转化为N2, 这表明利用N3进行反硝化脱氮能够减少温室气体N2O的释放.
2.2 不同环境因子对反硝化作用的影响2.2.1 不同C/N对反硝化作用的影响
水体中的硝酸盐不仅能够通过反硝化作用从水体中脱除, 还可以通过微生物同化作用转化为自身生物量, 或者经异化还原作用重新以铵根离子的形式释放到水体中.因此仅凭硝酸盐浓度的减少不能判断为反硝化脱氮, 还需与水体中总氮的去除效果进行比较.如图 3, 在C/N为8和12时, N3在8 h即可实现总氮的完全去除; 当C/N=4时, 14 h亦可实现90%的总氮去除率.这与水体中硝酸盐的去除效果基本一致, 表明N3主要通过反硝化作用完成整个脱氮过程.
图 3

在微生物反硝化过程中, 碳源不仅为菌体生长提供能量, 也是硝酸盐还原的主要电子来源.目前我国污水处理厂尾水中C/N普遍较低, 在对尾水进行进一步处理时, 碳源供应不足严重抑制了反硝化细菌的生长, 导致硝酸盐去除率不高. Taylor的研究发现Providencia rettgeri YL在C/N=10时去除性能最佳, Chen等也得出了相似的结论.而本研究得到的菌株N3在C/N=8时去除效果最佳, 在8 h内即可完全去除硝酸盐, 平均去除速率为1.87 mg·(L·h)-1.当C/N进一步增加到12时, 去除率并没有太大变化, 甚至出现轻微下降, 这与Joo等的研究结果相一致, 可能是因为此时菌体生长所需的能量充足, 碳源成为非限制性因素(图 3).即使在C/N=4时, N3在14 h内仍可达到90%的去除率, 能够满足低C/N水体中硝酸盐去除的需要.在2~8 h存在亚硝酸盐积累的峰值, 但其积累量低于0.1 mg·L-1, 并迅速降低.这可能是因为反硝化过程中氧化还原电位高的硝酸盐对电子的竞争能力大于亚硝酸盐, 从而导致少量亚硝酸盐的积累, 与李卫芬等的研究结果相一致.
当以亚硝酸盐为唯一氮源时, 总氮与亚硝酸盐的去除基本一致, 表明N3可以利用亚硝酸盐为底物进行反硝化.如图 4所示, N3在C/N为8和12时均能在6 h内将硝酸盐完全去除.在C/N=4时, N3反硝化速率相对较慢, 但8 h后脱氮率仍能达到95.54%.总之, N3可利用硝酸盐和亚硝酸盐为底物进行代谢, 这与牟东阳等[22]的实验结果一致.上述结果表明, N3能在短时间内实现良好的反硝化效果, 对低C/N水体中硝酸盐的去除具有重要意义.
图 4

2.2.2 不同硝酸盐浓度对反硝化作用的影响
作为反硝化作用的底物, 硝酸盐对反硝化过程产生重要影响. Mulholland等的研究表明, 随着硝酸盐浓度增加, 反硝化脱氮量也随之增加, 但是氮去除速率却呈现下降趋势.在水体修复过程中, 经常出现水体受外界冲击, 硝酸盐负荷过高的情况, 因此有必要研究硝酸盐浓度对N3反硝化过程的影响.
如图 5所示, 在硝酸盐浓度低于70 mg·L-1时, N3能够在48 h内将硝酸盐完全去除.随着硝酸盐浓度继续增加, 去除率略有下降.可能是由于高渗透压对微生物的活性产生抑制作用.另外, 消耗的碳源也随着硝酸盐浓度的增加而增加, 最终因电子供应不足导致硝酸盐不能被完全还原, 去除效果下降.在硝酸盐浓度为100 mg·L-1时, N3仍然能够实现80%的脱氮率, 脱氮效果良好.总体看来, 硝酸盐浓度低于100 mg·L-1时, N3受硝酸盐浓度影响不大, 能够满足水体中硝酸盐去除的需要.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
图 5

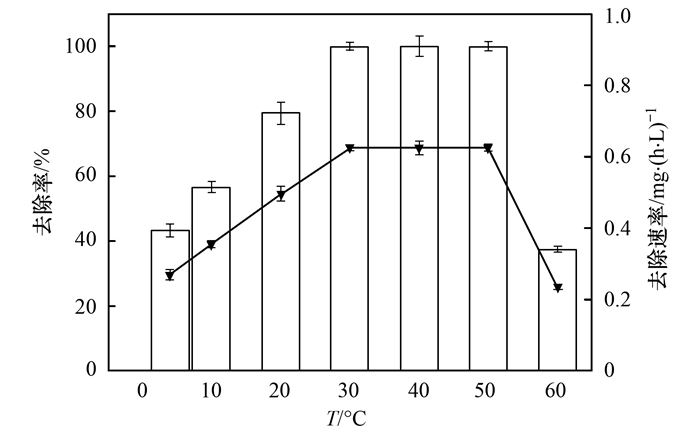
2.2.3 不同温度对反硝化作用的影响
长期以来, 温度一直被认为是影响反硝化作用的重要因素.在适宜的温度范围内, 温度越高, 微生物生长越快, 酶活性也越高.一般来说, 温度低于20℃时, 对微生物表现出明显的抑制作用.在10℃时Pseudomonas stutzeri YZN-001和Bacillus sp. strain YX-6几乎不生长, 而N3在4℃时仍然具有40%以上的去除率(图 6).且在50℃高温时, 仍然能够去除80%以上的硝酸盐.当温度继续升高到60℃时, 去除率只有30%, 可能是因为高温破坏酶的结构, 抑制细胞正常的代谢活动, 导致去除率下降.在4~30℃范围内, N3的硝酸盐去除速率由0.27 mg·(L·h)-1上升到0.63 mg·(L·h)-1.当温度继续升高, 速率保持不变, 直至60℃时, 反应速率下降到0.23 mg·(L·h)-1, 这与其去除率的变化保持一致.李卫芬等筛选得到的反硝化细菌F1在温度低于25℃或高于35℃时菌株的生长即受到抑制.相比之下, N3在4~50℃范围内均能实现40%以上的去除率, 具有更宽广的温度适应范围.尤其重要的是, N3对低温的适应性为冬季水体中硝酸盐的去除提供了一个潜在解决方案.
图 6
2.3 N3对低温的适应性2.3.1 低温下N3的硝酸盐去除效果及反硝化功能基因的表达检测
低温对酶的活性有强烈的抑制作用, 进而影响微生物的生长和代谢, 导致反硝化细菌冬季脱氮效果不理想[2].如图 7所示, 在刚开始的20 h, N3对低温有一个适应期, 硝酸盐去除表现出延滞作用.随后去除率迅速增加, 最终在36 h内实现对硝酸盐的完全去除.冬季人工湿地水力停留时间一般在2~10 d, 良好的低温适应性使得N3成为冬季人工湿地中反硝化脱氮的候选菌株, 具有良好的应用前景.
图 7

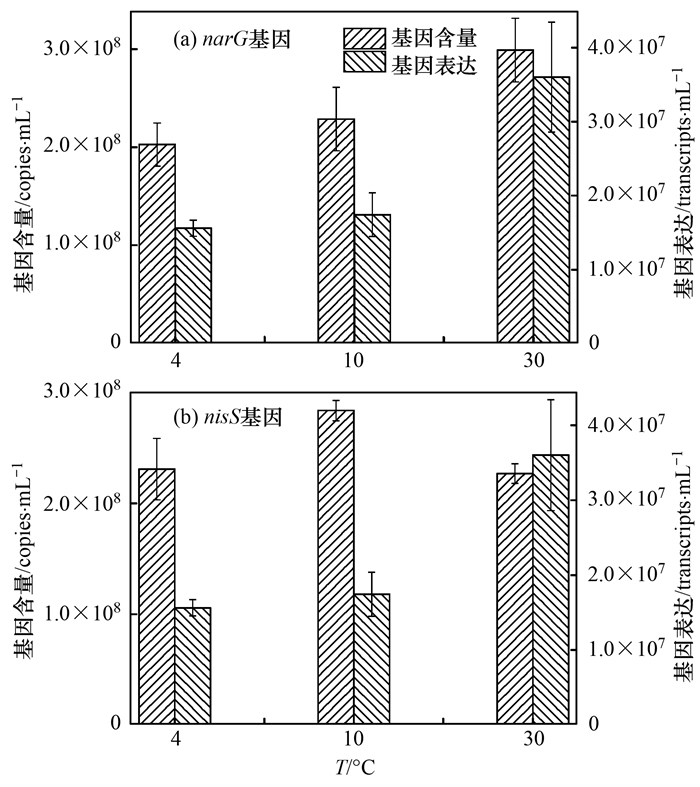
采用定量PCR技术对反硝化基因narG、nirS在4、10与30℃条件下的表达进行检测, 结果如图 8所示.在各温度下, narG的基因丰度在2.03×108~2.99×108 copies·mL-1之间, nirS的基因含量在2.27×108~2.83×108 copies·mL-1之间, 各温度之间相差不大.而对于基因表达来说, 4℃和10℃下, narG的表达量在1.74×107~1.95×107 transcripts·mL-1菌液之间, nirS的表达量在1.56×107~1.74×107 transcripts·mL-1菌液之间, 为30℃下表达量的1/3~1/2.低温通过抑制反硝化基因的表达影响菌的生长和酶的活性, 进而导致反硝化速率的下降, 但是反硝化能力的高低还可能与mRNA的寿命及蛋白质的活性等有关, 需要进一步地研究进行验证.
图 8
2.3.2 低温下固定化反硝化菌的运行稳定性实验
在实验室条件下, N3具有良好的低温反硝化效果.但是游离菌对不良环境抵抗力差, 容易流失, 在水体修复过程中具有一定的局限性.固定化技术能有效提高微生物对不良条件的抗性, 防止菌种流失.本研究采用PVA和SA对N3进行固定化, 进行低温半连续实验.
如图 9所示, 在运行的前4个周期内, 单个周期内反硝化细菌12 h的脱氮率即达到50%, 24 h去除率大于90%.调整C/N=4后, 初期受低浓度碳源的限制, 硝酸盐去除效果较之前有所下降, 但仍能实现90%的去除率.运行15 d后, 硝酸盐的去除达到稳定, 去除率始终保持在95%以上, 具有良好的稳定性.另外, 经固定化N3处理后的水体始终清澈, 没有因反硝化产气而破裂, 也观察不到菌体外泄现象, N3始终保持较好的活性.在连续运行的54 d内固定化N3保持良好的机械强度及去除稳定性, 能够满足水体处理的需要.
图 9

3 结论
(1) 从富营养化水体中分离得到1株低温反硝化细菌N3, 革兰氏阴性菌.菌株鉴定结果表明, N3为施氏假单胞菌.
(2) 菌株N3在C/N=8, 硝酸盐浓度低于70 mg·L-1时, 能实现硝酸盐的完全去除. N3具有良好的低温适应性, 4℃时可在36 h内实现对15 mg·L-1硝酸盐的完全去除; 反硝化基因narG、nirS的表达与30℃处于同一个数量级.在10℃下的低温半连续实验中, 固定化N3在运行的54 d中无菌体外泄情况且去除效果稳定, 可作为低温低C/N下的反硝化候选菌株, 对于冬季水体中硝酸盐的去除具有良好的应用潜力.(来源:环境科学学报 作者:路俊玲)




