生态环境部发布的2018年1~12月全国地表水环境质量通报中指出氨氮是全国地表水及主要江河水系污染指标之一.水体中的氨氮含量过高会引起水体富养化, 导致水质恶化、鱼虾等水生生物难以生存, 水生态系统遭到破坏.同时氨氮可被硝化细菌氧化成亚硝酸盐和硝酸盐, 人类饮用后可诱发血红蛋白血症和增加致癌风险.因此, 去除水中的氨氮、减少其危害是一项意义重大的课题.
常见的氨氮废水处理工艺有吸附法、折点氯化法、化学沉淀法、吹脱法及催化氧化法等.其中, 吸附法具有高效、工艺简单、成本低等优点, 被广泛应用于氨氮废水的治理中.吸附氨氮的材料既包括活性炭、生物炭、天然沸石和膨润土等天然材料, 也包括分子筛、纳米材料等人工材料.天然材料成本低、易获取, 但吸附效果较差.人工材料成本高、工艺复杂, 但吸附效果较好.
钛酸盐纳米材料具有独特的物理化学特性, 在储氢、电池和气体传感器等领域有广泛应用.其中钛酸盐纳米管具有比表面积大、孔隙度高、表面活性位点多及等电点较低等优点, 从而表现出卓越的离子交换性能、良好的沉降性能、较快的吸附速率及易于解吸再生等特点.钛酸盐纳米管在水体中重金属和染料的去除方面有较多研究, 但其对氨氮的吸附研究报道较少.本文利用水热法制备钛酸盐纳米管, 研究钛酸盐纳米管对水中氨氮的吸附特性及影响因素, 并通过再生-循环实验及红外表征探讨钛酸盐纳米管对氨氮的吸附机制, 以期为去除水中氨氮的应用打下理论基础.
1 材料与方法
1.1 试剂与仪器
本实验主要试剂有盐酸、酒石酸钾钠、氯化铵、碘化钾、二氯化汞、氢氧化钠(国药集团化学试剂有限公司); 氢氧化钾(上海凌峰化学试剂有限公司); P25(Degussa, 德国).以上试剂均为分析纯, 实验用水为自制超纯水.
主要仪器设备有PB-10型pH计(赛多利斯科学仪器有限公司); LG16-B型离心机(北京雷勃尔医疗器械有限公司); SHZ-88A型恒温水浴振荡器(太仓市仪器设备厂); D/max-rc X射线粉末衍射仪(XRD, 日本理学公司); H-7650型透射电子显微镜(TEM, 日本Hitachi公司); Cary 5000分光光度计(FT-IR, 美国Varian公司); Nano-ZS90型电位仪(英国Malvern Instruments公司); TU-1901型双光束紫外可见分光光度计(北京普析通用仪器公司)等.
1.2 TNTs的制备
将0.8 g的P25粉末加到80 mL NaOH溶液中, 超声30 min后, 磁力搅拌30 min, 然后将混合均匀的乳白色溶液放入100 mL含聚四氟乙烯内衬的不锈钢反应釜中(填充度80%), 置于150℃的鼓风干燥箱中反应24 h.反应结束冷却到室温后, 将生成的白色固体用去离子水洗涤至上清液呈中性后抽滤; 滤饼置于烘箱中80℃烘12 h, 研磨后收集备用.氢氧化钠浓度为6、8、10、12和14 mol·L-1制备的钛酸盐样品分别记为TNTs-6M、TNTs-8M、TNTs-10M、TNTs-12M和TNTs-14M.
1.3 TNTs的表征
所制备的样品及吸附氨氮后的样品经玛瑙研钵磨细后, 用XRD分析样品的物相组成, 辐射源为CuKα, 管电流40 mA, 管电压45 kV, 时间常数为tc=2, 扫描范围为5°~85°.样品的形貌用TEM观察.样品的红外光谱图由FT-IR测定, 采用KBr压片法, 测试范围为4 000~400 cm-1.不同pH值下样品表面的Zeta电位由电位仪测量.
1.4 静态吸附实验
本实验考察了溶液初始pH、吸附剂投加量、氨氮质量浓度、吸附时间、反应温度和共存阴阳离子对氨氮吸附的影响, 并进行吸附剂的再生-循环实验, 探讨材料对氨氮的吸附机制.具体实验如下:准确称取一定质量的TNTs, 放入一系列150 mL锥形瓶中, 分别加入50 mL一定浓度的氨氮溶液, 置于140 r·min-1的恒温摇床内6 h后取出, 上清液经0.45 μm水系滤膜过滤, 采用纳氏试剂分光光度法[24]测定滤液中氨氮浓度.所有实验进行3次平行重复, 取平均数据进行分析.氨氮的平衡吸附量(qe)及吸附效率(η)计算方法如下:
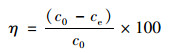
式中, qe为TNTs对氨氮的平衡吸附量(mg·g-1); η为吸附效率(%); V为氨氮溶液的体积(L); m为TNTs的投加量(g); c0和ce分别为氨氮溶液的初始浓度和平衡浓度(mg·L-1).
影响因素实验:①溶液pH范围为1~9; ②吸附剂投加量为2~12 g·L-1; ③氨氮溶液质量浓度为10~110 mg·L-1; ④吸附时间为1~360 min; ⑤反应温度为25、35和45℃; ⑥共存阴离子分别为Cl-、SO42-和H2PO4- (分别用氯化铵、硫酸铵和磷酸二氢铵配制氨氮溶液, 氨氮质量浓度为10、30、50、70、90和110 mg·L-1); ⑦共存阳离子分别为Na+、K+和Ca2+ (氨氮质量浓度为50 mg·L-1, 分别用氯化钠、氯化钾和氯化钙提供阳离子, 质量浓度分别为0、50、100、150和250 mg·L-1); ⑧ TNTs的再生-循环实验:0.2 g饱和吸附氨氮的TNTs加入到50 mL 1 mol·L-1的NaCl溶液中, 置于140 r·min-1的恒温摇床内振荡2 h, 固体残留物经水洗后于100℃下干燥6 h, 研磨后继续吸附氨氮.
2 结果与讨论
2.1 TNTs的表征
2.1.1 XRD分析
不同碱浓度下所制备的钛酸盐纳米管的XRD谱图如图 1所示.一般认为, 原料P25在浓碱环境下首先溶解-重结晶形成层状钛酸钠产物, 片层长大后卷曲成纳米管.从图 1中可见, 2θ在10°、24°、28°和48°处均有衍射峰, 表明所制备材料是钛酸盐, 其化学组成为(Na, H)2Ti3O7·nH2O[26]. 2θ在10°处的峰归因于钛酸盐的层间结构, 随着碱浓度的增大, 层间距d由0.966 8 nm减小至0.873 4 nm, 说明碱浓度越高纳米片卷曲成纳米管的驱动力越大. 2θ在24°、28°和48°处的峰为TNTs中Na+的衍射峰.从图 1中可见, Na+的衍射峰随着碱浓度增大而变强, 但当碱浓度达到12 mol·L-1时, 衍射峰强度下降; 增至14 mol·L-1时, 钛酸盐的特征衍射峰消失, 可能形成棒状材料, 说明碱浓度过高破坏了钛酸盐纳米管的结构.
图 1
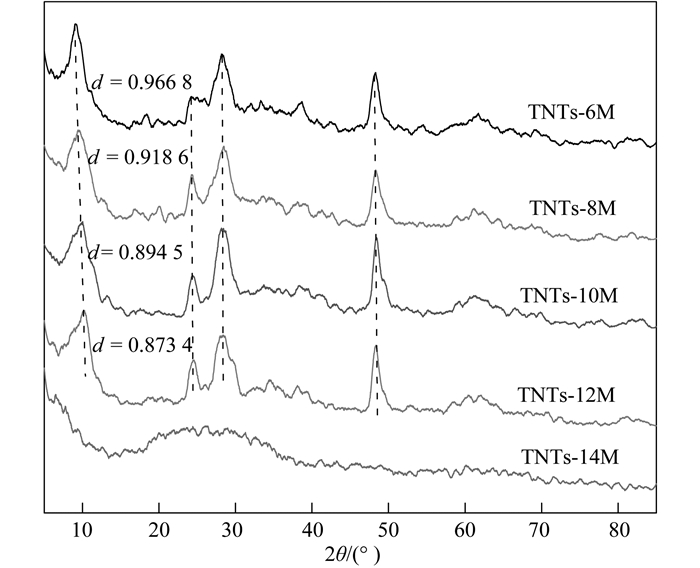
2.1.2 TEM分析
图 2为不同碱浓度下所得钛酸盐样品的TEM图谱.从中可知, 碱浓度影响钛酸盐的形貌.碱浓度在6~10 mol·L-1内, 样品由纳米片逐渐形成纳米管.碱浓度在10 mol·L-1时的TNTs-10M样品为形貌规整的纳米管[见图 2(c)], 管长为120 nm左右, 管径为8 nm左右.碱浓度继续增大, 导致钛酸盐层变厚, 难以卷曲成管状.碱浓度为12 mol·L-1时, TNTs-12M样品为宽度40~120 nm, 长度0.57~2.83 μm的纳米带.碱浓度为14 mol·L-1时, TNTs-14M样品为杂乱无序堆积的纳米棒, 这与XRD结果一致.从图 2(f)中可看出, TNTs-10M中只含有C、O、Ti和Na元素, 其中C杂质主要来源于测试过程中的C污染.将元素质量分数换算成元素含量比为C:6.62%、Na:8.35%、Ti:14.54%和O:70.50%, 其中Na:Ti:O=2:3.48:16.89, 基本符合钛酸盐的化学组成.
图 2

2.2 TNTs对氨氮的吸附实验
为考察不同碱浓度下所制备材料的吸附性能, 按照1.4节的方法, 将其应用于水中氨氮的去除, 吸附结果如图 3所示.
图 3

从图 3可以看出, 与带状的TNTs-12M和棒状的TNTs-14M相比, 管状的TNTs-10M对氨氮具有更好的吸附效果.其中, TNTs-10M的吸附效率和平衡吸附量最大, 分别为85.40%和10.67 mg·g-1.这可能与纳米管含有更多的吸附位点有关.为了进一步分析钛酸盐纳米管对氨氮的吸附行为, 以下以TNTs-10M为代表展开研究.
2.2.1 初始pH对氨氮吸附的影响
溶液初始pH影响着水中氨氮的存在形式及材料表面带电类型, 从而对氨氮的吸附产生重要的影响, 图 4(a)是溶液初始pH对氨氮吸附影响的实验结果.
图 4
图 4 pH对氨氮吸附的影响、不同pH下TNTs-10M表面的Zeta电位及25℃下氨氮溶液中离子分布情况如图 4(a)所示, 钛酸盐纳米管对水中氨氮的吸附量随pH升高先增加后减少.吸附氨氮的最佳pH为3~8, 此范围内的氨氮吸附量均高于10.00 mg·g-1.当溶液初始pH低于3或高于8时, 氨氮吸附量均呈现骤降趋势.由图 4(a)可知, TNTs-10M的等电点约为2.5.当pH低于2.5时, TNTs-10M表面带有正电荷, 与NH4+发生排斥, 阻碍了钛酸盐纳米管对氨氮的吸附.该条件下, 钛酸盐纳米管对氨氮仍有吸附, 这与纳米管含有大量吸附位点有关, 此时钛酸盐纳米管对氨氮的吸附以物理吸附为主; 当pH高于8时, 溶液中NH4+急剧减少, 分子态的NH3增多[见图 4(b)], 不利于对氨氮的吸附. pH在3~8范围内, 氨氮的主要存在形式是NH4+, 而钛酸盐纳米管表面带负电, 纳米管与NH4+间存在静电作用, 故该条件下对氨氮有较好地吸附效果.因此, 选取氨氮溶液的初始pH(5.25)作为其他实验中氨氮的初始pH值.
2.2.2 投加量对氨氮吸附的影响
投加量在2~12 g·L-1范围内, TNTs-10M对50 mg·L-1氨氮的吸附效果如图 5所示.
图 5
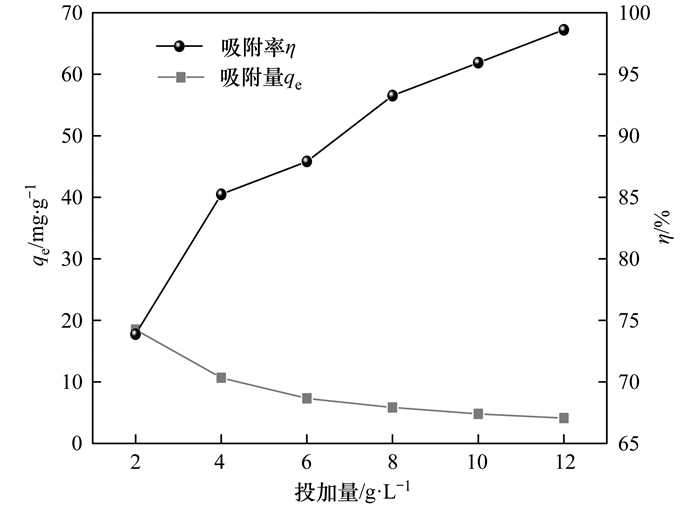
从图 5中可知, 随着TNTs-10M投加量从2 g·L-1增大至12 g·L-1, 平衡吸附量qe从18.47 mg·g-1降至4.11 mg·g-1, 而吸附率η则从73.87%增至98.60%.吸附剂的投加量影响溶液中吸附位点的数量.随着TNTs-10M投加量的增加, 导致吸附剂位点利用率下降, 致使qe呈减小趋势, 但氨氮去除效率增加. TNTs-10M投加量为4 g·L-1时, 吸附量趋于稳定, 同时吸附率的变化率降低, 结合成本等因素, 选择材料的投加量为4 g·L-1.
2.2.3 吸附等温线
吸附等温线体现了吸附材料吸附能力的强弱, 反映吸附剂表面和溶液中吸附质数量之间的关系.按照1.4节的方法, 所得等温线吸附实验数据, 分别采用Langmuir、Freundlich、Langmuir-Freundlich和Temkin等温吸附模型来拟合, 拟合曲线如图 6所示, 模型参数见表 1.
图 6
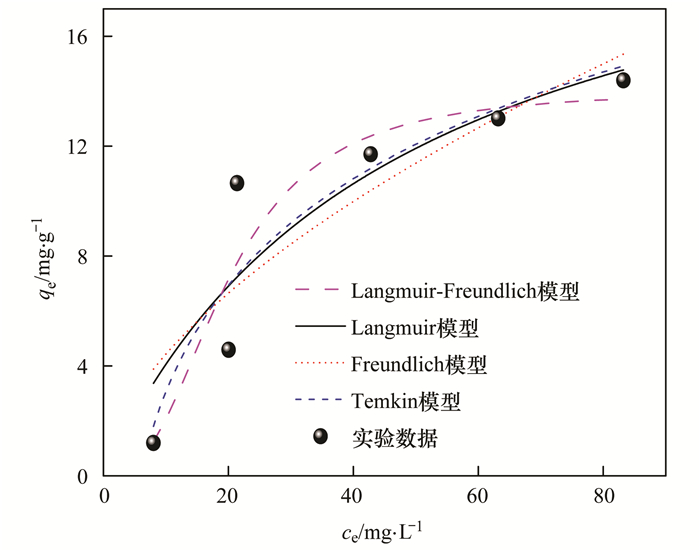
表 1 TNTs-10M吸附氨氮的等温方程参数
Langmuir吸附等温式:
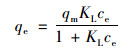
Freundlich吸附等温式:
Langmuir-Freundlich吸附等温式:

Temkin吸附等温式:
平衡参数:
式中, ce为氨氮吸附达到平衡时的浓度(mg·L-1); qe为吸附平衡时对氨氮的吸附量(mg·g-1); qm为理论最大吸附量(mg·g-1); KL(L·mg-1)和KF(mg·g-1)分别为Langmuir和Freundlich模型的吸附速率常数; A和B为Temkin等温常数.
从图 6中可以看出, 随着氨氮质量浓度的增大, TNTs-10M对氨氮的吸附量快速增加.由表 1拟合参数可知, 氨氮在TNTs-10M上的吸附过程更加符合Temkin等温模型, 即吸附质之间或吸附质与吸附剂表面之间的斥力变化造成吸附热发生线性变化. Langmuir拟合得到的平衡参数均在0~1之间, 表明TNTs-10M对氨氮的吸附为有利吸附.根据Langmuir方程计算得到氨氮的最大吸附量为23.10 mg·g-1, 高于以前研究报道的大部分吸附材料(见表 2), 大吸附容量使得钛酸盐纳管应用于氨氮废水的治理成为可能.
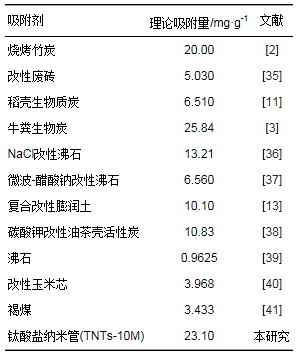
表 2 常见吸附剂对水中氨氮的理论吸附容量比较
2.2.4 吸附动力学
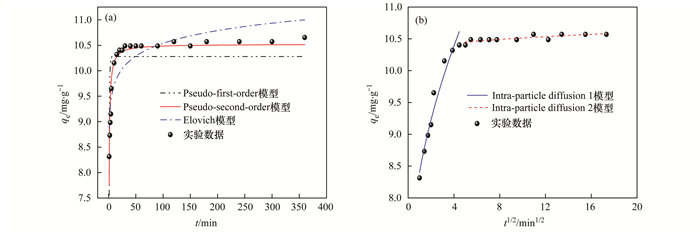
吸附动力学是评价吸附速率的重要指标.按照1.4节的方法, 所得吸附动力学实验数据, 分别采用准一级动力学模型、准二级动力学模型、Elovich模型和Weber-Morris颗粒内扩散模型进行拟合, 拟合曲线如图 7所示, 拟合参数见表 3和表 4.
图 7
表 3 TNTs-10M吸附氨氮的动力学参数

表 4 TNTs-10M吸附氨氮的颗粒内扩散动力学参数
Pseudo-first-order方程:
Pseudo-second-order方程:
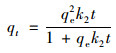
Elovich模型:
Weber-Morris颗粒内扩散模型:
式中, qt为t时的吸附量(mg·g-1); qe为吸附平衡时的吸附量(mg·g-1); k1(min-1)、k2[g·(mg·min)-1]、Kd[mg·(g·min1/2)-1]、A、B和Ci分别为上述动力学方程的常数.
从图 7(a)中可知, 在0~25 min内吸附量随着时间t的增大急剧上升; 在25~350 min内趋于平缓, 吸附平衡时间为1 h, TNTs-10M对氨氮表现出快速吸附的特点.由表 3可知, 准二级动力学模型对动力学实验数据的拟合相关性系数最高, 且准二级动力学模型计算的平衡吸附量与实验确定的吸附量比较接近.所以, 准二级动力学模型能更好地描述TNTs-10M对水中氨氮的吸附过程, 该吸附属于化学吸附.
吸附剂对吸附质的吸附速率控制步骤也是评价吸附剂的指标之一, 而速率控制步骤与吸附质向吸附剂表面或孔道内部扩散过程有关.为了确定实验中TNTs-10M对氨氮吸附的实际控速步骤, 用Weber-Morris颗粒内扩散模型对实验数据进行拟合, 结果列于表 4中.由图 7(b)和表 4可知, 钛酸盐纳米管吸附水中的氨氮动力学过程可分为2个阶.第1阶段为氨氮扩散到TNTs-10M的表面, 且扩散过程很快(较大); 第2阶段直线趋于水平, 且较小, 表明TNTs-10M吸附氨氮由第2阶段控制.一般认为, 直线通过坐标原点是判断颗粒内扩散是唯一速率控制步骤的依据.常数和都不为0, 且直线不经过原点, 说明TNTs-10M对氨氮的吸附过程由表面吸附和颗粒内扩散共同控制.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2.2.5 吸附热力学
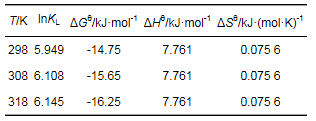
根据范特霍夫方程研究热力学函数间的关系, 有助于寻找吸附规律.本文考察了3个温度下的吸附等温线, 并根据相关公式计算吉布斯自由能(ΔGθ)、熵变(ΔSθ)和焓变(ΔHθ).
式中, R是理想气体常数[8.314 J·(mol·K)-1]; T是绝对温度(K); KL是Langmuir等温方程常数(L·mol-1).
从图 8(a)可知, 吸附量qe随着实验温度的升高而增大, 说明升高温度有利于对氨氮的吸附.利用lnKL对1/T作图, 所得直线斜率和截距计算ΔHθ和ΔSθ, 根据公式(12)计算ΔGθ, 结果见图 8(b)和表 5.由表 5可看出, ΔHθ为正值, 说明钛酸盐纳米管对氨氮的吸附过程为吸热反应. ΔGθ均为负值, 且随着温度的升高而降低, 说明TNTs-10M对氨氮的吸附是自发过程. ΔSθ为正值, 说明吸附过程中固-液界面处的自由度增加.
图 8
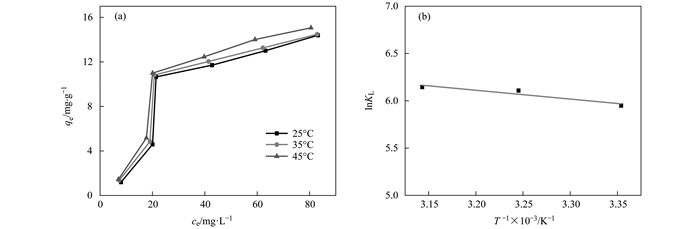
表 5 TNTs-10M吸附氨氮的热力学参数
2.2.6 共存阴阳离子对氨氮吸附的影响
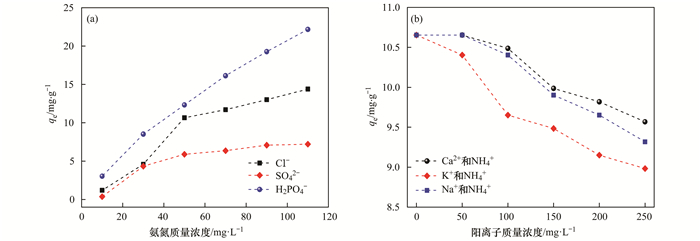
水中共存阴阳离子会在吸附过程与钛酸盐纳米管或NH4+产生竞争吸附, 因此有必要考察共存阴阳离子对氨氮吸附的影响.分别考察了3种共存阴、阳离子对氨氮吸附的影响, 结果如图 9所示.
图 9
图 9 共存阴阳离子对氨氮吸附的影响由图 9(a)可知, 所选3种阴离子对TNTs-10M吸附氨氮的影响顺序为SO42->Cl->H2PO4-, 水体中的SO42-更易与NH4+形成吸附竞争关系, 争夺钛酸盐纳米管表面或内部的吸附位点, 这与张家利的研究结果一致.可能的原因是SO42-带有两个负电荷, 能与更多的Na+结合.从图 9(b)中看出, 3种阳离子随着其质量浓度的增大, 对TNTs-10M吸附氨氮的影响增强.共存阳离子质量浓度为250 mg·L-1(为溶液中氨氮的5倍)时, 减少的吸附量均不超过16%, 表明TNTs-10M对NH4+拥有较好的吸附选择性, 抗干扰能力强.同等浓度情况下, 共存阳离子对TNTs-10M吸附氨氮的影响顺序为K+>Na+>Ca2+, 这与共存阳离子的水合半径大小相关, 其中K+水合离子半径与NH4+水合离子半径更相近, 故产生的竞争更为激烈.
2.2.7 再生-循环吸附研究
吸附剂的再生及循环使用是判断其是否高效的因素之一.本文采用1 mol·L-1 NaCl对吸附饱和的TNTs-10M补充钠离子, 5次连续循环使用结果如图 10所示.
图 10
图 10 TNTs-10M再生-循环使用效果及吸附氨氮前后XRD谱图从图 10(a)中可以看出, 吸附饱和后再生的TNs-10M对水中氨氮的吸附容量有所下降.经过5次循环使用, TNTs-10M对氨氮的吸附量均在9.46 mg·g-1以上, 再生效果为原样的88.64%, 表明该吸附剂具有良好的循环使用性能.由图 10(b)可知, TNTs-10M经再生-循环使用5次后的XRD衍射峰, 除了Na+特征峰强度略有下降, 其他衍射峰与初始样品几乎一致, 表明钛酸盐纳米管具有优良的稳定性.
2.3 吸附机制研究
为了探讨钛酸盐纳米管对水中氨氮的吸附机制, 本文研究了氨氮吸附前后材料表面官能团的变化情况, 如图 11所示.
图 11
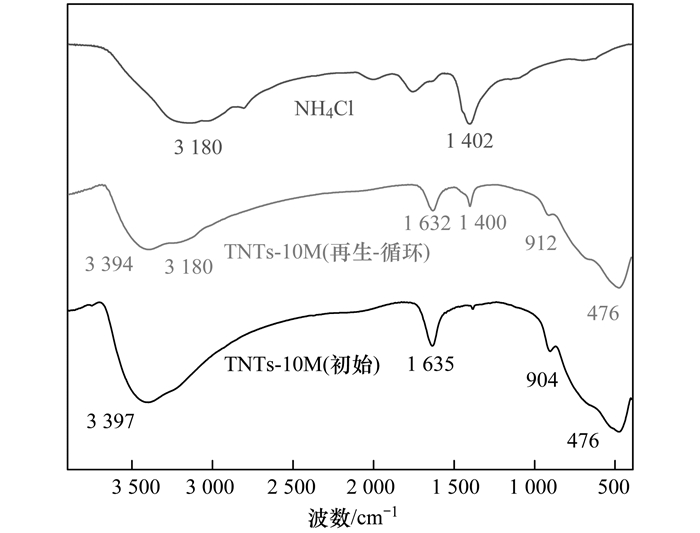
从图 11可知, 纯TNTs-10M的主要红外吸收峰在3 397、1 635、904和476 cm-1处, 其中3 397 cm-1和1 635 cm-1处的吸收峰归因于O—H键的伸缩振动和H—O—H键的弯曲振动, 而904 cm-1和476 cm-1处的吸收峰与Ti—O键的伸缩振动和[TiO6]八面体的振动相关. TNTs-10M吸附氨氮后, 904 cm-1处的吸收峰峰强度减弱且偏移至912 cm-1, 这与钛酸盐纳米管中Na+含量减少有关. Na+的含量影响着Ti—O健的长度和对称性. 1 400 cm-1出现明显的吸收峰, 与纯氯化铵中1 402 cm-1处的特征峰一致, 表明NH4+被吸附到TNTs-10M上. 3 250 cm-1处出现宽而钝的吸收峰, 这由N—H的伸缩振动引起.综上, 在适宜的pH下, 溶液中带正电荷的NH4+因静电作用被吸引到表面带负电荷的TNTs-10M上, 然后与层间的Na+发生离子交换, 其吸附机制如图 12所示.
图 12
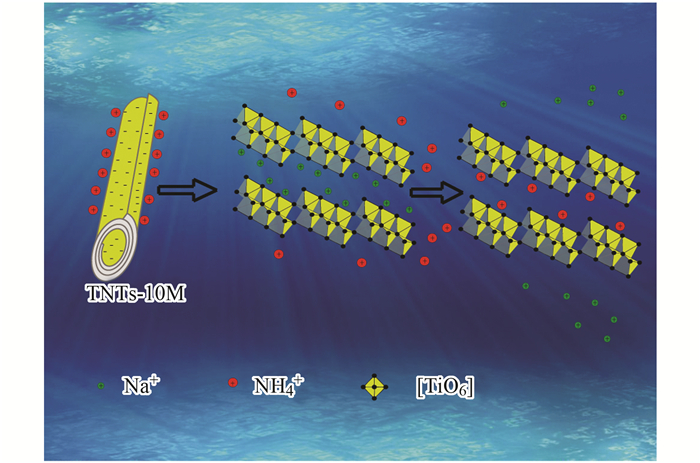
3 结论
(1) 钛酸盐纳米管可以有效吸附水中的氨氮.溶液的初始pH值、投加量、氨氮初始浓度、共存阴阳离子、吸附时间均影响氨氮的吸附.氨氮的初始浓度为50 mg·L-1、溶液的初始pH在3~8之间, TNTs投加量为4 g·L-1, 吸附1 h时, 氨氮的平衡吸附量10.68 mg·g-1.溶液中常见的阴阳离子在一定程度上会抑制对氨氮的吸附, 阴阳离子的抑制作用大小分别为K+>Na+>Ca2+、SO42->Cl->H2PO4-.
(2) Temkin等温吸附模型能较好地拟合等温吸附数据; 准二级动力学模型能很好地拟合吸附动力学数据, 说明TNTs-10M对氨氮的吸附属于化学吸附; Weber-Morris颗粒内扩散模型拟合图形由两部分组成, 说明TNTs-10M对氨氮的吸附由颗粒内扩散和表面吸附速率共同控制; 吸附热力学研究表明, TNTs-10M对氨氮的吸附是自发进行的吸热过程.
(3) 用NaCl对氨氮吸附饱和的TNTs-10M进行再生-循环使用, 具有良好的重复使用性能; TNTs-10M对氨氮的吸附机制主要为钛酸盐层间的Na+与溶液里的NH4+进行离子交换.(来源:环境科学 作者:张政)