1 引言(Introduction)
电镀技术具有便捷、快速且高效的特点, 目前已参与到多种重工业的加工中(李道金等, 2016).但电镀过程中会排出大量有机或无机废水, 其中包括难降解的含镍、铬、铜、镉、锌等有机金属化合物, 导致电镀工业成为全球三大污染工业之一(Ishikawa et al., 2002; 马小隆等, 2005; 王天行等, 2017).化学镀镍废水主要来源于电镀过程中的化学镀环节, 另外也包含相关漂洗槽废液、设备冷却水及地面冲洗水等(戴文灿等, 2009).
化学镀镍废水由于化学镀药剂特殊的耦合作用, 使得有机物与重金属离子之间耦合成分子量大、稳定性极强的重金属Ni络合物, 导致难以被一般氧化剂氧化.此外, 化学镀镍废水中还含有大量的络合剂、稳定剂、光亮剂等, 成分复杂, 水质生化需氧量低, 可生化性差, 不易被常规物化和生物的方法去除, 因此, 化学镀镍废水处理达标排放成为电镀废水中典型的难点问题(陈文溪等, 2017).近年来, 国家和地方环保部门对电镀废水污染物的排放要求愈加严格, 其中, 广东省《电镀水污染物排放标准》(DB44/1597—2015)就规定总Ni的排放标准为0.1 mg · L-1.
针对常规物化处理后化学镀镍废水中低浓度、高稳态的络合Ni污染物, 往往需要增加深度处理工艺.现有深度处理技术主要包括离子交换树脂法(符丽纯等, 2018)、膜分离反渗透法(程仁振等, 2018)、生物法(杨先伟等, 2017), 以及电化学氧化(宋萌等, 2018; 袁浩等, 2018)、类芬顿氧化(刘洋等, 2015)、紫外催化氧化(刘鹏等, 2014; 夏俊方等, 2018)等高级氧化技术(AOPs).但在已有的深度处理技术研究中, 单独针对去除重金属的研究很少, 如电化学氧化技术多应用于焦化废水、垃圾渗滤液的处理, 以降解去除其中的高浓度COD、氨氮、总磷、焦油、苯、酚类化合物等污染物质.目前研究较多的类芬顿氧化技术在实际应用中不仅需要多次调节pH值, 而且会产生大量的污泥, 需额外处理, 从而增加了成本.另外, 通过调研多家电镀废水处理厂所采用的深度处理工艺(如电化学、离子交换、膜分离技术等), 发现这些工艺往往因运行成本高、现场操作维护复杂、出水不稳定且难达标等原因而形同虚设.同时, 废水中重金属污染物能否有效去除, 是后续生化工艺能否正常运行的前提之一.因此, 急需寻找一种稳定、高效的方法对废水中低浓度、高稳态的络合Ni污染物进行深度去除.
由于臭氧具有强氧化能力、高效节能、不产生二次污染的优点, 被广泛用于工业污水深度处理、养殖废水杀菌消毒和饮用水消毒等领域(曾泳钦等, 2017; 黄磊等, 2018).近年来, 针对难处理工业废水的深度处理, 以臭氧为核心而引申出的其他新型联合高级氧化技术逐渐成为研究热点.螯合沉淀是一种高效、快速的化学沉淀方法.重金属高效捕集药剂不仅能与离子态金属进行螯合反应, 还能直接与络合态金属通过竞争螯合反应生成不溶性的络合态重金属物质, 从而将其从水中去除.如令玉林等(2011)合成了一种新的长链型二硫代氨基甲酸盐类重金属螯合剂RDTC, 对模拟废水中游离Ni和络合Ni的去除率分别高达99%和98%以上.
前期, 本课题组已研发合成相关的DTC类捕集剂, 针对模拟废水中低浓度、高稳态络合金属污染物有高效的去除作用(Xiao et al., 2016; Yan et al., 2016; Qiu et al., 2017), 并将合成的捕集剂与臭氧氧化相耦合应用于化学镀镍废水的深度处理.初步实验研究结果表明, 针对废水中低浓度、高稳态的络合镍, 臭氧预氧化破络-重金属螯合捕集深度处理技术体系, 即O3-SN-9耦合体系, 可以稳定地将废水中的Ni降到0.1 mg · L-1以下.在此耦合体系中, 前者若能通过有效控制臭氧氧化破络进程, 将稳定的大分子络合态Ni污染物分解为易失稳的小分子络合态Ni, 后续投加SN-9捕集去除Ni, 两者有效耦合, 则能进一步确保出水效果稳定, 且节省处理成本.然而, 在此体系中, 有关废水中低浓度络合态镍被臭氧预氧化的破络控制条件和破络机制, 继而被SN-9分子上的螯合基团捕集的去除途径和机理均还未知.因此, 本文拟通过静态反应实验, 研究O3-SN-9耦合体系去除废水中络合态镍的控制性影响参数及去除效率, 并进一步通过TBA捕获· OH实验、LC-MS和FTIR等分析手段, 阐明臭氧预破络与重金属捕集的协同耦合作用机理.
2 材料与方法(Materials and methods)
2.1 实验试剂及材料
重金属捕集剂(SN-9)为含有—SH的化合物, 由实验室自行合成, 分子量约为437~509;聚合氯化铝(PAC)、聚丙烯酰胺(PAM)、叔丁醇(Tert-Butyl Alcohol TBA)均为分析纯, 购自天津市大茂化学试剂厂; 氢氧化钠(NaOH)、硫酸(H2SO4)、硝酸(HNO3)均为分析纯, 购自广州化学试剂厂; 乙腈(CH3CN)、甲酸(HCOOH)均为色谱纯, 购自阿拉丁公司; 实验使用水为超纯水(18 MΩ · cm-1).
实验所用的废水取自东莞某电镀工业园废水处理厂经常规物化处理后的化学镀镍废水, 其水质情况如表 1所示.
表 1 化学镀镍废水的水质情况
2.2 实验设备
20 g · h-1臭氧发生器(JH-8002y, 广州佳环电器科技有限公司); 臭氧氧化反应器(自制有机玻璃材质, DN=120 mm, h=1500 m, 有效容积20 L); 携带式臭氧浓度在线检测仪(深圳鑫海瑞科技开发有限公司); 加热型臭氧尾气分解仪(盐城朗润环保有限公司); 电子天平(JJ223BF, 常熟市双杰测试仪器厂); pH计(美国奥豪斯公司); 超纯水一体化系统(广州市深华生物技术有限公司); 六联定时电动搅拌器(JJ-4C, 苏州威尔实验用品有限公司); 超高效液相色谱串联三重四极杆质谱联用仪(LC-MS); 火焰原子吸收分光光度计(FAAS); Nicolet6700傅里叶变换红外光谱仪(FTIR).
2.3 实验方法
静态反应实验:臭氧氧化反应在自制的臭氧反应装置(图 1)中进行, 室温条件下, 调节反应体系的初始pH值, 分别抽入15 L化学镀镍废水于臭氧反应器内.打开臭氧发生器并调节臭氧流量, 臭氧通过曝气盘分散后进入反应体系中反应, 尾端逸出多余的臭氧经尾气分解仪加热分解后排放.距离反应器底部5 cm处开有取样口, 在设定的氧化时间内进行取样.将所取100 mL水样置于150 mL烧杯中, 加入定量的SN-9, 放置于六联定时电动搅拌器中快速(200 r · min-1)搅拌15 min; 接而加入40 mg · L-1混凝剂PAC(100 r · min-1, 5 min)、5 mg · L-1絮凝剂PAM(60 r · min-1, 3 min)辅助沉淀, 静置30 min固液分离后取上层清液.原始废水与处理后的样品均经过0.45 μm针孔滤膜过滤后, 用火焰原子吸收分光光度计测定溶液中残留的总Ni浓度.
图 1

图 1臭氧静态反应实验装置示意图
TBA捕获· OH实验:在上述实验所探究的最佳条件下, 调节反应体系初始pH值为9.0, 取15 L化学镀镍废水于臭氧反应器内.打开臭氧发生器并调节臭氧载气流量, 同时分别加入10 mL · L-1与50 mL · L-1 TBA进行静态氧化反应.在设定的氧化时间内取样, 样品经上述一致的重金属捕集、混凝絮凝反应和静沉后, 取上层清液经针孔滤膜过滤, 测定溶液中残留的总Ni浓度.
采用单因素实验法考察静态反应体系的初始pH值、臭氧载气流量、氧化时间、SN-9投加量对化学镀镍废水中总Ni去除率的影响.以上所有实验和测试每组至少设置3次平行实验, 以尽可能减小实验误差, 结果取平均值.
2.4 分析方法
pH采用酸度计(美国奥豪斯公司)测定; 总Ni浓度采用火焰原子吸收分光光度计测定(FAAS, 日立Z2000型, 检出限0.01 mg · L-1); 液相色谱-质谱(LC-MS, Thermo Fisher, Q Exactive)检测条件:ST PAK C18色谱柱, 流动相为0.1%甲酸-乙腈(3 : 7, V/V), 流速1.0 mL · min-1, 分析柱温度25 ℃, 进样量10 mL.傅里叶变换红外光谱分析(FTIR, Nicolet6700, 美国THERMO Fisher Scientific):KBr压片法, 在波长4000~400 cm-1范围内测定透光率.
3 结果与讨论(Results and discussion)
3.1 O3-SN-9耦合体系废水总Ni的去除率
3.1.1 臭氧氧化初始pH值对总Ni去除率的影响
臭氧氧化机理分为直接氧化和间接氧化两种.其中, 直接氧化反应多发生在酸性条件下, 氧化方式为亲电取代反应与偶极加成反应(陈行行等, 2017).由于臭氧分子在酸性条件下相对稳定, 一般直接氧化有机物.但受限于臭氧分子的溶解度, 导致其与废水中有机物接触不充分, 从而影响了气液间传质效率与氧化效率.臭氧间接氧化多发生在中、碱性条件下, 臭氧在碱性条件下很不稳定, 易促进其自身分解(Tamura et al., 1999), 可通过自发的一系列链式反应生成强氧化性的· OH(Weiss et al., 1935; Nadezhdin et al., 1988).而· OH比臭氧具有更高的氧化能力(Eh=2.80 eV), 其反应速率常数没有臭氧的波动大, 为4.5×108~7×109 L · mol-1 · s-1(Buxton et al., 1988).
因此, 设置不同臭氧氧化初始pH值, 考察其对废水中低浓度、高稳态络合Ni去除率的影响, 结果如图 2a所示.由图可知, 总Ni的去除率随着初始pH的增加而逐渐升高, 但在过高pH条件下去除率反而下降.反应体系废水的初始总Ni浓度为2.76 mg · L-1, 在酸性(pH=3.0)条件下, 充分氧化50 min后, 溶液中残留的总Ni浓度仍为2.25 mg · L-1, 去除率仅有18.57%.而在初始pH分别为5.0、7.0、8.0、9.0和11.0的条件下反应相同时间, 重金属总Ni的去除率呈上升趋势, 分别达到76.26%、97.53%、97.67%、97.62%和98.34%.而在初始pH为12.0时, 总Ni去除率下降(86.45%).在去除率大于96%时, 废水中残留重金属总Ni的浓度低于0.1 mg · L-1.
图 2

图 2臭氧氧化不同初始pH (a)、臭氧载气流量(b)、臭氧氧化时间(c)和SN-9投加量(d)对废水总Ni去除率的影响
由此可初步推测该反应体系中主要以间接氧化反应为主, 小部分溶解态的臭氧首先无选择性地氧化废水中部分易降解的有机物, 其次大部分臭氧转化成· OH并进一步氧化不饱和双键或三键等大分子有机污染物, 进而将水体中大分子高稳态络合Ni有机污染物氧化成易失稳的小分子络合态Ni和部分游离态Ni(Ⅱ).在反应前10 min, 总Ni的去除效率极高, 而在10~50 min反应时间内有所减缓, 推测是在反应前期有机物浓度相对较高, · OH与有机物接触面积大, 反应速率快.而当溶液中pH过高时(pH>11), · OH之间会发生速度极快的猝灭反应, 此反应的速率常数为109 L · mol-1 · s-1, 从而溶液中的· OH浓度下降(Andreozzit et al., 2005).因此, 在反应体系的初始pH为12.0时, 反应开始前一段时间, · OH相互之间发生猝灭反应, · OH的产生量显著减少, 反应体系氧化速率降低, 以致总Ni的去除率对比pH为7.0~11.0时会有所下降.实验结果表明, 臭氧预氧化反应体系初始pH值在7.0~11.0的较大范围内, 废水中总Ni的去除效果均很稳定, 去除率高.而化学镀镍废水经常规物化处理后, pH值大都在9.0~10.0范围内, 适合臭氧氧化环境, 不需额外调节pH值, 使得本研究深度处理工序简化.另外, 在反应过程中, 废水的pH值会随反应时间的增加逐渐降低, 反应完全后, 溶液趋于中性.
3.1.2 臭氧载气流量对总Ni去除率的影响
通过气体流量计调节臭氧的载气流量分别为2、3、4、6、8和10 L · min-1, 观察其对废水中总Ni去除率的影响.由图 2b可看出, 在相同氧化反应时间内, 处理后出水中总Ni的去除率随着臭氧载气流量的增加而递减.臭氧流量在2~4 L · min-1时, 处理后出水的总Ni浓度低于0.1 mg · L-1, 去除率达97%以上.由实验结果可知, 最佳的进气流量为3 L · min-1.而在6、8和10 L · min-1的臭氧载气流量下, 去除率分别仅为89.59%、86.20%和80.49%.在反应的前30 min内, 氧化速率较快; 当反应时间继续延长, 氧化速率渐变缓慢.整体氧化过程中, 臭氧氧化速率随载气流量的增加而递减.这表明臭氧氧化效率不仅与反应体系氧化时间相关, 还受载气流量的影响.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
这主要有两方面原因:一方面与臭氧发生器产生臭氧的机理有关, 氧气经过臭氧发生管时, 经高压电极板/发生管放电将氧气电离氧化成臭氧(式(1)~(3)), 因此, 气体流量越大, 经过臭氧发生管的时间越少, 导致产生的臭氧浓度下降, 总臭氧产量减少; 另一方面与气液接触时间和接触面积有关, 气体流量增大, 气液接触时间与接触面积减少, 导致臭氧向水相的传质速率、臭氧与废水中靶向物质的化学氧化速率降低, 臭氧与· OH不能充分接触及氧化水中络合态Ni有机污染物, 从而使总Ni去除率降低.
3.1.3 臭氧氧化时间对总Ni去除率的影响
根据3.1.1节与3.1.2节研究结果, 调节反应体系的初始pH=9.0和臭氧流量为3 L · min-1, 考察不同氧化时间对废水中总Ni去除率的影响, 结果如图 2c所示.由图可知, 随着反应体系氧化时间的增长, 总Ni去除率逐渐增大, 去除速率却逐渐降低.去除速率可通过拟合一次函数曲线斜率的绝对值k表示, k值越大, 去除速率越快.根据图 2c中去除曲线的规律, 将曲线分为3个阶段:0~10 min、10~40 min和40~50 min, 其拟合一次函数曲线斜率的绝对值分别为k1、k2和k3.根据实际数据计算可知, k1=0.048, k2=0.016, k3=0.002, k1大于k2且远大于k3, 由此说明虽然总Ni去除率逐渐增加, 但去除速率却逐渐降低.初始废水总Ni浓度为2.76 mg · L-1, 反应体系氧化时间为40 min时, 出水总Ni浓度为0.09 mg · L-1, 去除率高达96.74%.在臭氧流量为3 L · min-1下, 经携带式臭氧浓度在线检测仪所测试的臭氧浓度为90~110 mg · L-1, 试折算出臭氧投加量约为720~780 mg · L-1, 然而局限于现有的实验方案设计、检测与分析手段, 实际参与络合Ni污染物反应的臭氧投加量远远小于宏观折算的臭氧投加量.另外, 经反复实验测试发现, 针对化学镀镍废水中低浓度、高稳态的靶向络合Ni污染物, 若想实现处理后出水总Ni浓度控制在0.1 mg · L-1以下的高要求, 最开始所需提供的臭氧或经臭氧自发反应产生的· OH的量就必须达到一个基础浓度值, 称之为“浓度反应阈值”.由于实际的化学镀镍废水中存在各种复杂的络合物和还原性物质, 而且臭氧及· OH不具有选择性, 因此, 在氧化反应过程中易先氧化易接触的大分子有机物和络合物, 臭氧及· OH攻击靶向络合态Ni的几率大大降低.在反应体系中, 臭氧或· OH生成的量一旦达到这个浓度反应阈值, 体系的破络反应就很快促发, 氧化反应速率快且氧化分解彻底.然而, 若未达到体系的浓度阈值, 则无论后续持续累积投加多少臭氧, 都无法促发反应顺利进行, 导致出水总Ni浓度无法大幅度下降.后续需对该“浓度反应阈值”现象进行进一步深入研究.
3.1.4 SN-9投加量对总Ni去除率的影响
本文研究了废水经臭氧预氧化破络前后, SN-9投加量对总Ni去除率的影响(图 2d), 反应体系初始的总Ni浓度为2.76 mg · L-1.由图可知, 在化学镀镍废水中直接投加SN-9对总Ni的去除效果并不理想, 去除率仅为6.76%~19.15%;经臭氧预氧化破络后再投加SN-9, 10 mg · L-1的SN-9投加量即可高效捕集废水中约70%的重金属Ni.当SN-9投加量为40 mg · L-1时, 处理后出水总Ni浓度为0.09 mg · L-1, 去除率达97.46%, 可达标排放.继续增加SN-9投加量, 去除率无明显增加, 此时废水中残留的Ni浓度已非常低.
若不经过预氧化破络处理, 废水中大部分的Ni以稳定性极强的络合物形式存在, 很好地被有机配体“保护”, SN-9不能有效捕集靶向重金属Ni.由此可推测, SN-9通过竞争配位可从低分子的络合态Ni中夺取Ni离子形成稳定的螯合沉淀物.而经臭氧充分氧化后, Ni以低分子的化合物形态或者游离态存在于水体中, 此时加入少量的SN-9即可产生竞争螯合沉淀反应.这表明在O3-SN-9体系中, 前端的臭氧氧化是基础, 在氧化不充分的条件下, 废水中的Ni仍以稳定性极强的大分子络合物的形式存在, 后端即使继续添加过量的SN-9, 竞争螯合沉淀反应的效率仍然极低; 后端SN-9捕集是关键, 前端预氧化不需要完全破络成重金属离子, SN-9仍能利用自身独特的官能团螯合靶向重金属, 使待处理的重金属从液相转移至固相, 达到高效捕集重金属Ni的效果.
3.2 低浓度高稳态络合Ni的去除机制
3.2.1 臭氧预氧化络合Ni的破络机制
实际化学镀镍废水中存在多种难降解的络合态Ni污染物, 乙二胺四乙酸(EDTA)是能够与元素周期表中大多数金属元素配位络合的最强螯合剂之一(Escudero et al., 2008; Chen et al., 2015), 以致乙二胺四乙酸-镍(EDTA-Ni)成为最难被氧化、化学性质最稳定的络合态污染物之一.由于实际废水的成分复杂多样, 以及检测分析手段不完全, 根据化学镀的合成工艺, 本文主要考察臭氧对EDTA-Ni的氧化破络作用.目前, 有关EDTA-Ni的降解途径及中间产物均已有研究(Huang et al., 2016, Xu et al., 2017), 尽管所采用的高级氧化方式不同, 但大多数研究得出的结论相近:在EDTA-Ni的氧化过程中, 乙酸根分级脱落, 最后形成小分子的有机酸、游离态Ni(Ⅱ)及部分小分子金属络合物.其中, 复杂的中间金属络合产物包含乙二胺基三乙酸-镍(ED3A-Ni, ethylene diamine triacetic-Ni)、乙二胺-N, N′-二乙酸-镍(ED2A-Ni, ethylene diamine-N, N′-diacetic acid-Ni)、氨基乙二胺甘氨酸(EDMA-Ni, amino ethylene glycine-Ni)和乙二胺-镍(EDA-Ni, ethylene diamine-Ni), 还包括草酰胺酸、甘氨酸、乙醛酸、草酸和甲酸等小分子化合物.
联用LC-MS检测臭氧氧化前后废水中EDTA-Ni相关络合物及中间产物的变化情况(图 3).实际化学镀镍废水中存在多种复杂的化合物及络合态污染物, 鉴于已有分析手段的不足, 主要以几种目标EDTA-Ni相关的络合物进行分析, 并扣除了其他杂质背景.由图 3可知, 在臭氧预氧化之前, 原水仅经简单的物化处理, 废水中主要的络合态Ni污染物为ED2A-Ni, 其次是低分子的EDA-Ni和ED3A-Ni, 而EDTA-Ni与EDMA-Ni只占少量.简单的物化处理工艺不能达到最新的排放要求, 且现场运行条件难以控制, 氧化过程不彻底, 导致大部分的EDTA-Ni络合物仅被初步氧化至ED3A-Ni和ED2A-Ni.而废水经充分氧化50 min后, ED2A-Ni含量显著减少, 难降解的EDTA-Ni和ED3A-Ni完全被氧化, 此时废水中只含有少量的ED2A-Ni、EDMA-Ni和EDA-Ni(图 3).这表明常规物化处理后的废水经臭氧氧化后, 可实现部分氧化破络, 大分子稳定性强的络合Ni部分分解为易失稳的小分子络合态Ni和游离态Ni(Ⅱ).
图 3

图 3臭氧氧化前后重金属Ni络合物及中间产物的变化
为了检测O3-SN-9耦合体系协同作用下, 臭氧的预氧化进程是否可以控制在部分破络程度, 本文进一步对比测试了SN-9和碱沉淀法对废水中Ni的去除效果.研究表明, 经常规物化处理后废水中的Ni主要被包裹在有机配体中, 直接投加SN-9和氢氧根离子(OH-)均不能对废水中的Ni进行有效去除.而将废水经臭氧充分氧化相同时间后, 分别投加适量SN-9和过量的碱液(调pH值在>9.5的最佳沉淀范围), 其他实验条件保持一致, 两者对废水中Ni的去除效果相差甚远(图 4).OH-只可与游离态Ni(Ⅱ)反应生成化学沉淀.臭氧预氧化处理50 min后, 即便过量的OH-作用下, 废水中总Ni的去除率仅为50.13%;而相同条件下, SN-9对总Ni的去除率可高达97.46%.再次证明O3-SN-9耦合体系中, 臭氧预氧化进程为部分氧化破络过程, 并非完全氧化破络, 氧化产物为低分子的络合态Ni和部分游离态Ni(Ⅱ).由于SN-9可同时高效捕集废水中低分子、易失稳的络合态Ni和游离态Ni(Ⅱ), 因此, 可减少反应体系的臭氧投加量, 提高重金属处理效率, 同时减少药剂投加量.
图 4

图 4 OH-与SN-9去除废水中总Ni的效果对比
为了进一步考察O3-SN-9耦合体系臭氧氧化络合态Ni(如EDTA-Ni)的破络机制, 调节反应体系初始pH值为9.0, 开展了TBA捕获· OH实验, 结果如图 5所示.TBA与· OH具有较高的反应速率常数(k=4×109 L · mol-1 · s-1), 而且几乎不与臭氧发生反应(k=1×10-3 L · mol-1 · s-1) (Andreozzi et al., 1999), 被众多研究认为是一种有效的· OH捕获剂, 在AOPs捕集实验中得到了广泛的应用(De witte et al., 2009; Sein et al., 2008).由图可知, 在TBA投加量为10 mL · L-1时, 反应体系处理后出水的总Ni去除率为78.86%, 低于没有投加TBA时的去除率(97.46%).而TBA投加量为50 mL · L-1时, 总Ni的去除率几乎为零.而且, 在臭氧反应中投加TBA后, 废水的总Ni去除速率均显著降低.前文已指出, 臭氧在碱性条件下可自发产生氧化性更高的· OH.在TBA投加量为50 mL · L-1时, TBA几乎把臭氧所产生的· OH全部捕获, EDTA-Ni等络合态Ni污染物氧化降解速率受到显著抑制, 总Ni未能有效去除.这表明臭氧预氧化主要是以间接氧化破络为主, 直接氧化为辅.· OH是主要的强氧化剂, 氧化络合态Ni污染物, 而臭氧主要通过自身链式反应提供· OH, 并非直接参与氧化过程.
图 5

图 5 TBA对废水总Ni去除效果的影响
3.2.2 SN-9捕集Ni的螯合机理
废水经臭氧氧化后, 分别投加适量的SN-9和OH-进行螯合沉淀和化学沉淀, 沉淀物经洗涤、干燥后, 分别对SN-9原样、O3-SN-9体系沉淀物、O3-OH-体系沉淀物进行FTIR表征.三者光谱图如图 6所示:SN-9原样在3372 cm-1处有最强吸收峰, 此峰为H—N的振动伸缩峰; 2978 cm-1处为C—H的振动伸缩峰, 且此峰低于3000 cm-1, 为C—H的饱和吸收峰.2698 cm-1处为微弱的—SH特征吸收峰; 1672 cm-1处为—SH振动伸缩峰; 1063 cm-1处为C═S振动伸缩峰; 1476 cm-1处为C—S特征吸收峰; 1091 cm-1处为N—C═S的伸缩振动吸收峰, 985 cm-1处为C—S伸缩振动吸收峰.以上结果表明, SN-9是双齿配位体, 即S═C—S.
图 6
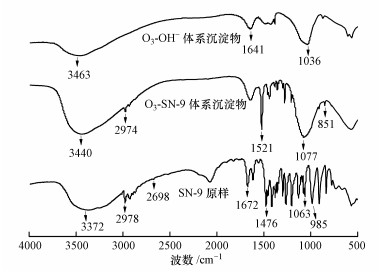
图 6 SN-9原样、O3-SN-9体系沉淀物、O3-OH-体系沉淀物的FTIR谱图
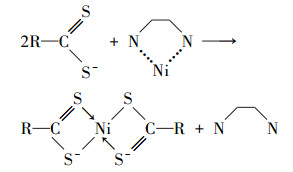
SN-9分子结构中具有二硫代羧基(—CSSH)官能团.在二硫基羧基的S原子中有3对孤立的电子, 其中两个可以占据金属离子的空D轨道, 导致形成配位键.根据配位理论, 在空D轨道条件下容易形成正四面体结构(Zhen et al., 2012), 此时电子对的相互排斥作用最小, 在S原子的外层由4个电子对组成一个正四面体结构的稳定的网状螯合物(式(4)、(5)).因此, 随着配位键的形成, 产生稳定的Ni沉淀物.SN-9与金属Ni反应后在1672 cm-1处的—SH振动伸缩吸收峰基本消失, 由此可推出SN-9捕集重金属Ni的主要官能团为—SH, 这与严苹方等(2015)的研究结果一致.由于实际废水成分复杂, 螯合沉淀物在加入PAC、PAM辅助絮凝沉淀后, 其他特征吸收峰(如C═S和C—S)发生一定的红移或断键.传统碱沉淀工艺在预氧化后投加OH-, 对比O3-SN-9耦合体系, OH-与Ni(Ⅱ)的化学沉淀在FTIR谱图中并没有太多特征吸收峰, 且吸收强度不高.
4 结论(Conclusions)
1) O3-SN-9耦合体系对化学镀镍废水具有良好的深度处理效果, 在臭氧预氧化反应初始pH值范围为7.0~11.0, 反应时间为40 min, 臭氧载气流速为3 L · min-1, SN-9投加量为40 mg · L-1的条件下, 处理后出水总Ni浓度低于0.1 mg · L-1, 可达到水污染物特别排放限值中总Ni的排放限值要求.且该处理工艺简单, 无需反复调节pH值, 药剂投加量少, 产泥量极低.
2) LC-MS及TBA捕获· OH实验结果表明, 臭氧氧化以间接氧化为主, 直接氧化为辅.氧化进程可控制为部分氧化破络, 不需要完全氧化破络, EDTA-Ni由大分子高稳态化合物逐步被氧化成小分子易失稳化合物, 氧化产物为低分子的络合态Ni和部分游离态Ni(Ⅱ).
3) 通过对比分析SN-9和沉淀物的FTIR谱图可知, SN-9含有—SH官能团.在螯合沉淀过程中, SN-9分子上的—SH可从低分子易失稳的Ni络合物上竞争夺取Ni离子, 或直接与完全破络的Ni2+反应, 形成不溶性稳定四边形配位化合物.(来源:环境科学学报 作者:关智杰)




