焦化废水是煤在高温干馏过程中以及煤气净化、 化学产品精制过程中产生的高浓度、 难降解有机工业废水,酚类是其主要有机组分,其他的有机物包括多环芳烃和一些含有氮、 氧和硫的杂环化合物,无机组分则包括氰化物、 硫氰化物(SCN-)和氨氮等[1, 2]. 酚类、 硫氰化物和氰化物是焦化废水中COD 的3 大主要来源,SCN-在焦化废水中的浓度为200~1000 mg·L-1,是仅次于酚类的第2 大COD来源; 由于SCN-的毒性相对较低,其在焦化废水处理过程中受到的重视程度远不如挥发酚和氰化物等污染物[3, 4]. SCN-是苯酚和氨生物降解的抑制剂[5, 6],对硝化过程有抑制作用[4]. 同时,SCN-的转化需要大量的氧化剂或溶解氧,且可能生成CN-中间产物[7],因此,SCN-不仅对焦化废水的主要控制指标COD、 色度及NH4+-N等有直接或间接作用,还会使废水毒性增高. 因此,焦化废水中的SCN-必须彻底有效去除,以消除废水对生态环境带来的潜在威胁和危害.
焦化废水的处理过程主要包括脱酚、 蒸氨、 脱氰、 除油、 生化处理、 混凝沉淀和后续高级氧化等. 其中生化处理是焦化废水处理的主体和核心,如缺氧-好氧、 厌氧-缺氧-好氧和序批式活性污泥法等[8]. 污泥的细菌群落结构在废水的生物处理过程中起着至关重要的作用,决定废水中污染物的去除效率[9, 10]. Zhu等[11]利用454高通量测序研究了焦化废水厌氧/缺氧/沸石生物滤池-膜生物反应器中微生物的群落结构组成和动态变化,结果表明沸石材料可以改变微生物菌群结构,促进了一些新类群的出现,使氨氧化菌和亚硝化细菌逐渐成为优势菌. 曹军伟等[12]通过 PCR 和 16S r DNA 序列分析技术,在焦化活性污泥中鉴定了20个属的28种酚类化合物降解菌. 乔琳等[13]通过末端限制性片段长度多态性(T-RFLP) 分析手段,探讨了固定化生物强化与对照反应器中微生物群落结构的动态变化,表明在吡啶初始浓度为 782.4~2934 mg·L-1时,投加的菌株Paracoccus sp.KT-5可以作为优势菌始终存在于反应器中. Huddy等[14]利用基因克隆文库分析表明Thiobacillus 是ASTERTM生物处理系统中SCN-降解的优势菌. Ryu等[15]利用高通量解析了SCN-降解过程中的藻类和细菌群落结构的动态变化,发现Thiobacillus 细菌和Micractinium 藻类为优势生物. 焦化废水处理系统功能的稳定性主要依靠优势微生物的活性和多样化的群落结构间的相互关系[16],SCN-是焦化废水中COD的主要来源之一,其好氧段生物去除效果影响废水的达标排放,而降解SCN-的细菌群落结构依然处于“黑匣子状态”. 对焦化废水活性污泥中降解SCN-的微生物进行分子生态学研究,有助于探讨焦化废水处理的工艺改进、 动态监控和优化控制.
本研究利用KSCN为唯一碳源和能源,采用逐步提高其浓度的方法富集焦化废水活性污泥中的SCN-降解菌群,并利用454测序分析其细菌多样性以及在不同SCN-浓度条件下群落结构的演替变化,以期为焦化废水处理工艺的稳定运行提供理论基础.
1 材料与方法
1.1 主要试剂和材料
生工Ezup柱式土壤基因组DNA抽提试剂盒,KSCN(分析纯); 接种污泥采集自鞍山某焦化厂好氧池.
1.2 污泥的驯化培养
取适量经沉淀浓缩的新鲜活性污泥于有机玻璃反应器中,加入用自来水配置的浓度为100 mg·L-1的KSCN水溶液,使其污泥浓度为3~5 mg·L-1,在温度为31℃条件下充分曝气(DO 4.0~7.0 mg·L-1),定时取样检测活性污泥降解SCN-的能力,同时设置未加污泥的污水做对照组. 活性污泥可以在24 h内可完全降解100 mg·L-1的SCN-,静置1 h后去除上清液,加入新鲜的100 mg·L-1的KSCN水溶液在相同条件下继续培养24 h(1号样品),去除上清液后加入浓度为300 mg·L-1的KSCN水溶液,培养2 d(一个周期)更换新的KSCN水溶液,8个周期后(2号样品)加入浓度为600 mg·L-1 的KSCN水溶液继续驯化培养,6个周期后结束培养(3号样品).
1.3 活性污泥对SCN-浓度的生物降解
分别取适量经沉淀浓缩的新鲜活性污泥和100~600 mg·L-1 KSCN驯化富集的活性污泥于有机玻璃反应器中,加入用自来水配置的浓度分别为100、 300、 600 mg·L-1的KSCN水溶液,使其污泥浓度为3~5 mg·L-1,在温度为31℃条件下充分曝气定时取样,检测活性污泥对SCN-的降解能力. SCN-的测定方法参照文献[17].
1.4 细菌多样性分析
1.4.1 污泥样品预处理
将不同周期培养后的活性污泥样品置于1、 2和3离心管中离心弃上清,用已灭菌的生理盐水洗涤 2~3次,用于后续污泥细菌总DNA的提取、 PCR和测序分析.
1.4.2 污泥细菌总DNA 提取、 PCR和16S rDNA测序
污泥细菌总DNA 提取、 PCR和16S rDNA测序由上海生工公司完成. 细菌总DNA 提取按照生工Ezup柱式土壤基因组DNA抽提试剂盒进行. PCR扩增引物: 341F CCTACGGGNGGCWGCAG 和805R GACTACHVGGGTATCTAATCC[18],扩增区域V3-V4. 反应条件94℃ 30 s; 94℃ 20 s,45℃ 20 s,65℃ 60 s,5个循环; 94℃ 20 s,60℃ 20 s,72℃ 20 s,20个循环; 72℃ 5 min,10℃. 50 μL反应体系,50 μL PCR反应体系及10×PCR buffer 5 μL,dNTP (10 mmol·L-1) 0.5 μL,Genomic DNA10 ng,引物F(50 μmol·L-1) 1 μL,引物R (50 μmol·L-1) 1 μL,Plantium Taq (5 U·μL-1) 0.5 μL,水42 μL. 各样品PCR 扩增后,利用Roche 454 GSFLX+测序仪上机测序.
1.4.3 序列数据处理
原始序列数据通过质量控制,舍弃低质量序列之后序列长度大部分分布在400~600 bp之间,平均长度均在440 bp以上,各样本序列数均在500 bp以上. 物种分类采用RDP classifier软件. 按照相似度为97%的标准将操作分类单位(operational taxonomic units OTU)进行分类[16],运行软件mothur(http://www.mothur.org/)中的summary.single 命令,计算常用的生物多样性指数,如丰富度指数(Chao/ACE指数)、 覆盖率指数(good's coverage)和多样性指数(Shannon指数).
2 结果与讨论
2.1 活性污泥对SCN-的生物降解
硫氰化物是焦化原水中含量最高的无机污染物之一[4],而在曝气池中SCN-的浓度约100mg·L-1. SCN-的组成元素 S、 C和N 是生物生长所需的营养元素,在好氧条件下微生物可以SCN-作为其碳源、 氮源或硫源进行生长,并形成SO42-、 CO2和NH4+代谢产物[15]. 结果表明(如图 1),原始污泥和驯化污泥对SCN-的降解速率随着SCN-初始浓度的升高而增大,驯化污泥的降解能力大于原始污泥,初始SCN-浓度为600 mg·L-1时,原始污泥的降解速率为14.255 mg·(g·h)-1,而驯化污泥的降解速率为15.978 mg·(g·h)-1,表明污泥驯化有利于SCN-降解菌群的富集和降解能力的提高. 解析不同SCN-浓度下驯化污泥的细菌种群结构有助于揭示污泥的降解机制和降解效率.

图 1 活性污泥中SCN-的的降解速率
2.2 活性污泥的细菌群落结构多样性
为了分析降解SCN-的细菌群落结构丰富度,在97%相似水平上计算了常见的多样性指数. 污泥细菌多样性指数如表 1所示,覆盖率指数是样品的测序深度也表明样品的覆盖率,3个样品的覆盖率分别是0.97、 0.98和0.98,表明绝大部分的细菌种群都被检测出来. 随SCN-驯化浓度的升高,活性污泥中的细菌多样指数随之减少,如100 mg·L-1 SCN-的活性污泥经过300 mg·L-1和600 mg·L-1的SCN-培养驯化后,生物分类单元(OTUs)从949分别降为749和702,香农指数也从4.42分别减为3.49和3.28,这表明细菌多样性及结构在不同浓度SCN-的培养下发生了改变,高浓度的SCN-对群落结构产生胁迫压力,使其生物多样性减少. 图 2同样显示不同SCN-浓度对生物群落结构的影响,图 2(a)生物群落丰富度稀疏曲线显示600 mg·L-1 SCN-的OTUs最少,100 mg·L-1 SCN-的OTUs最多,说明SCN-浓度越大,细菌多样性越少. 相似的结果也通过聚类分析图 2(b)得以阐明,聚类热图采用样本间unifrac 距离矩阵绘制,颜色块代表距离值,颜色越红表示样本间距离越近,相似度越高,越蓝则距离越远; 100 mg·L-1和300mg·L-1 SCN-培养过的生物群落聚类在一起,且距离较近,说明细菌群落结构经演替变化可以适应不同的SCN-浓度环境,SCN-浓度越高对生物群落的胁迫压力越大,细菌种群差异越大.

表 1 细菌群落多样性指数

图 2 细菌群落丰富度稀疏曲线和聚类分析
不同浓度的SCN-对活性污泥生物群落结构产生的影响不同,污泥生物群落维恩图(图 3)表明3个污泥样品共享部分OTUs占整个OTUs的13%,这部分微生物群落结构受SCN-浓度的波动干扰小,推测其对硫氰化的耐受性高,其中部分细菌菌群可能是SCN-降解菌群,可以SCN-为唯一碳源、 硫源和能源; 另一部分菌群可能与污泥的稳定性有关. 此外,图 3表明300mg·L-1和600 mg·L-1 SCN-培养的污泥共享的OTUs为106,300 mg·L-1 SCN-和原始污泥共享的OTUs为104,而600 mg·L-1SCN-和原始污泥共享的OTUs为51,同样说明高浓度SCN-驯化污泥与原始污泥的细菌群落多样性相差较大.
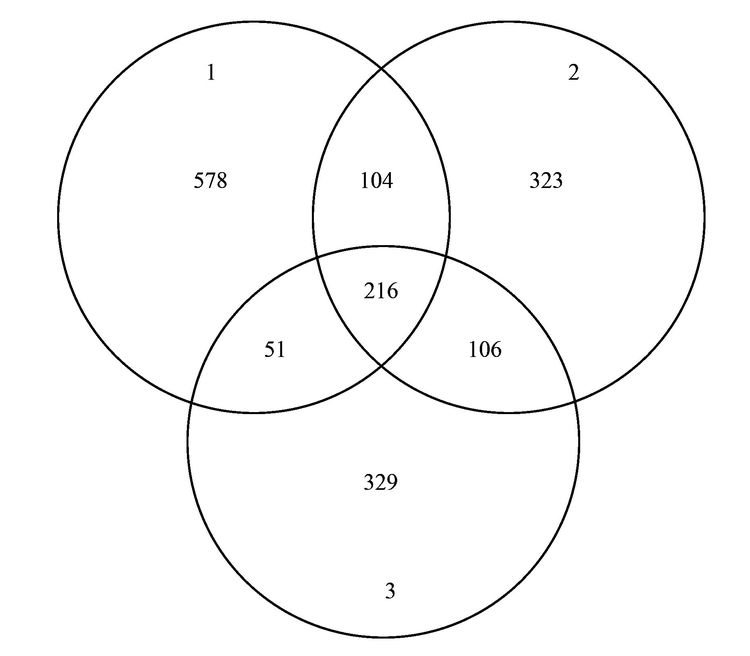
图 3 细菌群落结构维恩图
2.3 细菌群落结构组成和丰度
为了解析细菌群落结构组成和丰度,对质控后的序列采用RDP classifier软件进行物种分类,图 4、 表 2和图 5分别为细菌群落结构在门、 目和属水平上的组成和丰度. 污泥的优势门(图 4)主要有Proteobacteria、 Bacteroidetes、 Chlorobi、 Planctomycetes、 Acidobacteria、 Nitrospira、 Firmicutes、 未分类的和微小菌群,与Ma等[16]的研究结果基本一致. Proteobacteria在焦化废水中占主导地位[11],其在3个污泥样品中的丰度也最高,分别为47.47%、 50.28%和38.65%. Bacteroidetes为第二优势门,丰度分别为36.78%、 31.57%和46.11%,Acidobacteria在3个污泥样品中的丰度分别为2.62%、 7.33%和7.99%. Bacteroidetes 和 Actinobacteria为好氧污泥中的优势门,Mclellan等[19]发现二者也为污水处理厂进水中的优势细菌. Chlorobi的丰度分别为0.21%、 1.65%和3.19%. Firmicutes在3个污泥样品中的丰度分别为4.04%、 0.35%和0.25%,而在厌氧污泥中的丰度高达92.3%[20]. Nitrospira为亚硝化细菌,在3个活性污泥中的丰度低于1%. 各种分子指纹图谱的方法已被开发用于评估微生物群落结构,而高通量测序可以检测更多未知和低丰度的序列[21]. 虽然90%以上的细菌门类在3个污泥样品中被鉴定,然而无法分类或者未知的门类在3个污泥样品中的丰度分别为6.54%、 7.69%和2.79%.
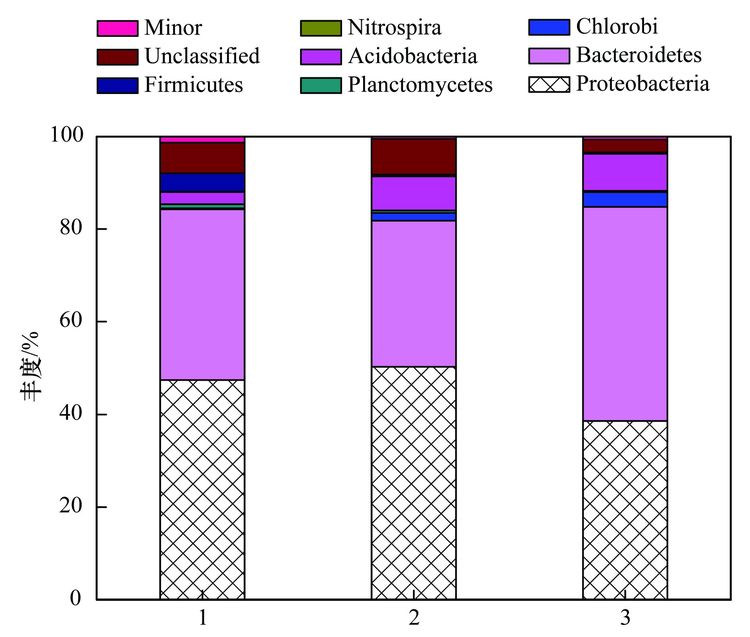
图 4 细菌群落结构门水平上的组成
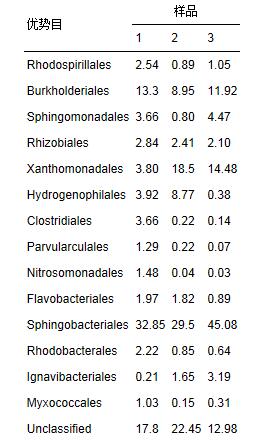
表 2 细菌群落结构目水平上的组成
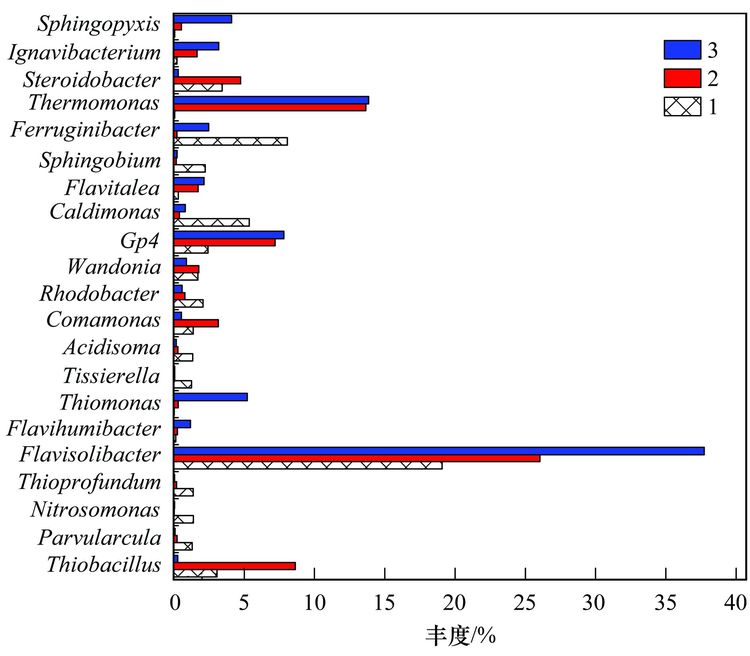
图 5 细菌群落结构属水平上的分布
目水平上分类表 2(每种目的丰度至少在一个样品中不小于1%)表明: 3个污泥样品的优势目均为Burkholderiales、 Sphingobacteriales 和Xanthomonadales. Sphingobacteriales 在3个污泥样品中的丰度分别为32.85%、 29.5%和45.08%,Xanthomonadales的丰度分别为3.8%、 18.5%和14.48%,而Burkholderiales的丰度分别为13.3%、 8.95%和11.92%. Burkholderiales可以降解烃类物质,是芳烃污染的地表水中的优势目[22],可降解焦化废水中的苯酚和PAHs(芘)[23, 24]. Rhodospirillales、 Sphingomonadales、 Clostridiales、 Parvularculales、 Rhodobacterales和Myxococcales等是3个污泥样品所共享的目,虽然各自的丰度不同,但表明其对不同SCN-浓度胁迫下有一定的适应性,也说明群落结构可通过自身的调整以适应不同的SCN-浓度环境.
细菌群落结构在属水平上的组成和丰度(每种属的丰度至少在一个样品中不小于1%)表明(图 5): 3个污泥主要的属为20个,不同属在不同污泥样品中的丰度不同,有些菌的丰度会随SCN-浓度的升高而提高,有些菌株的丰度会随SCN-浓度的升高而降低,结果类似于门和目分类得到的结论,进一步说明细菌种群对不同SCN-浓度胁迫下有一定的适应性,群落结构可以通过自身的组成变化适应不同的SCN-浓度环境. Flavisolibacter、 Ferruginibacter、 Caldimonas、 Steroidobacter、 Thiobacillus和Gp4,为100 mg·L-1 SCN-培养的污泥样品中主要的属,Flavisolibacter、 Thermomonas、 Thiobacillus、 Gp4、 Steroidobacter和Comamonas,为300 mg·L-1 SCN-培养的污泥样品中主要的属,而600 mg·L-1 SCN-培养的污泥样品中主要的属为Flavisolibacter、 Thermomonas、 Gp4、 Thiomonas、 Sphingopyxis和Ignavibacterium. Flavisolibacter可能参与聚羟基脂肪酸酯的合成[25],而Thermomonas在50℃生长的能力有助于细菌细胞壁组分的修饰,如蛋白质和(糖)脂质的化学修饰[26],自养微生物Thiobacillus 和Thiomonas可利用H2S作为能源生长[27]. 焦化废水中分离出Thiobacillus 和Acremonium菌株能以SCN-为唯一碳源和能源生长[28, 29],本研究未发现Acremonium的存在. Thiobacillus普遍存在于含SCN-的废水处理系统中,可有效降解SCN- [11],Thiobacillus为100 mg·L-1和300 mg·L-1 SCN-培养的污泥样品中的优势菌,丰度分别为3.07%和8.63%,而在600 mg·L-1 SCN-培养的污泥样品中的丰度仅为0.27%,表明在SCN-浓度<300 mg·L-1时Thiobacillus可能是SCN-主要的降解菌,然而SCN-浓度>300 mg·L-1时,可能有其他菌群参与SCN-的降解,如Arthrobacter、 Bacillus、 Escherichia、 Klebsiella、 Methylobacterium、 Ralstonia和Pseudomonas为SCN-降解菌[30],除Escherichia和Methylobacterium外,这些SCN-降解菌在本实验中均已经检测出来,然而其丰度很低,推测这些低丰度的SCN-降解菌可能在高浓度SCN-下发挥协同降解作用. 另外,不同的细菌具有不同的污染物降解功能,同一种细菌也可具有降解多种不同污染物的功能,如Comamonas菌可降解酚类、 PAHs和杂环类物质(如吲哚、 喹啉)等[16]; Thiobacillus不仅能降解SCN-,还具有很强的反硝化能力[31]; Pseudomonas可降解SCN-、 酚类化合物、 苯、 甲苯和PAHs等,同时具有硝化和反硝化的能力[32~35]. 污泥是一个复杂的微生物群体,焦化废水中SCN-的降解可能是多种菌群共同作用的结果,菌群间复杂的相互作用关系还有待进一步研究.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
(1) 活性污泥经300~600 mg·L-1 SCN-的驯化后,其SCN-的降解能力提高,细菌多样性随SCN-浓度升高降低.
(2) 活性污泥细菌群落结构组成中的优势门为Proteobacteria和Bacteroidetes,优势目为Burkholderiales、 Sphingobacteriales 和Xanthomonadales,Flavisolibacter是系统中含量最高的属,Thiobacillus是<300 mg·L-1 SCN-焦化废水中主要的SCN-降解菌,在600 mg·L-1SCN-高浓度时低丰度的SCN-降解菌群可能发挥协同降解作用.


