1 引言
于桥水库作为天津市生活饮用水及农业用水重要的水源地, 近年来入库污染负荷逐渐增加, 高负荷氮、磷营养盐的输入造成水库内蓝藻生长, 致使每年夏季“水华”现象发生, 藻类生物量高达12.83 mg·L-1.尤其是大坝区域, 受到风力、风向等因素的影响, 出现藻类聚集在岸边不易扩散的现象, 使得局部岸带Chl-a浓度均值达7.13 mg·L-1.大部分藻类死亡后堆积在沉积物表面, 进而在生物扰动或在悬浮作用下掩埋进入表层沉积物中, 作为碳源被微生物降解利用, 分解释放藻源性污染物导致水质二次污染, 因此, 藻屑腐烂分解对水质影响已成为研究热点之一.
已有大量研究表明, 蓝藻生物降解过程中会释放大量胞外有机物(EOM), 包括藻毒素、蛋白质、脂肪、多糖等有机质, 成为水生态系统中溶解性有机质(DOM)的重要组成部分.当高密度蓝藻暴发时, 一部分藻类分解,快速消耗水体溶解氧(DO), 引起藻屑死亡分解, 并且释放出大量的胞外聚合物(EPS), 很有可能成为消毒副产物(DBP)前驱物质, 引发一系列水质安全问题;另一部分堆积在沉积物中的藻屑, 通过好氧或厌氧分解产生高浓度溶解性有机碳(DOC)至间隙水中, DOC在浓度梯度作用下释放至上覆水中并不断累积.藻源性DOM具有结构复杂、种类繁多的特征, 易光化学降解或被微生物利用形成新的结构或小分子量DOM, 因此, 紫外可见吸收光谱和荧光光谱技术被用来定量与定性研究自然水体中DOM组分变化过程.近年来, 三维荧光光谱分析技术(EEMs)被广泛应用至DOM研究中.该技术通过平行因子法(PARAFAC)分析可得到DOM主要组分及所占比例, 如类蛋白类物质及类富里酸、类腐殖酸类物质等, 来追踪不同时期DOM腐殖化进程或被微生物利用的组分变化过程.Parlanti等(2000)在研究藻源的DOM时发现, 微生物是新近藻源DOM矿化的主要影响因素, 其中一部分DOM通过缩合反应或分子结构重排被转化成类腐殖质类物质, 进而引发一系列的荧光带变化.因此, 在本实验设计过程中利用EEMs技术来研究藻屑降解过程产生的DOM及其组分变化过程.
氮、磷作为限制性营养元素, 在藻类生长过程中发挥着不可或缺的作用;而作为藻类碎屑矿化分解释放的主要产物, 也不可忽视研究表明, NH4+-N、PO43--P释放量与藻添加浓度成正比, 蓝藻分解明显增加了水体中氮、磷浓度.这是由于溶解性有机氮(DON)与溶解性有机磷(DOP)作为藻源性DOM最为活跃的部分, 易被微生物利用转化成为无机氮、磷营养盐.而且蓝藻积累易消耗上覆水中大量的DO, 降低硝化细菌活性, 引起上覆水中NH4+-N、PO43--P不断积累.这时DO成为沉积物有机质矿化的主要影响因素, 制约着氮、磷释放.Roberts等(2012)研究表明, 富含有机质的沉积物在O2削弱区域向上覆水释放大量NH4+-N、PO43--P, 增加了沉积物有机质矿化速率.因此, 藻类碎屑有机质在沉积物中积累对沉积物氮、磷释放的影响不容忽视.
目前, 有关藻类水华暴发影响上覆水污染负荷的研究主要以室内添加新鲜藻浆模拟实验为主, 侧重蓝藻逐渐由活体到衰亡过程中对上覆水污染物(以氮、磷释放为主)再分配作用.相关研究表明, 近年来于桥水库夏季蓝藻水华发生期间水体Chl-a浓度平均为50~60 μg·L-1, 甚至累积高达1300 μg·L-1左右.然而水华发生后死亡蓝藻大多数以有机碎屑的形式埋藏或堆积于沉积物中, 可能改变沉积物-水界面的生物理化性质, 从而影响沉积物中污染物的地球化学循环过程.因此, 本文针对这一现象所产生的环境问题开展研究, 设置2个添加梯度, 一个代表现今蓝藻水华暴发的藻屑浓度(1倍组), 另一个代表严重水华暴发时的藻屑浓度(20倍组), 研究不同密度藻屑堆积对沉积物DOM及氮、磷等污染物释放形成的不同影响, 以揭示频繁发生的水华引起藻屑不断积累过程中对饮用水源水质产生的污染效应.
2 材料与方法
2.1 样品采集与处理
实验水样和泥样取自于桥水库.于2016年10月在于桥水库大坝区(40°01′54.21″N, 117°26′55.49″E), 用装有ϕ100 mm×500 mm有机玻璃管的柱状采泥器采集沉积物柱9根, 吸取样柱中的上覆水, 现场测定水温、溶解氧(DO)、pH、氧化还原电位(Eh).剩余水样保存于带有冰盒的保温箱中, 用于水质理化指标分析.柱子上部缓慢注满原水并用橡皮塞塞紧, 以免扰动底泥.采集水库底层水样25 L, 在实验室经0.45 μm醋酸纤维滤膜过滤后作为沉积物柱静态培养实验补给水.所有样品尽快运回实验室置于恒温室中((16±1) ℃), 模拟秋季蓝藻代谢死亡时的温度, 于暗处静置2 h使沉积物样稳定.
在大坝区用浮游生物网(孔径64 μm)采集浓缩藻液10 L, 带回实验室反复冻融4~5次以保证藻类死亡(细胞破碎并有藻蓝蛋白及其他内融物流出), 经蒸馏水反复清洗, 以5000 r·min-1转速离心得到浓缩藻浆, 置于-70 ℃冰箱中保存备用, 使用时用冷冻干燥机冻干, 并研磨过80目筛得到干藻屑, 实验用藻屑总氮(TN)、总磷(TP)和Chl-a含量分别为129.27、4.83和3.136 mg·g-1.
2.2 实验设计
分析得出于桥水库大坝上覆水Chl-a浓度为50~60 μg·L-1, 以此为依据设置2个藻屑添加组:1倍组(加入0.06 g干藻, 约6 g·m-2, 以干重计)、20倍组(加入1.2 g干藻, 约120 g·m-2, 以干重计), 以不添加藻屑组为空白对照.每组设置3个平行, 其中, 1倍组的藻屑添加量下Chl-a在上覆水中的浓度为56 μg·L-1, 符合大坝区域Chl-a浓度实况, 20倍组添加量设置以张亚等对于桥水库发生严重水华时调查的Chl-a浓度1300 μg·L-1为参考依据.首先将稳定好的沉积物柱(沉积物高度均为30 cm, 上覆水高度为19 cm)中的上覆水缓慢虹吸至无, 将冻干的藻屑按上述添加量与表层1 cm沉积物混匀, 用注射器缓慢注入少量过滤水样使沉积物稳定3 d.再将上覆水吸掉, 重新沿管壁缓缓注入过滤后的水样至标记处(保证每个柱子上覆水体积一致), 保证此过程中均未扰动沉积物表面.实验培养温度、光照与采样时现场温度相近, 为(16±1) ℃, 避光培养.开始培养当天记为第0 d, 按时间序列分别在第0、0.2、0.5、2、4、6、9、11、13、18、22和27 d采样.采样方式为利用注射器筒吸取沉积物-水界面上1 cm处水样70 mL, 其中, 50 mL水样过0.45 μm水系滤膜后于-20 ℃冷冻保存, 测定氮、磷营养盐;20 mL水样经GF/F膜(Whatman, U, K, 450 ℃灼烧4 h)过滤保存在棕色瓶(450 ℃灼烧4 h)中, 4 ℃冷藏保存.用紫外-可见分光光度计(UV2700, 岛津)进行光谱扫描, 用荧光分光光度计(F-7000, 日立)扫描三维荧光光谱(3DEEMs).采完样后用便携式溶氧仪(美国哈希HQ40D)测定沉积物-水界面层DO、Eh、pH.沿管壁缓慢补充相同体积原水至原位置.
2.3 分析方法
营养盐指标主要包括溶解性总氮(DTN)、溶解性有机氮(DON)、溶解性总磷(DTP)、氨氮(NH4+-N)、硝氮(NO3--N)、亚硝态氮(NO2--N)、正磷酸盐(PO43--P).其中, DON为DTN与DIN(NH4+-N、NO3--N、NO2--N之和)之差, 测定所用液体为过0.45 μm醋酸纤维膜的上覆水.分析方法均参照《水和废水监测分析方法(第4版)(国家环保总局《水和废水监测分析方法》编委会, 2002).
紫外-可见光全波扫描(UV-Vis):将经GF/F膜(450 ℃灼烧4 h)过滤的水样用紫外-可见分光光度计(UV2700, 岛津)扫描测定DOM吸收光谱, 扫描范围为200~800 nm, 间隔为1 nm.通过提取相关光谱特征参数(表 1), 获得关于溶解性有机质的分子量大小、结构变化等信息.
表 1(Table 1)
表 1 紫外-可见吸收光谱参数 Table 1 Parameter of Ultraviolet-visible spectral
参数定义意义
E250/E365250 nm和365 nm处吸光度比值可以表征溶解性有机质(DOM)的分子量大小及其腐殖化程度, 与之大小呈负相关
E253/E203253 nm与203 nm处吸光度比值反映出芳香环的取代程度及取代基的种类
SRSR=S275~295/S350~400, 根据所在波段的吸光度值非线性拟合所得比值光谱斜率(S)根据所在波段的吸光度值非线性拟合所得;SR与DOM相对分子质量呈反比, 与含量无显著相关性
注:参数来源于文献(李晓航等, 2010;程杰等, 2014).
三维荧光光谱:用高灵敏度荧光光谱分析仪(Hitachi F-7000, Japan)进行三维荧光光谱扫描测定.激发波长范围为λEx=200~450 nm, 间隔为10 nm, 发射波长范围为λEm=250~600 nm, 间隔为2 nm.实验以Milli-Q超纯水为背景值, 每隔10 min扫描出一次图.EEM-PARAFAC组分分析首先结合紫外可见光谱数据进行内滤效应修正, 三维荧光光谱数据扣除超纯水背景值以消除拉曼散射, 将出现瑞利散射的置零, 消除瑞利散射影响, 在MATLAB 2014a中运行DOMFluor工具箱, 对三维荧光光谱数据进行平行因子分析(Parallel factor, PARAFAC), 并得到组分模型.
数据采用Excel 2013进行计算, 并用Origin 9.0绘制数据图;利用Matlab 2014a对三维荧光数据进行处理;采用SPSS 20.0软件进行数据相关性分析.
3 结果分析
3.1 上覆水DO、Eh、pH变化特征
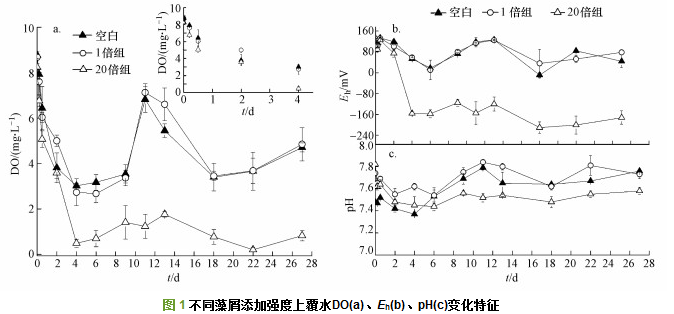
在沉积物柱静态培养过程中, 对照组及添加组上覆水DO浓度在前4 d呈快速下降趋势(图 1a), 尤其是20倍组, 到第4 d溶解氧浓度下降至0.5 mg·L-1, 而后DO趋于稳定并呈厌氧状态.其它两组在第4 d后DO浓度呈波动变化, 第4~9 d逐渐复氧, DO浓度恢复至初始水平;第9~18 d DO浓度逐渐降低, 但均处于好氧状态, 且两者无显著性差异(p > 0.05).从Eh分析可知(图 1b), 整个实验阶段3组实验组DO与Eh波动趋势相同, 相关性显著(p < 0.05).第0 d, 3组实验组Eh值均小于200 mV, 处于弱还原状态.大量藻屑引入后, 20倍组Eh值在前4 d从131.0 mV下降至-156.3 mV, 表明上覆水环境条件由中度还原环境转化成强还原环境(图 1b), 随后一直维持强还原状态.而空白组与少量藻屑引入组Eh值处于稳定波动状态, 无显著性差异(p > 0.05).3组实验组沉积物-水界面pH值在整个实验过程中略有波动, 均处于中性偏弱碱性, 20倍组pH值略低于空白组与1倍组.因此可知, 少量藻屑输入对上覆水DO、Eh、pH并无明显性影响, 但大量有机藻屑输入明显消耗大量DO, 使得上覆水形成厌氧强还原环境, 降低pH.
3.2 上覆水DOM变化特征 3.2.1 紫外-可见吸收光谱特征
静态沉积物柱培养过程中上覆水紫外可见光谱参数值变化如图 2所示, 第11 d后, 1倍组与20倍组E250/E365值略大于空白对照组(图 2a).20倍组E253/E203值在第4 d增加明显, 其它两组差异不大(图 2b).图 2中显示, 在实验过程中3组处理SR值均趋于降低, 20倍组小于空白组与1倍组(图 2c).
3.2.2 三维荧光平行因子法组分分析
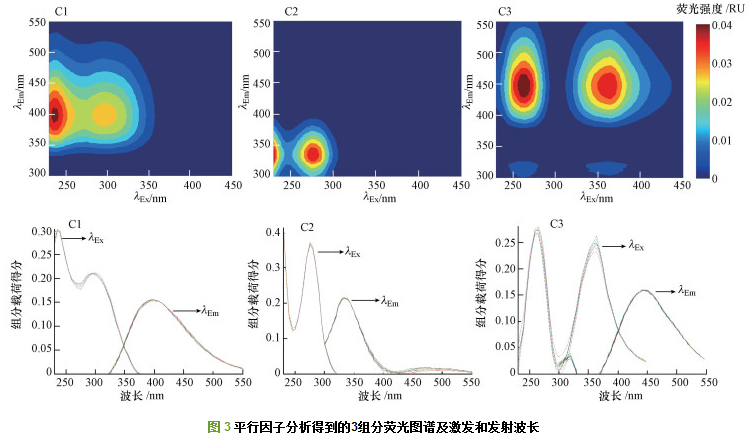
由平行因子分析法分析得到空白组与20倍组上覆水中溶解性有机质(DOM)的主要组分有3个, 分别为C1、C2、C3(图 3).如表 2所示, 组分C1(235、295 nm/396 nm)、C3 (265、365 nm/446 nm)均有2个激发波长峰值, 1个发射波长峰值, 属于类腐殖质荧光组分.C1(235 nm/396 nm)对应A峰, 属于紫外类腐殖质, C1(295 nm/396 nm)对应M峰, 属于UVA类腐殖质;C3(265 nm/446 nm)处于A峰范围内, C3(365 nm/446 nm)对应C峰, 属于可见类腐殖质, 类腐殖质峰以紫外类腐殖质峰(A峰)为主要存在形式, 可推断为分子量较大的UVC类腐殖质物质;C2(230、275 nm/336 nm)属于类蛋白物质, 并且激发和发射波长范围恰好处在类色氨酸荧光峰范围内, 含有类色氨酸基团, 因此, 属于类色氨酸类, 可认为来源于藻类降解, 其中, 230 nm/336 nm对应S峰, 275 nm/336 nm属于T峰.各组分值以荧光峰最高处的荧光强度即Fmax(RU)表示, 荧光强度越大, 物质组分的相对含量越高.
由图 4可知, 空白组腐殖质类物质(即C1、C3)含量随着培养时间的增加而逐渐增加, 类色氨酸含量处于波动状态, 最后减少.20倍组腐殖质类物质荧光强度值高于空白组(p < 0.05), 且其相对含量呈上升趋势.相反, 20倍组类色氨酸荧光强度由第0~4 d迅速上升至0.8 RU达到最高值, 对荧光强度的贡献比例高达51.7%.在随后的实验期间, 类色氨酸含量逐渐降低, 所占比例也逐渐降低至第27 d的37.3%, 类腐殖质对荧光强度的贡献比例为52.48%~67.72%.且在20倍组, 类色氨酸类物质及腐殖质类物质浓度均高于空白组, 说明藻屑输入是上覆水中类腐殖质及类色氨酸的重要来源.
3.3 上覆水氮、磷变化特征
实验期间, 各实验组各种形态氮存在显著差异, 其中, 空白对照组与1倍组上覆水NH4+-N释放量处于平缓增加趋势(图 5a), 处于0.37~0.85 mg·L-1之间, 占DIN的比例分别为12.13%~55.31%和14.54%~44.00%.与此相反, 20倍组NH4+-N释放量短时间内快速增加, 由0.73 mg·L-1上升至7.69 mg·L-1.经拟合计算, 前4 d空白组、1倍组和20倍组NH4+-N平均释放速率分别为0.11、0.16和1.0 mg·L-1·d-1.20倍组第4 d后NH4+-N浓度虽有所波动, 但整体逐渐稳定增加, 至实验结束时沉积物-水界面NH4+-N浓度增加至6.05 mg·L-1.整个实验过程中, 20倍组NH4+-N占DIN比的例由初始的21.9%上升至第4 d的78.07%, 之后维持在72.19%~80.67%, 说明NH4+-N是20倍组DIN释放的主要形态.各实验组NO3--N浓度在前4 d显著降低(图 5b), 空白组第4~18 d NO3--N浓度变化较小, 基本处于1.44~1.6 mg·L-1之间, 而1倍组第4~18 d NO3--N浓度逐渐增加, 第18 d后两组NO3--N浓度增加1倍多, 较为显著.实验期间, 空白组与1倍组NO3--N占DIN的比例分别为46.67%~86.59%和54.83%~84.23%, 说明NO3--N是空白组与1倍组DIN的主要形态.20倍组NO3--N浓度变化较小, 基本平稳, 占DIN的比例由初始的77.01%降至19.15%, 逐渐低于NH4+-N所占比例.DON与DTN在实验阶段中释放趋势与NH4+-N相似, 20倍组DON与DTN浓度前4 d分别增加15 mg·L-1与20 mg·L-1(图 5c、5d), 且DON占DTN的比例由第0 d的46.57%上升至第4 d的79.02%, 随后实验期间所占比例相对稳定, 可知释放出的DTN以DON为主.同样, 对照组与1倍组均是DON占DTN比例较多, 分别为46.93%~74.96%和47.33%~75.77%, 但在实验期间释放趋势平缓.
藻屑加入沉积物后PO43--P与DTP快速释放, 上覆水中PO43--P与DTP变化趋势相同.各实验组PO43--P与DTP均在前4 d显著增加, 并在第4 d到达最高值(图 6a、6b).第4 d到达峰值后上覆水中PO43--P与DTP浓度降低, 随时间变化无显著差异.各个实验组相比, 空白组与1倍组PO43--P与DTP释放量无显著差异(p > 0.05).20倍组PO43--P与DTP释放程度远高于空白组与1倍组, 其中,空白组、1倍组和20倍组PO43--P最高浓度分别为0.46、0.50和0.90 mg·L-1.空白组与1倍组DOP释放较为平稳, 实验期间无显著性差异(p > 0.05)(图 6c).20倍组DOP释放前4 d与其他两组无显著性差异, 但在第4~6 d增加0.25 mg·L-1, 第6 d后逐渐降低至稳定(图 6c).说明低密度藻屑添加条件下直接通过藻屑分解释放的DOP较低, 主要是由沉积物矿化引起的释放.高密度藻屑输入在短时期内分解可促进沉积物中PO43--P与DTP释放, 并且释放的DTP主要以PO43--P形态释放, 占DTP释放比例的57.74%~93.10%.
4 讨论
4.1 藻屑输入对上覆水DO、pH、Eh的影响
上覆水是污染物释放的汇聚区, 在浓度梯度作用下沉积物中的污染物可扩散至上覆水, 体现沉积物-水界面污染物释放过程.有机质的不断积累提高了沉积物需氧能力, 首先有机质分解需要电子受体, 按照需要顺序先后依次为O2、NO3-、Mn4+、Fe3+和SO42-等.因此, O2作为有机质降解的重要电子受体, 在丰富的有机质情况下能够快速被微生物利用消耗.因此, 在本实验中空白组和1倍组、20倍组前4 d DO浓度与Eh快速下降, 有机质以O2为电子受体进行矿化分解(图 1a、1b).而空白组和1倍组前4 d DO浓度下降, 复氧速率显然低于耗氧速率, 微生物降解有机质所消耗DO并没达到缺氧甚至厌氧环境.所以随后实验阶段, 可能由于溶氧环境条件变化, 耗氧速率低于复氧速率, 导致在第10~11 d空白和1倍组上覆水DO浓度突然大幅度上升.另一方面原因主要是微生物活性及其耗氧能力的改变.氧气充足情况下, 异养微生物新陈代谢过程利用水体中氧气与无机碳, 从而降低系统pH; 低氧情况下, 异养微生物死亡裂解产生NH4+, 导致pH升高, 因此, pH可以反映异养微生物活性状态.在第10~11 d, 空白组和1倍组上覆水中pH升至最高, 可能是因为部分异养微生物不适应条件变化,裂解死亡释放的氨基酸氨化产生NH4+, 导致其耗氧能力受抑制, 引起DO浓度回升.如此反复使其溶解氧处于“下降与上升”的动态过程.20倍组由于有机质增加了沉积物需氧量, 使得上覆水一直维持在缺氧或厌氧水平, 与空白组、1倍组形成明显差异.实验中发现, 添加硅藻后明显增强了沉积物柱耗氧速率, 与本实验结论一致.并且高浓度有机质在沉积物处积累往往伴随着黑臭现象, 本实验过程中同时发现20倍藻屑添加组沉积物柱在第4 d出现黑臭现象, 水体发臭, 与藻类分解产生的嗅味物质有关.与此同时, 活性有机质在降解过程中能够产生大量有机酸及CO2, 大量有机质堆积在沉积物表面同样能够加速硫还原速率, 导致水界面H2S浓度升高, 降低pH值.藻屑有机质分解、微生物活性等促使沉积物中酸性物质向上覆水释放可能是导致20倍组pH值低于空白组与1倍组的重要原因(图 1c).因此, 20倍组藻屑有机质矿化分解引起严重耗氧, 改变沉积物界面DO、Eh, 并产生大量有机酸及二氧化碳, 降低界面水体pH值.
4.2 藻屑输入对沉积物DOM释放影响
E250/E365常用作湖沼学中有机质腐殖化程度的指示.本研究中, 20倍组E250/E365高于其他两组, 说明20倍组藻屑有机质的腐殖化程度较沉积物中的低, 导致释放的DOM腐殖化程度较低.蓝藻堆积时期, DOM释放主要是以内源为主, 藻体分解释放大量DOM至水体.而且蓝藻堆积量越大, 会使厌氧微生物活性增加, 消耗有机质产生厌氧环境从而使其开始腐殖化过程.因此, 在实验期间, 各个实验组E250/E365值逐渐降低, 至结束时该值突然增加, 说明有机质降解过程中分子量及腐殖化程度有增加趋势.E253/E203值可以表征有机质结构中芳香环基团的取代程度及取代基种类, E253/E203值越大, 说明DOM取代基越多, 腐殖化程度低, 较易被微生物利用分解.图 2b显示, 20倍组E253/E203值较高,表明该组DOM腐殖化程度偏低, 与E250/E365指示结果一致.且随着有机质降解的进行, E253/E203值逐渐降低并趋于稳定, 可推断苯环类有机化合物上取代基中的脂肪链分解程度降低, 复杂有机质开始分解合成腐殖质, 与E250/E365分析得出的结果一致.同时, SR值作为紫外可见光谱重要的参数值, 与DOM分子量成反比, 能够定性地反映出DOM分子量的变化情况.在富含有机质水体中, 受光照影响, SR值趋于增加, 但在微生物作用下SR值会逐渐降低.本实验由于是避光培养, 基本可排除光照作用对SR值的影响, 造成各个实验组SR值降低的主要因素是微生物活动利用小分子DOM满足生理活动, 导致分子量较大的DOM比重逐渐增加(图 4a、4c).与空白组相比, 富含有机质的20倍组的SR值较低(图 2c), 可能与微生物降解活性有机质有关.此结论与陈丙法等(2016)研究发现的打捞蓝藻造成SR值偏高的结果一致.
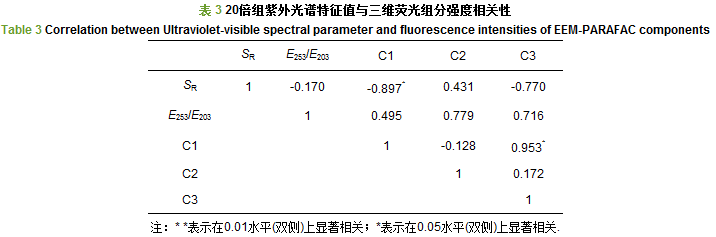
在本实验的20倍组中发现大量类色氨酸类物质(C2)和类腐殖质类物质(C1、C3)(图 4), 荧光强度均高于空白对照组, 说明藻屑分解初期释放出大量类蛋白物质和少量类腐殖质类物质(C1、C3).研究表明, 类色氨酸类物质易被微生物利用降解, 同时微生物活动也可使得类腐殖质含量增加.类腐殖质类物质的来源一般侧重于海洋深水生态系统, 但由于人为及藻类降解等原因, 目前在淡水生态系统也有所发现.实验初期DOM以类色氨酸为主, 对荧光强度的贡献比例为51.73%, 类色氨酸在后期由于细菌降解利用, 荧光强度降低, 同时难分解的类腐殖质组分C1、C3荧光强度逐渐增高(图 4a、4c), 分子量大的类腐殖质成为主要成分, 最终含量高于类色氨酸(图 4).相关性分析表明, C3与C1荧光强度呈显著正相关(p < 0.05), 与SR呈显著负相关(p < 0.05)(表 3).可协同表明上覆水中DOM分子量变化及藻屑的腐殖化程度.傅平青等认为羰基/羧基与类腐殖质荧光有关, E253/E203作为表征DOM取代基种类的重要指标, 而在表 4中并未发现E253/E203与C1、C3荧光强度具有显著相关性(p > 0.05).任保卫等(2007)和吕桂才等研究发现, 假藻、赤潮藻在生长阶段产生类色氨酸荧光物质、类腐殖质荧光物质, 类色氨酸荧光强度在稳定期达到最高, 而后由于细菌降解使其荧光强度降低.相反, 类腐殖质荧光强度在消亡期后逐渐增加.与本次实验20倍组中类色氨酸荧光强度先升高后降低的变化结果一致.
因此, 20倍组藻屑堆积在沉积物中对上覆水中DOM释放有明显的贡献作用.在降解过程中, 藻屑有机质初期分解较为剧烈, 有机质取代基种类及程度降低, 导致腐殖化程度增加.同时, DOM释放首先是以类色氨酸类物质为主, 在降解后期类腐殖质所占比重逐渐增加, 说明藻屑正处于腐殖化的历程.
4.3 藻屑输入对沉积物氮、磷营养盐释放的影响
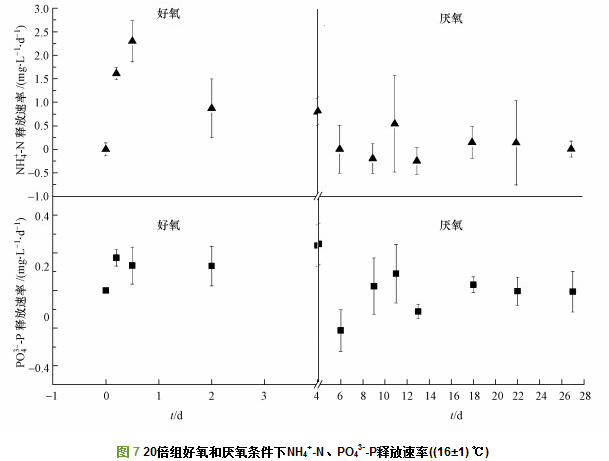
相关研究表明, 沉积物中氮矿化会释放各种形态无机氮(NH4+-N、NO3--N、NO2--N)至上覆水中, 且矿化程度和矿化速率与沉积物中有机质含量息息相关.实验前4 d, 空白组与1倍组DIN与DON释放无显著性差异且释放量相对稳定(图 5a~c), 原因在于对照组在实际环境已经接受了与1倍组相近浓度的蓝藻碎屑的输入, 其对沉积环境的生物理化性状已经有所影响.而添加1倍藻屑组不足以引起更大的影响, 所以二者差别不大.因此, 在下一步实验中将增加蓝藻浓度梯度研究, 获得引起明显改变的藻屑添加量阈值.其中, NO3--N是空白组与1倍组DIN的主要形式.高密度藻屑(20倍组)输入至沉积物使得沉积物有机质含量剧增, 藻屑矿化产生大量DTN(图 5d).同时, 20倍组藻屑来源的DTN由开始至实验结束增加了26.55 mg·L-1, DTN经好氧微生物作用矿化为NH4+-N或小分子DON(图 5a、5c、5d).20倍组藻屑分解促使DON浓度增加了23.34 mg·L-1, 同时藻屑耗氧降解释放出大量DIN, 形态以NH4+-N为主, 与空白组与1倍组差异明显.主要原因是受到DO的限制, 藻屑有机质活性高, 需氧能力强, 能够快速利用沉积物溶氧, 造成厌氧环境.因DO减少或不足使NO3--N成为电子受体参与氮矿化进程, 使得反硝化作用增强, NO3--N转化成N2或N2O, 导致NH4+-N不断累积增加, NO3--N浓度降低.同时,O2是影响氮矿化速率的重要限制性因子, 一般认为好氧条件下氮矿化速率高于缺氧或厌氧条件.因此, 第4 d后的实验阶段, 空白组与1倍组受到有机质含量的影响, 氮素浓度基本不变.而20倍组处于缺氧或厌氧状态, 导致有机质厌氧矿化分解速率减缓, 也可能受pH升高条件限制, 微生物活性降低, 造成氨氮(NH4+-N)释放速率降低.但由于加藻量较多, 藻屑分解导致DTN、NH4+-N浓度不断增加.且可能由于厌氧条件下微生物对氮的需求量较少, 导致厌氧条件下DIN释放形态仍以NH4+-N为主(图 7).
沉积物既是磷“汇”, 也是磷“源”, 对湖泊生态系统有重要的调控功能.沉积物磷素形态释放以PO43--P为主, 其中, PO43--P的释放特点主要依赖于Fe-P的解析与结合.本实验中20倍组藻屑输入至沉积物中与上覆水PO43--P与DTP释放量具有显著相关性(p < 0.05), 空白组与1倍组PO43--P与DTP释放均低于20倍组且较为稳定(图 6), 说明藻屑在沉积物中降解释放大量PO43--P与DTP.20倍组以第4 d为界限明显出现好氧、缺氧、厌氧环境条件之间的转换(图 1a), 理论而言, 厌氧条件下沉积物对PO43--P表现为释放, 而好氧条件下则表现为吸附.Hansen等研究发现, 在绿藻衰亡过程中上覆水中P的释放量与时间成正比, 在第8 d达到最高, 之后降低, 与本实验结果有相似之处.本实验中第4 d PO43--P浓度达到最高(图 6a), 之后PO43--P释放速率明显降低(图 7).由于PO43--P释放对沉积物氧化还原环境具有高度敏感性, 与以往文献结论相反, 在实验第4 d后PO43--P浓度降低, 可能与胶体及颗粒物吸附与浓度梯度扩散相关.
沉积物中NH4+-N、PO43--P等的氮、磷释放主要与温度、DO、Eh、pH及生物扰动相关, 因此, 排除温度、生物扰动等因素干扰, 在其他条件一致的情况下, 不同质量藻屑输入沉积物中主要通过改变沉积物界面DO、pH、Eh, 以及影响微生物活性造成各培养组氮、磷释放差异.因此, 20倍组藻屑输入至沉积物造成上覆水长期处于厌氧还原状态也是合理的现象, 使得底泥有机质厌氧矿化作用增强, 形成较强的氮、磷营养盐释放潜力.
5 结论
1) 实验表明, 120 g·m-2(即20倍组)藻屑密度堆积在沉积物中可造成水体DO迅速下降并长期处于缺氧甚至厌氧还原环境.紫外可见光谱特征值表明,在藻屑有机质降解过程中, 有机质腐殖化程度明显增加, 取代基种类减少.同时, 平行因子法分析三维荧光组分表明, 20倍组上覆水DOM各组分荧光强度高于空白组, 藻屑降解明显释放DOM至上覆水中, 初期释放的DOM主要为类色氨酸物质, 随后类色氨酸物质逐渐被降解, 类腐殖质荧光强度增加即含量增加, 占据DOM主要比例.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
2) 20倍组NH4+-N、PO43--P释放量最高, 1倍组与空白组水体中NH4+-N、PO43--P浓度无显著性差异.其中, 20倍组NH4+-N及PO43--P为DIN与DTP的主要释放形式, 而1倍组与空白组NO3--N则为DIN的主要释放形式.1倍组与20倍组藻屑浓度分别代表常态和严重蓝藻水华时的藻屑堆积浓度, 结果表明, 常态藻屑积累量并未对沉积物中氮、磷释放造成显著影响, 而藻屑积累量达到严重水华暴发的蓝藻密度时, 将显著改变沉积物生物理化性状, 使得沉积物形成强大的DOM及氮、磷释放潜力, 导致沉积物成为污染物的“源”, 需引起足够重视.