国内外炼锌的主要方式是湿法炼锌,采用焙烧-浸出-电积工艺生产锌。由于炼锌原料锌精矿或者锌二次资源都含有大量的S、Cl等元素,使得在焙烧工艺中产生含氯的二氧化硫烟气,在“淋洗净化”烟气制酸过程中,氯化物特别容易被水和酸吸收,因此产生了大量含氯的高酸废水。若未加处理直接回用,水中Cl-会对生产设备造成严重腐蚀。此外,高浓度含氯废水若排入江河,会使水质恶化,甚至污染饮用水源,对人体健康造成威胁。近年来,由于矿石中氯含量不断提高,使得硫酸废水中的氯含量也越来越高,含氯硫酸废水的处理迫在眉睫。
目前,国内外所用去除工业废水氯离子的方法主要有沉淀法、离子交换法、膜分离技术、电吸附、电解法、电渗析和反渗透,但是这些方法对于高浓度含氯废水的处理,普遍存在去除效率低、成本高、能耗高、操作方式复杂、出水难以达到环保要求等缺点。现行常用的石灰铝盐沉淀法具有成本低、去除效率高优点,但其主要缺点是产生大量化学污泥成为固体废弃物,在固体废弃物监管日益严格的情况下,该方法的使用受到了限制。因此寻找一种价格低廉、无二次污染、高效去除酸性冶炼废水中Cl-的方法具有重要意义。笔者研制了一种Hg2+改性壳聚糖(HgCTS)高效氯离子吸附剂,研究了其对Cl-的吸附机理,并探讨了吸附剂投加量、溶液初始pH、吸附时间对吸附剂除Cl-性能的影响。
1、实验部分
1.1 试剂与仪器
实际硫酸废水选取广西某冶炼厂硫酸废水(Cl1050mg/L、SO42-18400mg/L、F255mg/L、Fe3+1140mg/L、Zn2+82400mg/L、pH=3.3)。壳聚糖(CTR)(脱乙酰度≥90.0%)、硫酸汞、浓硫酸、柠檬酸、丁二酸、氯化钾、硝酸钾、氢氧化钠、冰乙酸、戊二醛(体积分数为2.5%)。总离子强度调节剂(自配):称取88g硝酸钾和量取100mL冰乙酸溶于烧杯中,用10g/L氢氧化钠调节pH至5~5.5,定容于1000mL容量瓶中。
SHZ-82A气浴恒温振荡器, DF-101S集热式恒温加热磁力搅拌器, PXSJ-216离子计、217-01参比电极、PCl-1-01氯离子电极, FA-1604电子天平, FE20-FivepH计, DZF-6020真空干燥箱, Nexus傅立叶变换红外光谱仪, D8AdvanceX射线衍射仪, Kratos Axis Ultra DLD多功能电子能谱仪;JSM5610LV型扫描电子显微镜。
1.2 吸附剂的制备
取柠檬酸0.25g、丁二酸0.15g、硫酸汞0.4g于50mL去离子水中,再加入0.1mL浓硫酸将硫酸汞溶解制得汞配位溶液A;称取2g壳聚糖溶于100mL体积分数为2%的冰乙酸溶液,搅拌5h,直至壳聚糖溶液完全无气泡,得到壳聚糖乙酸溶液B。将以上A和B两份溶液混合后搅拌2h,将得到的凝胶用去离子水反复洗涤,抽滤后,再置于体积分数为2.5%戊二醛中交联30min,洗涤、过滤,60℃下烘干研磨,制得不溶于水改性的壳聚糖(Hg-CTS)吸附剂。
1.3 实验方法
吸附实验:在150mL的锥形瓶中加入吸附剂和Cl溶液,在一定的Hg-CTS投加量、溶液初始pH、Cl-初始浓度和吸附时间等实验条件下,以150r/min在气浴恒温震荡摇床中震荡一定时间后,取上清液用离子计测定电位值并通过标准曲线计算出残余Cl浓度。计算Cl的去除率和吸附量。
1.4 分析方法
Cl-的测定采用直接电位法,量取反应后的上清液5mL于50mL容量瓶中,加入20mL缓冲溶液后定容,用离子计测定其电位值,然后由氯离子浓度的对数与电位值的校准曲线计算出废水中Cl含量。
2、结果与讨论
2.1 物化特性及微观结构表征
2.1.1 FI-TR分析CTS、Hg-CTS和Hg-CTS吸附Cl-的FI-TR见图1。
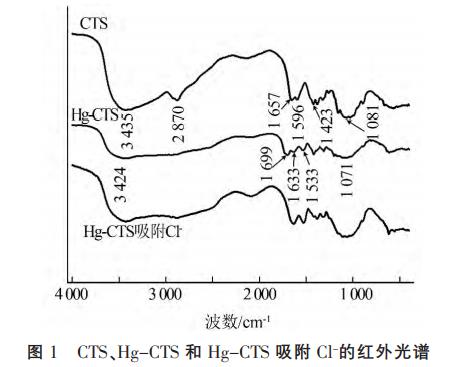
图1可知,CTS主要吸收带有:3435cm-1(—OH和—NH2的伸缩振动)、2870cm-1(—CH和—CH2的伸缩振动)、1657cm-1(—NH2的弯曲振动)、1081cm-1(C—O的伸缩振动)。Hg-CTS中,壳聚糖表面的吸收带基团特征峰发生了显著变化,特征峰3435、1657(Ⅰ型酰胺)、1596(Ⅱ型酰胺)、1423(Ⅲ型酰胺)cm-1分别移至3424、1699、1633、1533cm-1,且CTS位于2870cm-1处的—C—H伸缩振动吸收峰有所减弱,这可能是由于壳聚糖的游离氨基(—NH2)或游离氨基和二级羟基(C3—OH)与Hg(Ⅱ)的螯合作用引起的,这和X.Wang等研究的改性壳聚糖吸附Hg(Ⅱ)后峰值变化相符合。对比CTS,Hg-CTS吸附剂制备成功,对比Hg-CTS和Hg-CTS吸附Cl后的光谱图,发现吸附剂吸附Cl前后的吸收带基团特征峰未发生明显变化,说明了吸附剂结构比较稳定。
2.1.2 XRD分析
壳聚糖XRD谱图显示其有两种不同的晶体形态,均属于单斜晶系,在2θ分别为10.55°、19.94°处。在汞配位化合物改性壳聚糖后,壳聚糖在10.55°、19.94°处的衍射峰消失了,显示Hg-CTS是无定型相,这是由于其处于单层分散状态。许多盐类或氧化物具有分散到载体表面形成单层和亚单层的倾向,即当负载物的量低于某一阈值时,呈单层分散状态,高于此阈值时出现晶相,X射线检测不出活性组分可认为处于单层分散状态。
2.1.3 XPS分析
为进一步研究Hg-CTS吸附剂除氯机理,CTS和Hg-CTS吸附氯前后的吸附剂被用于XPS分析。扫描能谱全谱图显示CTS包含氧、氮、碳元素(O1s、N1s、C1s),而吸附剂Hg-CTS能谱全谱图除氧、氮、碳元素外,出现了S2p和Hg4f峰,证明壳聚糖被成功改性为载汞吸附剂了。Hg-CTS吸附Cl后能谱全谱图出现Cl2p峰,证明Cl被吸附于吸附剂表面。
为探讨CTS和Hg-CTS吸附Cl前后的吸附剂各个元素的变化,进行了XPS的O1s、N1s、C1s、S2p、Cl2p和Hg4f能谱分析。结果表明,CTS的O1s光谱的结合能532.58eV为其表面的—OH、—C—O或结合水,改性前后基本没有发生变化,但吸附Cl后其强度变小。CTS的N1s光谱的结合能399.4eV为其表面上NH2基团中的N,但Hg-CTS在高结合能出现一个明显的新能峰,其结合能为400.2eV,其对应的是质子化的氮原子(N+),说明改性壳聚糖过程中加入的酸使得部分氨基质子化了,但吸附剂吸附Cl后其质子化的氮原子减少,可能是质子化的壳聚糖带正电,其表面的部分电荷与溶液中带负电的SO42-和Cl发生了电中和。CTS的C1s图谱峰值对应的结合能284.6、286.2、288.34eV分别属于基团C—C/C—H、C—O/C—N+、C=O/O—C—O。CTS的N和C—N的结合能在Hg(Ⅱ)改性后,由399.4、286.2eV移动到399.83、296.53eV,说明—NH2参与了Hg(Ⅱ)的吸附过程。Hg-CTS吸附Cl前后S2p光谱的结合能基本没有变化,强度变小。CTS-Hg与CTS能谱图对比,出现Hg4f峰,说明CTS在改性后成功络合上了Hg(Ⅱ)。CTS-Hg吸附Cl前后的能谱图对比发现Cl2p峰,说明CTS-Hg吸附了Cl-,主要是由于Hg(Ⅱ)与Cl-络合作用形成了HgCl42-,由于发生了化学反应,在吸附剂上形成了较稳定的氯汞化合物。
2.1.4 SEM分析
CTS、Hg-CTS和Hg-CTS吸附Cl-后10000倍的SEM见图2。
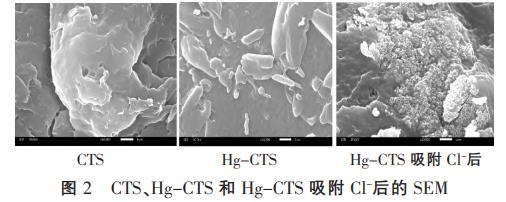
由图2可知,CTS为非孔材料,呈现出平坦的层状结构,表面光洁无空洞出现;Hg-CTS表面出现块状结构,且表面紧实、凹凸不平;Hg-CTS表面在吸附Cl-后变得非常粗糙,结合XPS表征分析,推测粗糙面可能为吸附剂表面的氯聚集体。
2.2 Hg-CTS投加量对Hg-CTS吸附Cl的影响
在20℃,Hg-CTS投加量为0.1~1.0g条件下,分别与100mL1000mg/L的Cl于摇床振荡30min。考察不同Hg-CTS投加量对Cl吸附的影响,结果见图3。
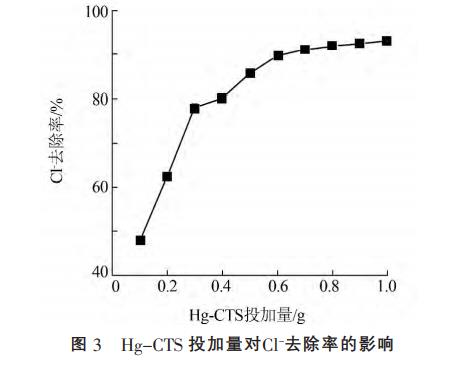
由图3可知,随着Hg-CTS投加量增加,Cl去除率逐渐增大,0.8g后继续增大投加量,Cl去除率变化不大。这是由于在Cl初始浓度一定情况下,随着HgCST投加量的增加,Hg-CST上活性位点的可用性随着投加量增大而增大,去除率也随着增加。投加量达0.8g后Cl去除率趋于平衡,这是由于过多的吸附剂使吸附剂颗粒之间相互聚合,阻碍了吸附剂对Cl的吸附作用。当吸附剂投加量为8.0g/L时,Cl-去除率为91.91%,出水Cl质量浓度为80.9mg/L,远低于《工业用水水质》(GB/T19923—2005)回用标准限值250mg/L,综合考虑成本和去除效果,最佳投加量取8.0g/L。
2.3 溶液初始pH对Hg-CTS吸附Cl的影响
在20℃,调节10组100mL1000mg/L的Cl溶液在不同初始pH条件下,含氯溶液与0.8g的HgCTS混合振荡60min。结果表明随着溶液pH升高,Hg-CTS对Cl的去除率先升高后下降。溶液的初始pH在1~10,吸附剂对Cl的去除率均大于85.07%,Cl出水浓度均能达到回用标准。当pH为3时,Cl去除率达到最大95.12%;当pH>3时,Cl的去除率略有所下降。由此可以看出吸附剂Hg-CTS具有较宽的pH适应范围。
2.4反应时间对Hg-CTS吸附Cl的影响
在20℃下,8.0g/LHg-CTS与不同初始浓度的Cl-溶液混合,振荡一定时间。考察反应时间对HgCTS吸附Cl的影响,结果见图4。
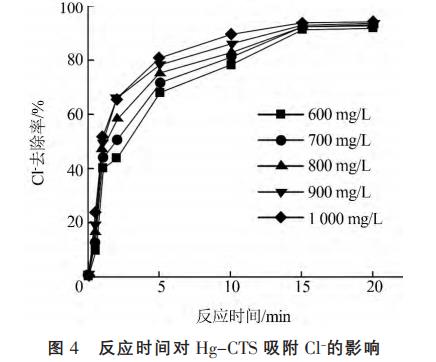
由图4可知,Hg-CTS对Cl吸附速率很快,与初始质量浓度1000mg/L的Cl反应在20min内达到吸附平衡,Cl去除率达到94%,这是由于Hg-CTS对Cl有较强的富集能力,使得在短时间内达到吸附平衡。在前15min内,吸附速率非常快,此后,随着吸附时间的延长,Hg-CTS对Cl的去除率变化不明显,且未出现解吸附的现象,因此反应时间取20min为最佳。
2.5 吸附动力学分析
在吸附时间0~25min范围内,用拟一级动力学方程和拟二级动力学方程对图2中的数据进行拟合。表达式见式(1)、式(2)。
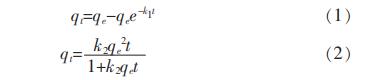
式中:
qt———t时刻的吸附量,mg/g;
qe——吸附平衡时的吸附量,mg/g;
k1——拟一级动力学方程吸附速率常数,min-1;
k2——拟二级动力学方程吸附速率常数,g/(mg·min)。
动力学方程非线性拟合结果见图5。
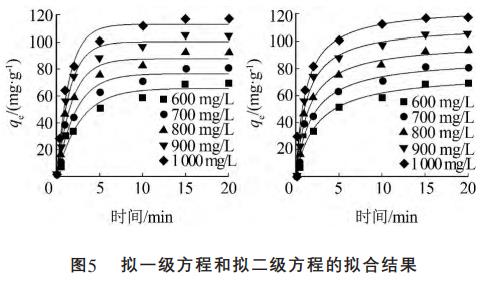
式(1)和式(2)对图2中的数据进行拟合得到的动力学相关参数见表1。
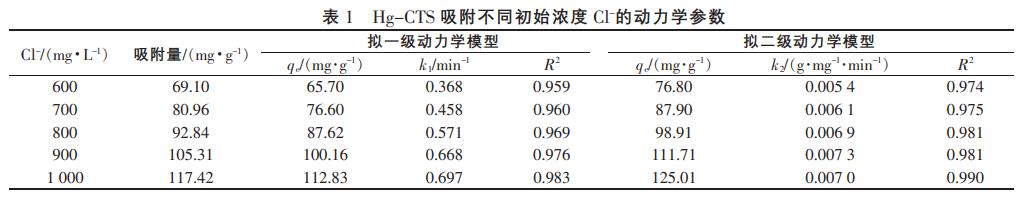
由图5、表1可知,拟合曲线和R2表明,两个模型都能较好地描述Hg-CTS对Cl的吸附过程。对比拟合结果还发现,拟二级动力学模型比拟一级动力学模型更适合用于阐释Hg-CTS对Cl的吸附过程。拟二级动力学模型是以化学吸附为基础的,因此吸附过程中可能发生了化学反应。根据拟二级动力学方程可以求出Cl-在Hg-CTS吸附剂上的吸附速率常数,当Cl初始质量浓度为1000mg/L时,吸附量达到117.42mg/g。其吸附量大于常用树脂、水滑石的吸附量。
2.6 共存离子对处理实际废水的影响
为了尝试所制备的吸附剂对实际硫酸废水的处理效果及共存离子SO42-对吸附的影响,选取了广西某冶炼厂的硫酸废水和投加Na2SO4增大废水SO42-浓度进行了除氯实验。在20℃下,8.0g/LHg-CTS与两份Cl-质量浓度为1050mg/L的硫酸废水反应,其中废水的ρ(SO42-)=1.84g/L,竞争实验废水投加Na2SO4后溶液中ρ(SO42-)=3.38g/L。一段时间后取上清液测定Cl-含量,60min前Hg-CTS对硫酸废水中Cl吸附速率较快,60min时Cl-去除率达到79.65%,随着反应时间的增加,吸附速率逐渐变缓慢,在120min时达到吸附平衡,Cl去除率达到90.39%,废水中残留Cl-为100.91mg/L,低于《工业用水水质》(GB/T19923—2005)回用标准限值250mg/L。同时竞争实验结果表明,SO42-对Hg-CTS吸附氯离子基本没影响,Hg-CTS的吸附具有很好的离子选择性。
3、结论
(1)通过将硫酸汞与两种有机酸形成的配位化合物与壳聚糖氨基反应后,制备出高效Hg-CTS吸附剂,在Cl-初始质量浓度为1000mg/L,投加量8.0g/L,时间20min,pH为3条件下,Cl-的去除率达到94%,吸附量为117.42mg/g。同时,Hg-CTS吸附剂对Cl-吸附动力学符合拟二级动力学模型。
(2)该吸附剂对Cl-表现出良好的吸附性能,对广西某冶炼厂硫酸废水中Cl-去除率达到90%以上,Cl-残留浓度低于《工业用水水质》(GB/T19923—2005)回用标准限值250mg/L。
(3)从吸附剂表征结果发现,Cl-的去除主要是靠吸附剂上Hg2+对Cl-的富集来实现。(来源:广西华锡集团股份有限公司,东华理工大学水资源与环境工程学院)


