电镀、不锈钢制造等工业废水的排放是Cr(Ⅵ)的主要来源之一。Cr(Ⅵ)毒性大、溶解性好、迁移性强,且重金属污染物与其他污染物不同,在水体中难以被降解消除。水体中的Cr(Ⅵ)可通过地表径流和生物富集的方式进行扩散,进入人体后有致癌、致畸、致突变风险,长期暴露在Cr(Ⅵ)污染环境中将对人体健康产生严重威胁。
施氏矿物是在富含Fe2+、SO42-等离子的酸性矿山废水中发现的一种次生羟基铁矿物,因其具有较高的比表面积及富含·OH、SO42-等优点,被广泛应用于水体中Cr(Ⅵ)的去除。但生物合成法制备施氏矿物过程长、步骤复杂,因此难以大规模应用,过氧化氢快速氧化法合成的施氏矿物比表面积小、微孔结构不明显;同时施氏矿物结晶度差,矿物相易随外界酸碱环境变化而发生转变,造成吸附的重金属离子二次释放。基于此,笔者在施氏矿物中嵌入CaSiO3合成了一种类施氏矿物,合成过程中可同步去除工业废水中的Cr(Ⅵ),并考察反应物浓度、共存离子浓度等因素对类施氏矿物除Cr(Ⅵ)的影响,旨在为处理含Cr(Ⅵ)工业废水提供借鉴和参考。
1、材料与方法
1.1 类施氏矿物除Cr(Ⅵ)影响因素试验
称取0.283g的K2Cr2O7于烧杯中,加入适量去离子水,用玻璃棒搅拌至固体完全溶解,转移至1L容量瓶中定容至标线,得到浓度为100mg/L的Cr(Ⅵ)模拟废水。通过单因素试验,探究反应物投加量、温度、pH、共存离子浓度、络合剂浓度对类施氏矿物去除Cr(Ⅵ)的影响。取250mL含Cr(Ⅵ)模拟废水于500mL锥形瓶中,按表1配比加入FeSO4·7H2O、H2O2、Na2SiO3、CaCl2,置于恒温水浴振荡器中,保持转速为150r/min进行10min摇瓶试验,以确定最佳反应物投加量。
采用最佳反应物投加量,分别在15、20、25、30、35℃条件下进行10min摇瓶试验(转速为150r/min),确定最佳反应温度。将模拟废水初始pH分别设定为2.0、3.5、5.0、6.5、7.5后,在最佳温度下进行摇瓶试验,其他条件与上述试验一致。调节模拟废水pH至最佳,按照物质的量之比为1∶2∶1加入NaCl、MgCl2、KCl,配制共存离子(Na+、Mg2+、K+)浓度分别为20、40、60、80、100mmol/L的模拟废水,在最佳反应物投加量、最佳温度下进行摇瓶试验,其他条件同上,分析共存离子浓度对类施氏矿物去除Cr(Ⅵ)的影响。在配水中加入EDTA-2Na,配制络合剂浓度分别为0.5、1、2、4、8mmol/L的模拟配水,在最佳反应物投加量、最佳温度、最佳初始pH下进行摇瓶试验,其他条件同上,分析络合剂浓度对去除Cr(Ⅵ)的影响。
各单因素试验均在反应后1、2、4、6、8、10min取样,过0.45μm滤膜,取上清液测定pH、总Fe、SO42-、Ca2+、SiO32-和Cr(Ⅵ)的浓度。
1.2 矿物的制备
在250mL去离子水中加入5.56g/L的FeSO4·7H2O、3mL的H2O(230%),保持28℃、150r/min的条件,并在恒温水浴振荡器中进行24h的合成试验。向含Cr(Ⅵ)的废水中投加施氏矿物粉末,以同样的方法合成含Cr(Ⅵ)的施氏矿物。
分别取250mL去离子水和模拟废水于500mL锥形瓶中,采用最佳投量加入FeSO4·7H2O、H2O2、Na2SiO3、CaCl2,其他条件同上。反应后1、2、4、6、8、10min取样过滤,得到不同时段合成的类施氏矿物和含Cr(Ⅵ)类施氏矿物固体。
上述合成的固体矿物样品均采用抽滤分离,滤渣置于烘箱内(65℃)烘至恒质量,经研磨过筛后备用,采用相关设备对其结构进行表征。
1.3 类施氏矿物和施氏矿物去除Cr(Ⅵ)的效能
取1L含Cr(Ⅵ)模拟废水于烧杯中,在最佳反应条件下加入11.12g的FeSO4·7H2O、6.66g的H2O2、8.53g的Na2SiO3、4.44g的CaCl2,保持650r/min的转速于磁力搅拌器上进行去除Cr(Ⅵ)的试验,在1、2、4、6、8、10min取样过滤,测试上清液中Cr(Ⅵ)浓度。保持相同的试验条件,在含Cr(Ⅵ)模拟废水中加入1g施氏矿物进行12h的吸附试验,每隔1h取样测定Cr(Ⅵ)浓度,对比类施氏矿物和施氏矿物去除Cr(Ⅵ)的效能。
在1L聚乙烯广口瓶中加入1L去离子水,向其中分别加入1g含Cr(Ⅵ)的类施氏矿物和含Cr(Ⅵ)的施氏矿物,常温静置,定期取样测定上清液中Cr(Ⅵ)浓度,观察40d内Cr(Ⅵ)的溶出情况。
1.4 检测项目及方法
SO42-采用铬酸钡分光光度法测定;总Fe采用邻菲啰啉分光光度法测定;Cr(Ⅵ)采用火焰原子吸收法测定;Ca2+采用原子吸收分光光度法测定;SiO32-采用钼硅黄分光光度法测定;比表面积采用激光粒度分析仪测定;施氏矿物和类施氏矿物采用场发射扫描电子显微镜(SEM)、X射线粉末衍射仪(XRD)、红外光谱仪(FT-IR)进行表征。
2、结果与讨论
2.1 反应物浓度对类施氏矿物去除Cr(Ⅵ)的影响
不同反应物浓度下pH的变化如图1所示。
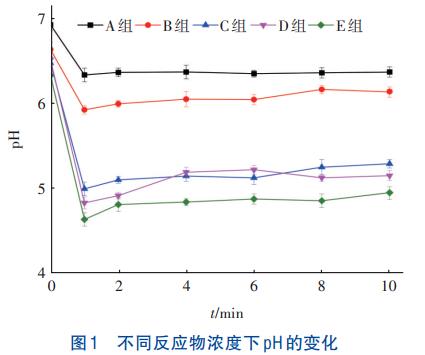
由图1可知,pH在反应开始1min内急剧下降至最低值。分析原因,反应开始后,溶液中的Fe3+与SO42-反应合成了类施氏矿物,并产生了大量H+,见式(1),引起pH急剧下降;之后pH趋于稳定,可能是由于SiO32-发生水解反应中和H+所致。
在反应物初始浓度由11.54g/L增至30.75g/L条件下,pH降幅由7.68%~8.52%增加至21.80%~26.78%。分析是由于随着初始反应物浓度的增加,单位体积内Fe3+与SO42-含量增加,有效促进了类施氏矿物的合成,增加了H+产量。
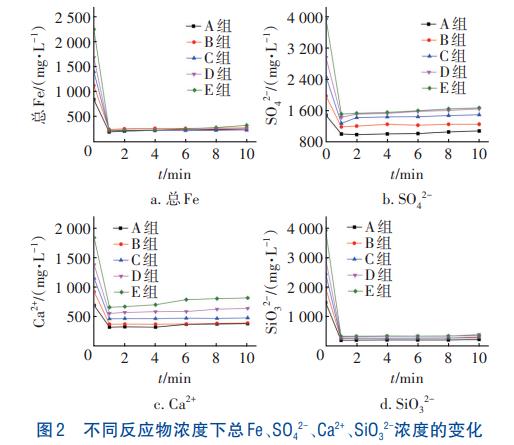
不同反应物浓度下总Fe、SO42-、Ca2+、SiO32-浓度的变化如图2所示。可知,溶液中的总Fe、SO42-、Ca2+、SiO32-浓度均在反应开始1min内迅速下降,FeSO4·7H2O在H2O2的催化下快速产生了Fe3+,Fe3+在短时间内与SO42-、Cr(Ⅵ)反应形成含铬矿物沉淀;同时,SiO32-与Ca2+碰撞形成CaSiO3嵌合在矿物中。因此,各离子浓度均急剧下降,之后浓度趋于平稳是由于合成类施氏矿物反应逐渐达到平衡。
反应物浓度对去除Cr(Ⅵ)的影响如图3所示。可知,Cr(Ⅵ)浓度在反应开始1min内由100mg/L急剧下降至0.85~6.34mg/L,绝大部分Cr(Ⅵ)被去除,之后Cr(Ⅵ)浓度呈上升趋势。结合上述分析可知,类施氏矿物在合成过程中会产生大量H+,酸性环境导致类施氏矿物孔道溶解或结构发生改变,因此Cr(Ⅵ)重新溶出。
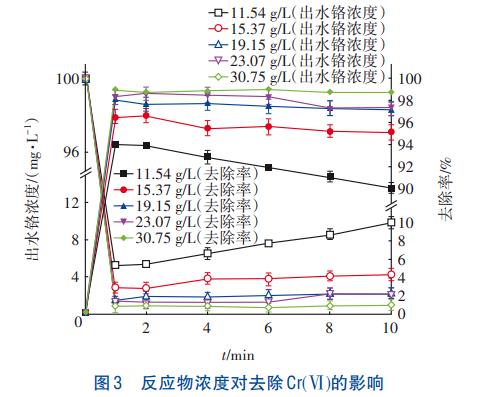
当反应物初始浓度由11.54g/L增至30.75g/L时,Cr(Ⅵ)去除率由89.12%~94.66%增至98.99%~99.15%。这是由于初始反应物浓度增加后,Cr(Ⅵ)周围的Fe3+与SO42-浓度增大,Cr(Ⅵ)与矿物接触的几率增大,去除效果增强;同时单位体积内Ca2+、SiO32-的活化分子数量增多,促进了Ca2+与SiO32-的有效碰撞,加速了CaSiO3与Cr(Ⅵ)的共沉淀。
2.2 温度对类施氏矿物去除Cr(Ⅵ)的影响
温度对去除Cr(Ⅵ)的影响表明,反应开始1min内,Cr(Ⅵ)浓度由100mg/L下降至1.68~3.14mg/L,不同温度条件下Cr(Ⅵ)均基本被去除,之后缓慢上升。在温度为15~35℃的条件下,Cr(Ⅵ)去除率由94.76%~96.86%增至97.74%~98.32%,温度对去除Cr(Ⅵ)的影响微弱。这是由于Cr(Ⅵ)与类施氏矿物结合的化学键相对稳定,当反应物浓度相同时,合成的类施氏矿物量差距较小。
2.3 pH对类施氏矿物去除Cr(Ⅵ)的影响
初始pH不仅会影响矿物表面的带电性和质子化程度,还会影响Cr(Ⅵ)在溶液中的存在形态。当初始pH为2.0~7.5时,反应开始1min后,Cr(Ⅵ)浓度迅速下降至0.44~7.16mg/L,之后回升至0.72~10.27mg/L。当系统初始pH由2.0增加至7.5时,Cr(Ⅵ)去除率由99.28%~99.56%降至89.73%~92.84%。初始pH升高以后,类施氏矿物表面的带电基团由正电荷向负电荷转变,从而对含氧阴离子Cr(Ⅵ)产生静电斥力,影响了其与类施氏矿物的结合;pH的变化影响了Cr(Ⅵ)在溶液中的存在形态,见式(2)。HCrO4-、Cr2O72-、CrO42-在pH为3~8时共存,当溶液pH升高后,H2CrO4和HCrO4-发生电解反应转变为Cr2O72-和CrO42-,而临界基团≡Fe—O—对HCrO4-的亲和力最高,吸附量最大;同时,pH升高会促进Fe3+和OH-生成Fe(OH)3,并覆盖在类施氏矿物表面,抑制·OH产生,影响Cr(Ⅵ)的去除。
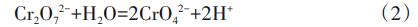
2.4 共存离子对类施氏矿物去除Cr(Ⅵ)的影响
Na+、K+等共存离子普遍存在于水体中,共存离子浓度增加会加速次生铁矿的形成,且Na+、K+离子半径与Fe3+、SO42-相似,反应过程中可能会占据矿物的吸附点位,影响对Cr(Ⅵ)的去除。共存离子浓度对类施氏矿物去除Cr(Ⅵ)的影响表明,Cr(Ⅵ)浓度在反应开始1min内下降至3.73~68.65mg/L,之后趋于平稳。当共存离子浓度为20~80mmol/L时,对Cr(Ⅵ)的去除率由95.16%~96.27%降至90.01%~90.36%;当共存离子浓度继续增至100mmol/L时,对Cr(Ⅵ)的去除率降至30.65%~31.35%,共存离子浓度增大对类施氏矿物去除Cr(Ⅵ)存在抑制作用,且在80~100mmol/L区间更为显著。推测原因是:一方面共存阳离子会与Fe3+形成竞争关系,影响类施氏矿物与Cr(Ⅵ)的结合,从而降低去除Cr(Ⅵ)的能力;另一方面共存离子增大到一定浓度时会加速Na+、K+与SO42-反应生成黄铁矾矿,见式(3),抑制类施氏矿物的合成。
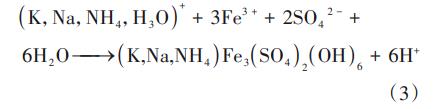
2.5 络合剂对类施氏矿物去除Cr(Ⅵ)的影响
工业生产需投加一定量的络合剂以满足生产需求,络合剂的分散、悬浮作用可能会影响矿物去除工业废水中的重金属。络合剂浓度对类施氏矿物去除Cr(Ⅵ)的影响表明,Cr(Ⅵ)浓度在反应开始1min内迅速下降至2.48~24.69mg/L,之后趋于平稳。当络合剂浓度由0.5mmol/L增至8.0mmol/L时,对Cr(Ⅵ)的去除率由97.52%~97.86%降至75.22%~75.33%。推测溶液中络合剂EDTA-2Na与Fe3+、Ca2+发生络合反应,影响类施氏矿物的合成,导致去除能力降低。
2.6 类施氏矿物去除Cr(Ⅵ)机理分析
2.6.1 矿物微观结构分析
施氏矿物的SEM照片如图4所示。可见,施氏矿物表面由光滑球形颗粒组成,直径约为2.48~3.39μm,表面有一些突起,这与Xie等人的研究结果一致。相比于施氏矿物,含Cr(Ⅵ)的施氏矿物结构形态并未发生改变,这是因为Cr(Ⅵ)在施氏矿物上的结合机理主要包括静电吸附、与表面·OH的络合作用,以及与SO42-的交换作用,致使溶液中的Cr(Ⅵ)吸附在施氏矿物表面,故没有影响施氏矿物的球形颗粒状形态。

反应过程中类施氏矿物的SEM照片见图5。可见,反应开始后1~4min内,矿物表面被大量细小的球状颗粒覆盖;6min之后,矿物表面开始出现长度为0.83~1.63μm、宽度为0.55~1.0μm的不规则块状矿物,可能是在合成过程中添加的Na2SiO3、CaCl2生成大量CaSiO3嵌合在类施氏矿物中所致。反应8min时,矿物表面的结晶颗粒密度增大,球状特征不再清晰,且之后矿物稳定,推测类施氏矿物是在反应开始后的6~8min内合成的。

含Cr(Ⅵ)类施氏矿物的SEM照片见图6。含Cr(Ⅵ)类施氏矿物表面为不规则的多边形块状颗粒,表面光滑,且在反应1~10min内表观结构基本未发生明显变化,说明类施氏矿物能在1min之内快速去除Cr(Ⅵ),与上述分析结果一致。结合图5的结果推断,类施氏矿物是在合成过程中去除Cr(Ⅵ)的。

另外发现,含Cr(Ⅵ)类施氏矿物的长和宽较类施氏矿物分别多出0.24~0.60、0.21~0.33μm。分析原因:①类施氏矿物中的CaSiO3通过网捕作用将Cr(Ⅵ)离子固定在矿物的晶格中,同时溶液中的Cr(Ⅵ)与类施氏矿物发生共沉淀反应,Cr(Ⅵ)充实了矿物的晶体结构,导致类施氏矿物表观发生明显改变;②Cr(Ⅵ)与SO42-的离子半径相当,所以类施氏矿物表面和隧道内部的SO42-很容易被含Cr(Ⅵ)阴离子取代,见式(4),溶液中的Cr(Ⅵ)被吸附在类施氏矿物表面,致使其本来具有的球状颗粒不被观察到。
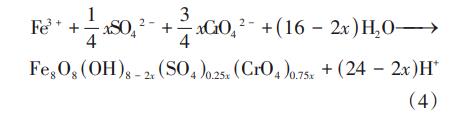
相对于施氏矿物,类施氏矿物棍棒状和细小的球状颗粒表面为重金属提供了更多的吸附点位,所以对Cr(Ⅵ)的去除水平远远优于施氏矿物。分析表明,类施氏矿物的比表面积为322.85m2/g,较施氏矿物的13.70m2/g增大了约23倍,也验证了这一点。
2.6.2 矿物XRD分析
类施氏矿物和施氏矿物的XRD图谱见图7。可知,施氏矿物衍射峰为22.65°、35.42°、47.37°、55.23°、61.45°,与标准施氏矿物(JCPDS47-1775)一致。含Cr(Ⅵ)施氏矿物较施氏矿物峰值略有增加,说明吸附Cr(Ⅵ)后矿物的结晶度上升。二者的XRD图谱均呈现较多毛刺,说明晶体结晶度差或是无定形矿物。

类施氏矿物的XRD图谱在20.83°、27.31°、35.10°、41.13°、51.88°处出现与施氏矿物相近的衍射峰,说明类施氏矿物部分晶体结构与施氏矿物相似。35.10°、51.88°处的衍射峰出现偏移,且衍射峰较窄,与矿物中CaSiO3的嵌入导致矿物晶相出现一定程度的变化有关。嵌合的CaSiO3可以提高矿物的稳定性,为溶液中的Cr(Ⅵ)提供了更多的吸附点位,提高了类施氏矿物对Cr(Ⅵ)的去除效果。此外,类施氏矿物在11.52°、29.51°处出现了CaSiO3的衍射峰,表明类施氏矿物是在合成施氏矿物的基础上嵌合硅酸钙生成的一种新型矿物。含Cr(Ⅵ)类施氏矿物衍射峰相对于类施氏矿物没有出现新的峰位。Cr(Ⅵ)是通过离子交换、静电吸附等方式与类施氏矿物表面的SO42-络合,因此不影响矿物的隧道结构和晶型。但是含Cr(Ⅵ)类施氏矿物在27.31°、41.13°处的衍射峰比类施氏矿物分别高出96、127cps,这是由于Cr(Ⅵ)通过共沉淀作用进入类施氏矿物晶格中,增强了矿物的结晶度所致。
2.6.3 矿物FT-IR分析
矿物的红外光谱如图8所示。可以看出,含Cr(Ⅵ)施氏矿物、含Cr(Ⅵ)类施氏矿物的SO42-吸收峰透过率分别比施氏矿物、类施氏矿物增加了17.17%、32.02%。Cr(Ⅵ)的离子半径与SO42-相近,吸附过程中其与施氏矿物表面的SO42-发生离子交换或表面络合反应,从而导致施氏矿物中的SO42-减少。
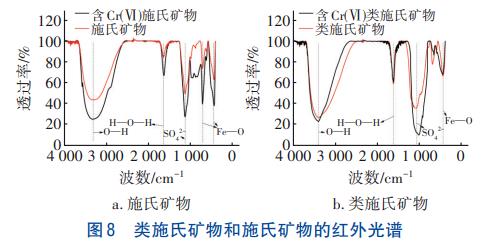
含Cr(Ⅵ)类施氏矿物的O—H吸收峰透过率较类施氏矿物增加了4.29%,表明类施氏矿物结合Cr(Ⅵ)后基团含量减少。推测原因是类施氏矿物表面的羟基基团与重金属离子进行配位络合,促使重金属离子进入矿物双电层的sterm层,通过形成的内层络合物去除Cr(Ⅵ),由此导致O—H含量减少。含Cr(Ⅵ)类施氏矿物的SO42-吸收峰透过率比类施氏矿物增加了25.30%,这是SO42-与溶液中的Cr(Ⅵ)在合成矿物时发生离子交换和共沉淀作用所致。类施氏矿物的O—H特征峰和SO42-吸收峰均呈明显的沟壑状,透过率较施氏矿物分别降低了5.71%、29.95%,表明类施氏矿物含有更多的羟基和硫酸根基团,因此对Cr(Ⅵ)的去除能力增强。
2.7 类施氏矿物和施氏矿物去除效能对比
保持温度为35℃、pH为2.0、共存离子浓度为20mmol/L、络合剂浓度为0.5mmol/L,试验结果表明,类施氏矿物溶液中Cr(Ⅵ)在1min内由100mg/L降至最低值,去除率为97.7%,之后趋于稳定。施氏矿物在反应12h后达到最大去除率47.98%,较类施氏矿物下降49.72%。施氏矿物合成及处理时间较长,而类施氏矿物可以在1min内将Cr(Ⅵ)基本去除,且去除效能显著优于施氏矿物。
2.8 类施氏矿物和施氏矿物的稳定性
类施氏矿物溶液中的Cr(Ⅵ)浓度在1d时上升至0.37mg/L,之后趋于稳定,Cr(Ⅵ)的溶出率为1.16%,表明类施氏矿物能高效固定Cr(Ⅵ)。推测原因:①类施氏矿物通过CaSiO3的网捕作用将Cr(Ⅵ)稳定地固定在矿物固相中,不易发生后沉淀现象;②通过共沉淀作用去除的Cr(Ⅵ)被吸附在类施氏矿物内,导致Cr(Ⅵ)无法溶出;③Cr(Ⅵ)可能会生成(Crx,Fe1-x)(OH)3等化合物,增加了类施氏矿物的吸附稳定性。
同时发现,1d内施氏矿物溶液中的Cr(Ⅵ)浓度升至0.13mg/L,之后趋于稳定,Cr(Ⅵ)的溶出率为28.39%,较类施氏矿物增加27.23%,存在Cr(Ⅵ)的二次污染。这是因为施氏矿物主要是通过静电吸附或离子交换作用将溶液中的重金属吸附在矿物表面,经过长时间浸泡后,施氏矿物表面电位发生变化,致使通过静电吸附作用去除的Cr(Ⅵ)脱附,同时溶液中游离的Fe3+与Cr(Ⅵ)发生离子交换,也促使溶液中Cr(Ⅵ)浓度升高。
3、结论
①共存离子浓度和络合剂浓度增大均会显著抑制Cr(Ⅵ)的去除。当共存离子浓度为100mmol/L时,对Cr(Ⅵ)的去除率可以降至30.65%~31.35%;当络合剂浓度为8.0mmol/L时,对Cr(Ⅵ)的去除率仅为75.22%~75.33%。初始反应物浓度、温度、初始pH对Cr(Ⅵ)的去除影响不明显。
②合成类施氏矿物的最佳反应条件是温度为35℃、pH为2.0、共存离子浓度为20mmol/L、络合剂浓度为0.5mmol/L,此时对Cr(Ⅵ)的最高去除率为97.7%,较施氏矿物提高了49.72%。
③含Cr(Ⅵ)类施氏矿物溶液中Cr(Ⅵ)浓度在1d内上升至0.37mg/L,Cr(Ⅵ)溶出率为1.16%,较施氏矿物降低了27.23%。
④类施氏矿物可以通过静电吸附、离子交换等方式吸附重金属,并能通过CaSiO3的网捕和共沉淀作用将重金属固定在矿物的晶格内,从而可在合成过程中高效去除废水中的Cr(Ⅵ)。(来源:广州大学土木工程学院,广州市市政集团有限公司,生态环境部华南环境科学研究所,广州市北控环保工程有限公司)



