申请日2014.06.06
公开(公告)日2014.08.27
IPC分类号G01N21/31; G01N1/38; G01N1/28
摘要
本发明公开了一种污水测汞方法,属于分析化学技术领域。其基本的检测步骤包括:选取标准液介质、配置标准贮备液、配备标准使用液、配备NaBH4还原剂溶液、样品预处理以及将产生的冷蒸汽汞原子接入冷原子吸收测汞仪进行检测的步骤。本发明采用盐酸(HCl)介质配制汞的标准溶液,使汞在盐酸介质中生成极其稳定的氯化汞氢(HHgCl3)配合物;另外使用硼氢化钠为还原剂,其操作更加方便快捷。
摘要附图
权利要求书
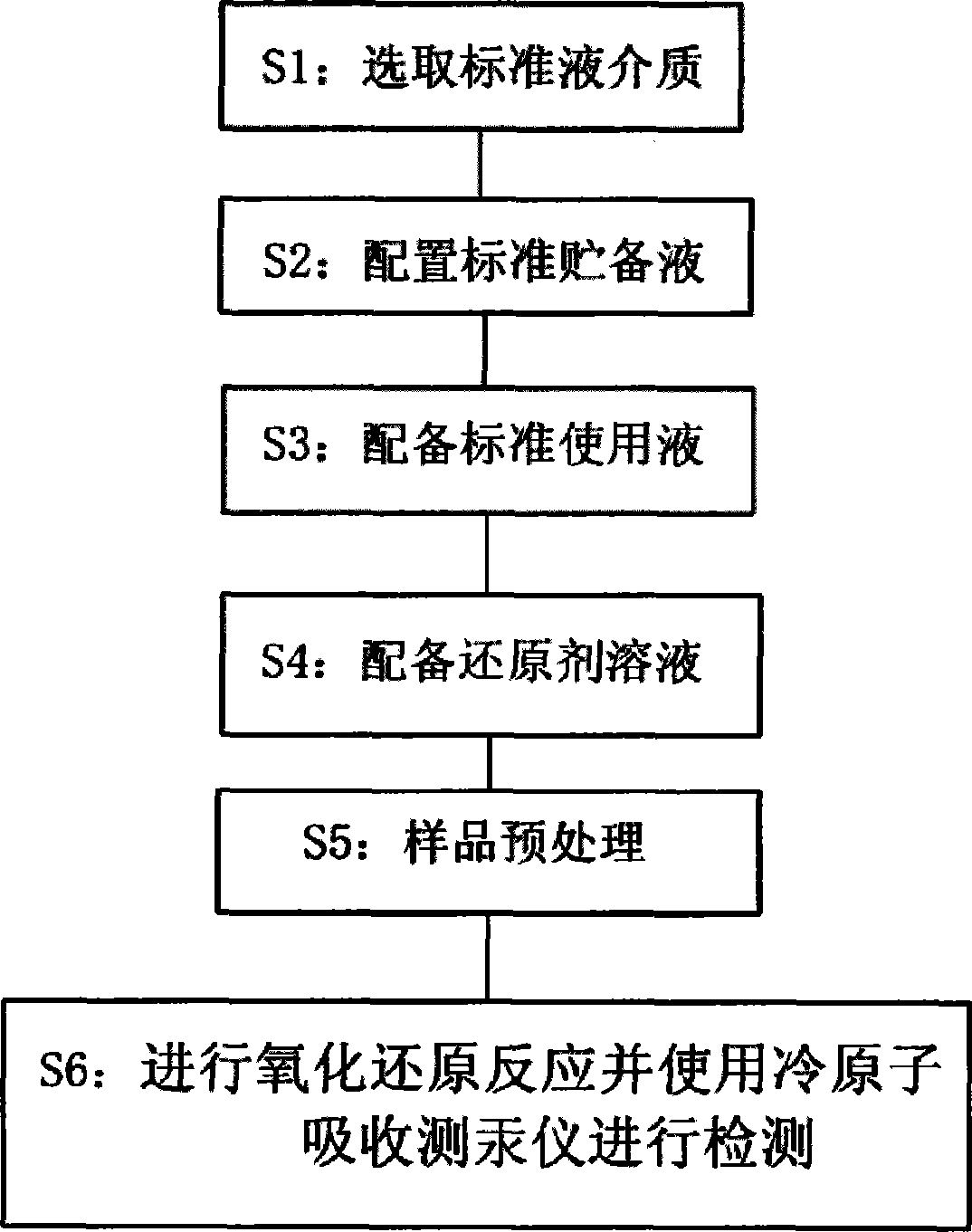
1.一种污水测汞方法,其特征在于:包括步骤,
S1:选取标准液介质,该标准液介质包括HCl溶液、重铬酸钾盐酸溶液和 酒石酸溶液;其中所述HCl溶液的浓度为0.5mol/L;所述重铬酸钾盐酸溶液由 0.56g的K2Cr2O7溶解于30ml水中,加入15ml浓度为35%的盐酸并加水至 100ml配置而成;所述酒石酸溶液的浓度为40%;
S2:使用S1步骤中的HCl溶液配置标准贮备液,该标准贮备液包括HgCl2溶液,其浓度为10μg/ml;
S3:选用S2步骤中的标准贮备液为原料配备标准使用液,该标准使用液 为HgCl2溶液,其浓度为10ng/ml:
S4:配备NaBH4还原剂溶液,其浓度为0.05mol/L;
S5:样品预处理:取含汞水样放于比色管,该汞水样占比色管三分之一的 体积,并加入0.4molS1步骤所述的重铬酸钾盐酸溶液,5分钟后加入0.8mol 步骤S1所述的酒石酸溶液,摇匀;
S6:往经过步骤S5处理后的样品加入S4步骤中的0.5mol的NaBH4还原 剂溶液,发生氧化还原反应,然后将产生的冷蒸汽汞原子接入冷原子吸收测汞 仪进行检测。
2.如权利要求1所述之污水测汞方法,其特征在于:步骤S2中所述的 HgCl2溶液的制备方法为采用硅胶干燥器中放置12小时以上的HgCl20.1354g, 溶解于0.5mol/L HCl中,并用该HCl稀释定容至1L。
说明书
污水测汞方法
技术领域
本发明涉及分析化学技术领域,具体来说是利用硼氢化钠还原冷汞离子原 子来测定汞含量的检测方法。
背景技术
汞污染,是指人们工业生产和生活中因为对汞的处理不力而导致的人体和 环境被破坏的现象。元素汞基本无毒,无机汞中的昇汞是剧毒物质,机汞中的 苯基汞分解较快,毒性不大,甲基汞进入人体很容易被吸收,不易降解,排泄 很慢,特别是容易在脑中积累,毒性最大。
中国是汞生产和使用大国,数据显示2005、2006年,中国汞产量约占全 球总汞产量的60%左右,汞需求量约占30%~40%,均位居全球首位。与此同 时,中国也是全球汞排放大国。截止2010年,全球每年人为活动向大气的汞 排放量有2000吨,其中中国每年排放汞约500-600吨,占全球汞排放总量的 1/4还多。
大气中气态和颗粒态的汞随风飘散,一部分通过湿沉降或干沉降落到地面 或水体中。土壤中的汞可挥发进入大气,也可被降水冲洗进入地面水和地下水 中。地面水中的汞一部分由于挥发而进入大气,大部分则沉降进入底泥。底泥 中的汞,不论呈何种形态——金属汞、无机汞、有机汞——都会直接或间接在 微生物的作用下转化为甲基汞或二甲基汞。二甲基汞在酸性条件下可以分解为 甲基汞。甲基汞可溶于水,又从底泥回到水中。水生生物摄入的甲基汞,可以 在体内积累,并通过食物链不断富集(生物放大)。
水生生物摄入的甲基汞,可在体内积累,并通过食物链不断富集。受汞污 染水体中的鱼,体内甲基汞浓度可比水中高上万倍。通过挥发、溶解、甲基化、 沉降、降水冲洗等作用,汞在大气、土壤、水之间不断进行着交换和转移。
水是人类生存的必需品,离开了水,人类就没有了赖以生存的物质基础。 因此,对污染水的处理对于人们的生活异常重要。特别是,针对汞重金属,对 人体健康具有重大的影响;故而污水的处理技术发展越来越多。
目前,常用的技术是:冷原子吸收法测汞法,其标准溶液的介质为5%硝 酸+0.05%重铬酸钾溶液,以保证汞的标准溶液的稳定。
测定原理是以氯化亚锡作为还原剂,将汞释放成为冷原子汞蒸汽,机体反 应方程式如下:
Sn2++8Cl-+2Hg2+=[SnCl6]2-+Hg2Cl2
Sn2++4Cl-+Hg2Cl2=2Hg+[SnCl6]2-
释放出的汞蒸气进入冷原子吸收测汞仪进行测定。
上述的技术方案对含汞的水处理具有很好的效果,但是也存在很大的不足 之处,如:
1、以硝酸+重铬酸钾为介质,汞标准溶液浓度依然会逐渐降低,难以长时 间保存,且重铬酸钾为有毒物质。
2、氯化亚锡还原高价汞释放汞蒸气的过程中存在缺陷:
氯化亚锡必须在较低酸度(低于1mol/L)下才有较高的还原效果,但是低 酸度易造成氯化亚锡水解沉淀而失去还原能力;当提高酸度保证氯化亚锡不被 水解时,氯化亚锡的还原效率又会降低,影响汞蒸汽的释放,使测定结果偏低, 不稳定,甚至无法检测。
发明内容
本发明为了克服现有技术的不足,提供一种污水测汞方法,其目的是提高 测定汞的稳定性与准确性,保证分析检测质量,使操作更便捷。
为了解决上述的技术问题,本发明的基本解决技术方案是:一种污水测汞 方法,包括步骤,
S1:选取标准液介质,该标准液介质包括HCl溶液、重铬酸钾盐酸溶液和 酒石酸溶液;其中所述HCl溶液的浓度为0.5mol/L;所述重铬酸钾盐酸溶液由 0.56g的K2Cr2O7溶解于30ml水中,加入15ml浓度为35%的盐酸并加水至 100ml配置而成;所述酒石酸溶液的浓度为40%;
S2:使用S1步骤中的HCl溶液配置标准贮备液,该标准贮备液包括HgCl2溶液,其浓度为10μg/ml;
S3:选用S2步骤中的标准贮备液为原料配备标准使用液,该标准使用液 为HgCl2溶液,其浓度为10ng/ml;
S4:配备NaBH4还原剂溶液,其浓度为0.05mol/L;
S5:样品预处理:取含汞水样放于比色管,该汞水样占比色管三分之一的 体积,并加入0.4molS1步骤所述的重铬酸钾盐酸溶液,5分钟后加入0.8mol 步骤S1所述的酒石酸溶液,摇匀;
S6:往经过步骤S5处理后的样品加入S4步骤中的0.5mol的NaBH4还原 剂溶液,发生氧化还原反应,然后将产生的冷蒸汽汞原子接入冷原子吸收测汞 仪进行检测。
本发明所述之污水测汞方法中,步骤S2中所述的HgCl2溶液的制备方法 为采用硅胶干燥器中放置12小时以上的HgCl20.1354g,溶解于0.5mol/L HCl 中,并用该HCl稀释定容至1L。
本发明以硼氢化钠作为还原剂,将汞释放成为冷原子汞蒸气,其离子反应 方程式为:
2BH4-+2H2O=6[H]+2B(OH)3
Hg2++2[H]=Hg↑+H2
本发明的有益效果是:
1、本发明采用盐酸(HCl)介质配制汞的标准溶液,使汞在盐酸介质中生 成极其稳定的氯化汞氢(HHgCl3)配合物,实践证明,在盐酸介质中,10ng/ml 汞的标准贮备液在常温下储存一年其浓度无变化,氯化汞氢配合物在盐酸介质 中即使加热煮沸也不挥发损失。
2、汞的还原释放采用盐酸介质,用硼氢化钠作为还原剂,配制简单,还 原效率高,不受介质酸度影响,分析质量易于保证。
3、在采用冷原子吸收测汞仪和试剂时,以往是使用氯化亚锡溶液,但是 氯化亚锡溶液的逐渐水解沉淀会使泵管内壁不光滑和变细造成进样不顺畅和 不稳会,而本发明使用硼氢化钠为还原剂,其操作更加方便快捷。






