城镇污水处理厂生化尾水深度净化脱氮常采用异养反硝化工艺,安全廉价的碳源是该工艺高效运行的关键。与常用液态碳源相比,可生物降解型人工合成聚合物固体碳源因运输安全、释碳稳定而成为反硝化脱氮领域的研究热点。聚乳酸(PolylacticacidPLA)、3-羟基丁酸/戊酸酯共聚物(Polyhydroxy-butyrate-co-valeratePHBV)、聚己内酯(Poly(ε-caprolactone)PCL)和聚丁二酸丁二醇酯(Poly(ButyleneSuccinate)PBS)等聚合物具有良好释碳性能。但PHBV,PCL和PBS等聚合物在合成过程中存在聚合条件苛刻、催化剂毒性高等问题,存在安全隐患。PLA能够由乳酸直接缩聚而成,合成方法简单、价格低廉,被认为是最具有发展潜力的可生物降解聚合物。
目前,关于PLA作为固体碳源进行反硝化脱氮的研究多以工程应用为主。FAN等研究了PLA反硝化脱氮的污泥培养时间(35d)与适宜温度(30~40℃)。彭书林等优化了PLA反硝化系统的适宜进水pH范围为7.8~10.1。TAKAHASHI等从PLA水解产物角度判断了不同分子量PLA的脱氮效果,指出低分子量PLA脱氮效果更好。但是不同分子量PLA的脱氮路径及相应机制尚不清晰,这是异养微生物脱氮过程高效调控的理论基础。
本研究选取分子量为5000g·mol−1,10000g·mol−1和50000g·mol−1的PLA,在探究其释碳性能和反硝化效果的基础上,通过分析出水溶解性有机质(DOM)组分及微生物群落结构,揭示不同分子量PLA反硝化脱氮路径与机制,以期为PLA应用于低碳脱氮提供参考。
1、材料与方法
1.1 实验原料
本实验选用直接聚合法合成的PLA。该方法流程简单成本较低,合成的PLA分子量在5000~50000g·mol−1 。因此,本实验选取分子量为5000g·mol−1,10000g·mol−1,50000g·mol−1的PLA进行研究。PLA的形态为白色椭球形颗粒,其直径为2~3mm、长为3~4mm。其他试剂均采用分析纯。模拟废水的制备方法:在自来水中加入NaNO3和KH2PO4,使NO3−-N质量浓度为30mg·L−1,PO43−-P质量浓度为6mg·L−1;微量元素溶液按1mL·L−1体积分数添加,其组分如表1所示。
1.2 实验方法
1)聚乳酸PLA静态释碳研究方法。取3只500mL锥形瓶,分别加入300mL去离子水,并加入100g分子量为5000g·mol−1、10000g·mol−1、50000g·mol−1的PLA,瓶口密封,放置于35℃、80r·min−1恒温培养箱中。每24h取样并更换去离子水,连续更换17d。之后,测定水样COD,并计算PLA的累计释碳率(cumulativecarbonreleaserate)。
2)聚乳酸PLA反硝化研究方法。取3只500mL锥形瓶,加入300mL模拟废水和150mL活性污泥(MLSS为3g·L−1),分别加入100g分子量为5000g·mol−1、10000g·mol−1、50000g·mol−1的PLA,瓶口密封,放置于35℃、80r·min−1恒温培养箱中。每24h取样并更换300mL模拟废水,连续更换36d,并于第1天、第17天和第37天取样分析DOM组分,于第37天取样分析微生物群落结构。测定水样NO3−-N、NO2−-N、NH4+-N、COD,并计算反硝化速率(Denitrificationrate)。
3)PLA累计释碳率计算。PLA累计释碳率可用CR来表示,计算如式(1)所示。
![]()
式中:CRd为第d天的累计释碳率;Ci为第i天的COD,mg·L−1;V为实验溶液体积,L;TC为释碳实验所使用PLA总含碳量,mg。
4)PLA反硝化速率计算。反硝化速率可以用DR表示,如式(2)所示。
![]()
式中:DR为反硝化速率,mg·L−1·h−1;C0和Ce分别为NO3−-N初始浓度和出水质量浓度,mg·L−1。本研究中水力停留时间(HRT)统一为24h。
1.3 分析测试方法
水样经0.45μm膜滤膜过滤后测定相关参数。其中,NO3−-N采用紫外分光光度法测定;NO2−-N采用N-(1-萘基)-乙二胺光度法测定;NH4+-N采用纳氏试剂法测定;COD采用快速消解分光光度法(DR-1900,哈希,美国)测定。三维荧光光谱采用日立(Hitachi)F-7000荧光分光度计测定,激发波长(λex)扫描范围:200~450nm,发射波长(λem)扫描范围:250~600nm;狭缝宽带:λex=5nm,λem=5nm;扫描速度2400nm·min−1。三维荧光光谱(3D-EEM)根据激发波长和发射波长的不同范围分为5个区域。这5个区域分别为Ⅰ区(λex/λem=(200~250nm)/(250~330nm),类酪氨酸物质)、Ⅱ区(λex/λem=(200~250nm)/(330~380nm),类色氨酸物质)、Ⅲ区(λex/λem=(200~250nm)/(380~550nm),类富里酸物质)、Ⅳ区(λex/λem=(250~400nm)/(250~380nm),溶解性微生物代谢产物物质)、Ⅴ区(λex/λem=(250~400nm)/(380~550nm),类腐殖酸物质)。按照荧光区域积分(FRI)分析法,通过Origin9.1计算荧光区域的积分体积Фi;对荧光区域的积分体积进行标准化,得到区域i的标准化积分体积Фi,n;再计算总荧光区域标准化积分体积ФT,n;最后计算区域i标准化积分体积占总标准化积分体积之比Pi,n。
微生物群落结构采用16SrRNA高通量测序进行分析。污泥样品采集后置于10mL离心管内,-20℃保存,随后进行样品DNA提取,采用通用引物338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对样品16SrRNA基因V3-V4可变区进行PCR扩增。PCR产物用QuantiFluor™-ST定量系统(美国Promega公司)检测定量后,最后利用IlluminaMiseqPE300平台进行测序。使用Uparse软件(version11),根据97%的相似度对序列进行OTU聚类。利用RDPclassifier(version2.13)对每条序列进行物种分类注释,比对Silva16SrRNA数据库(version138),设置比对阈值为70%,并在门、科和属水平上统计不同样本的群落组成。
2、结果与讨论
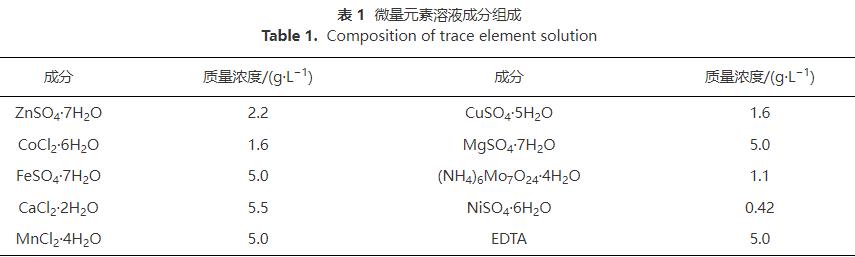
2.1 PLA静态释碳性能
分子量为5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA静态释碳性能如图1所示。PLA的分子量增大,其释碳稳定性越好。分子量为5000g·mol−1、10000g·mol−1的PLA释碳表现出明显的两阶段性:第1天为快速释碳阶段,COD分别降为40mg·L−1和33mg·L−1;第2~17天为缓慢释碳阶段,每天稳定释放COD约20mg·L−1。分子量50000g·mol−1的PLA未见明显的阶段性,而周期内COD释放量每天保持约20mg·L−1。不同分子量PLA在17d内累计释放率稳定增长,且不超过0.1%。
性能良好的固体碳源在清水中释碳能力较弱,可在微生物作用下释放反硝化脱氮所需碳源。上述数据表明,不同分子量的PLA均可长时间进行低量释放碳源,为一种性能良好的固体碳源。这归因于PLA的水溶性差,在清水中可长时间低量释碳(约为20mg·L−1),与PCL、PHBV等人工合成碳源释碳量相近(13.35~26.70mg·L−1),远低于玉米芯和花生壳等天然碳源(200~300mg·L−1);而固体碳源静态释碳过高,应用脱氮系统中会造成出水有机物含量超标。
2.2 PLA反硝化脱氮性能
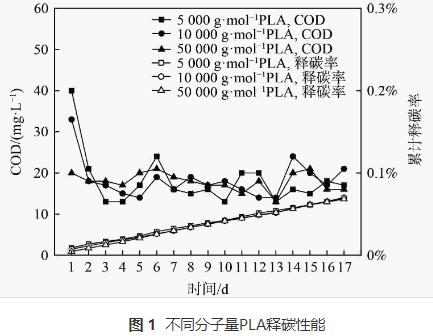
当PLA分子量分别为5000g·mol−1、10000g·mol−1和50000g·mol−1时,出水NO3−-N质量浓度变化、去除率和反硝化速率如图2所示,副产物NH4+-N质量浓度和不同形态N比例变化如图3。

随着PLA分子量的增加,出水NO3−-N质量浓度增大,去除率和反硝化速率降低。第1~16天,不同分子量PLA的出水NO3−-N质量浓度均随时间逐渐下降,去除率和反硝化速率逐渐升高;第17~36天,不同分子量PLA出水NO3−-N质量浓度、去除率和反硝化速率均呈稳定趋势,5000g·mol−1分子量PLA的NO3−-N去除率和反硝化速率可分别达到100%和1.29mg·L−1·h−1。分析其原因,在反硝化过程中,微生物无法直接利用PLA颗粒,而是以PLA的水解产物作为碳源。PLA会在微生物分泌的胞外水解酶作用下,发生内部酯键水解而形成小分子有机酸 ,胞外水解酶会优先催化水解PLA的非晶区。PLA水解出小分子有机物的能力也与其分子量密切相关。低分子量PLA主要以非晶区存在更容易被胞外酶催化水解提供有效碳源,故其反硝化效果更好。
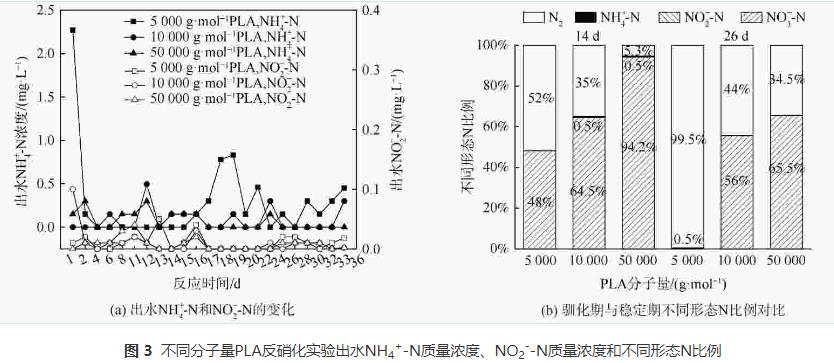
由图3 (a)可知,在反应过程中,PLA分子量分别为10000g·mol−1、50000g·mol−1时,NH4+-N无明显积累(<0.5mg·L−1)。PLA分子量为5000g·mol−1时,反应1d时出水NH4+-N质量浓度为2.27mg·L−1。这可能是由于PLA分子量为5000g·mol−1时,反应器的接种污泥释放了在污水处理厂吸附的铵;而在后续实验阶段,NH4+-N稍有积累,最高质量浓度为0.83mg·L−1,这可能是由于反应器内发生了硝酸盐异化还原为铵(dissimilatorynitratereductiontoammonium,DNRA)的反应。PLA分子量为5000g·mol−1时,NH4+-N积累量大于PLA分子量为10000g·mol−1和50000g·mol−1时。这是因为PLA分子量为5000g·mol−1时,能释放更多碳源并加强DNRA作用。DNRA作用常见于固体碳源脱氮过程,但NH4+-N积累量会随不同种类碳源变化。一般情况下,天然固体碳源的效果会优于聚合物类固体碳源。而本实验结果表明,PLA为固体碳源时,其出水NH4+-N积累量(<0.83mg·L−1)会低于PHBV(1.14mg·L−1)等其他聚合物碳源。不同分子量PLA反硝化实验出水NO2−-N无明显积累(<0.2mg·L−1)。异养反硝化反应以有机物为电子供体,分为NO3−-N被还原为NO2−-N与NO2−-N被还原为N2两步,分别由硝酸盐还原酶和亚硝酸盐还原酶催化进行。出水NO2−-N无明显积累表明以PLA为固体碳源的反硝化反应的限速步骤为NO3−-N被还原为NO2−-N过程,而NO2−-N能迅速被亚硝酸盐还原酶还原为N2。
由图3 (b)可知,稳定期(第17~36天)不同分子量PLA反硝化氮气转化率均高于驯化期(第1~16天),5000g·mol−1分子量PLA稳定期氮气转化率达到99%,且不同分子量PLA反硝化出水NO2−-N无明显积累。这表明5000g·mol−1分子量的PLA能实现完全反硝化,几乎不生成NO2−-N和NH4+-N等副产物。
2.3 PLA反硝化脱氮机制
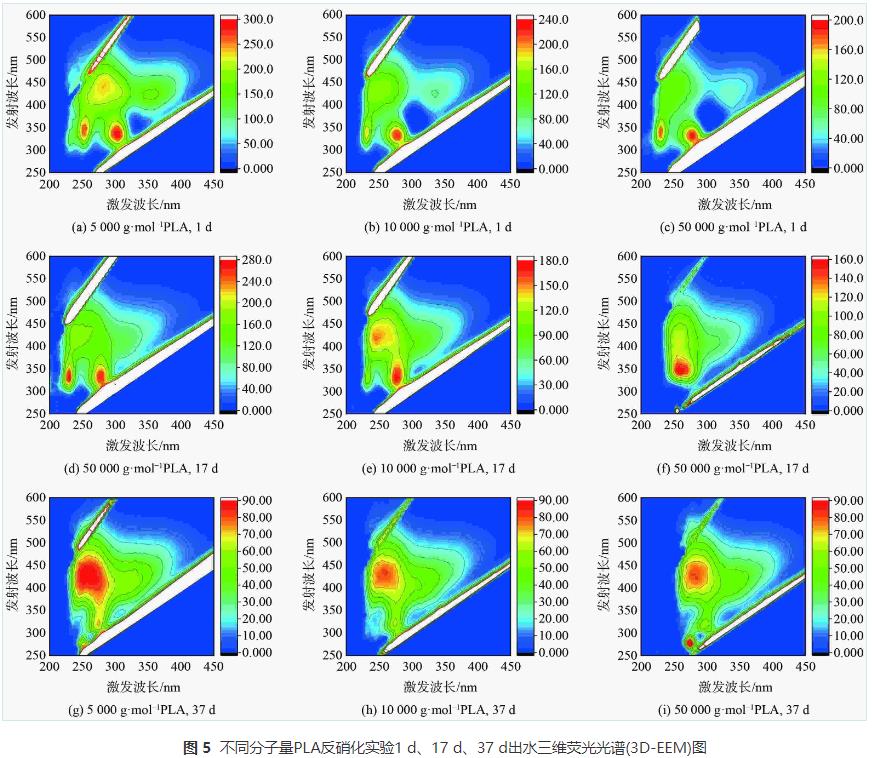
1)PLA反硝化电子供体有机质来源。分子量分别为5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA对应反硝化出水COD的变化如图4所示,溶解性有机质(DOM)组分变化如图5、6和7所示。
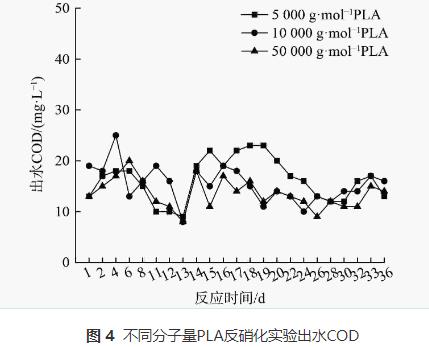
由图4可知,分子量为5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA对应的反硝化实验出水COD较稳定,平均COD分别为16.26mg·L−1、15.35mg·L−1和14.17mg·L−1。固体碳源反硝化系统内COD主要取决于微生物作用下碳源释放过程与异养反硝化等碳源利用过程。图4中出水COD稳定表明脱氮系统内碳源的释放与利用达到平衡,即在脱氮过程中微生物水解PLA释放的碳源会被微生物菌群迅速用于反硝化脱氮及自身生长繁殖。
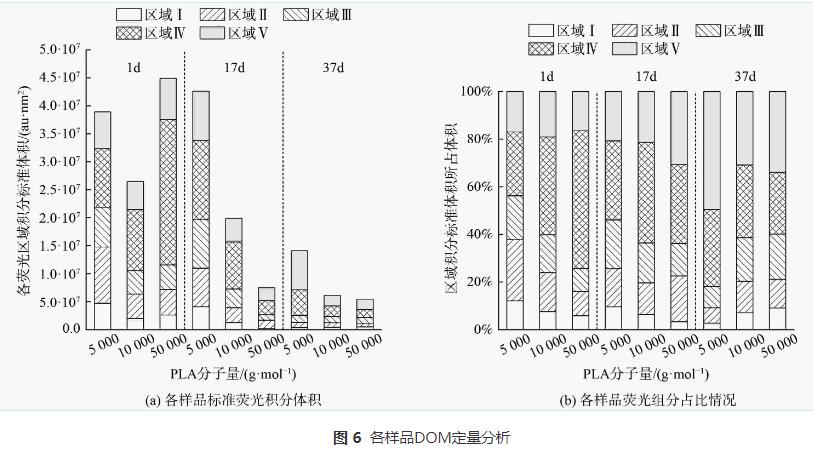
根据三维荧光光谱(3D-EEM)的特定波长荧光强度数据,能显示水中溶解性有机质(DOM)的组分特征。由三维荧光光谱(图5)可知,不同分子量PLA反硝化出水中DOM组分主要为溶解性微生物代谢产物、腐殖酸类、富里酸类及少量蛋白质类物质。为进一步探究DOM的荧光特性,运用荧光光谱FRI对DOM的三维荧光光谱进行定量分析。各样品的总积分标准体积见图6 (a)。随着实验的进行,反应器中DOM的荧光强度逐渐降低。这说明PLA异养反硝化能去除水中DOM。各荧光组分占比见图6 (b)。随着反硝化时间的延长,反应器内溶解性微生物代谢产物和类蛋白质物质组分占比降低,而腐殖酸类和富里酸类物质组分占比升高。这是因为溶解性微生物代谢产物等易降解有机物在反硝化过程中会逐渐转化为腐殖酸类和富里酸类等难降解有机物,A2O工艺的缺氧池中也存在以微生物代谢产物为电子供体的反硝化过程,同时产生腐殖酸。因此,PLA反硝化脱氮电子供体来源不仅有PLA释放的小分子碳源,还有溶解性微生物代谢产物等有机物。
2)PLA脱氮微生物学机制分析。分子量分别为5000g·mol−1、10000g·mol−1和50000g·mol−1的PLA对应的反硝化脱氮系统微生物群落多样性分析结果:α多样性指数如表2所示,微生物门、科和属水平群落结构如图7和8所示。
表2表明,所有样品覆盖率(coverage)均为0.99,代表测序结果真实可靠。反应器中Shannon和Chao指数基本无变化并保持在较高数值,证明PLA分子量对微生物群落丰富度和多样性影响不大,且PLA反应器内微生物活性较高,同时也表明PLA可作为反硝化固体碳源。
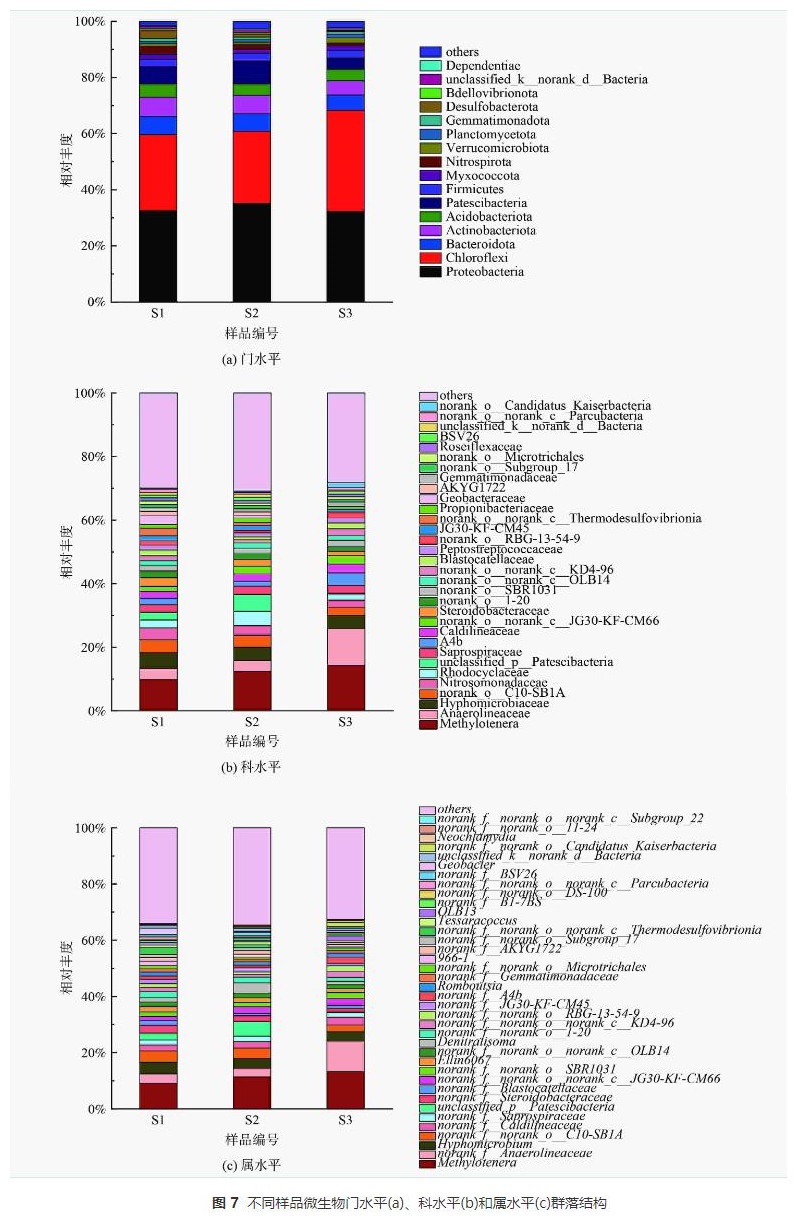
不同污泥样品在门水平上的分布如图7 (a)所示,主要优势门主要有变形菌门(Proteobacteria)(32.28%~35.12%)、绿弯菌门(Chloroflexi)(25.67%~36.00%)、放线菌门(Actinobacteriota)(5.11%~6.82%)、CPR细菌(Patescibacteria)(3.92%~8.14%)和拟杆菌门(Bacteroidota)(5.47%~6.27%)。常见的还原硝酸盐的反硝化菌属大多在变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota)下,不同分子量PLA反应器内变形菌门(Proteobacteria)与拟杆菌门(Bacteroidota)相对丰度之和为37.75%~41.38%。这表明各反应器内这2种菌门为优势菌门。绿弯菌门(Chloroflexi)下的微生物能在厌氧条件下吸收来自细胞裂解的肽聚糖等物质,其部分属能利用细胞释放的微生物代谢产物作为电子供体进行反硝化作用,S3样品内绿弯菌门(Chloroflexi)相对丰度(36.00%)明显高于S1(27.97%)、S2(25.67%)样品。推测这是由于分子量50000g·mol−1的PLA无法释放出足够碳源以供微生物生长所需,使得微生物细胞裂解释放肽聚糖,造成绿弯菌门(Chloroflexi)等菌群相对丰度的增加。放线菌门(Actinobacteriota)与CPR细菌(Patescibacteria)常见于城市污水处理厂活性污泥内。
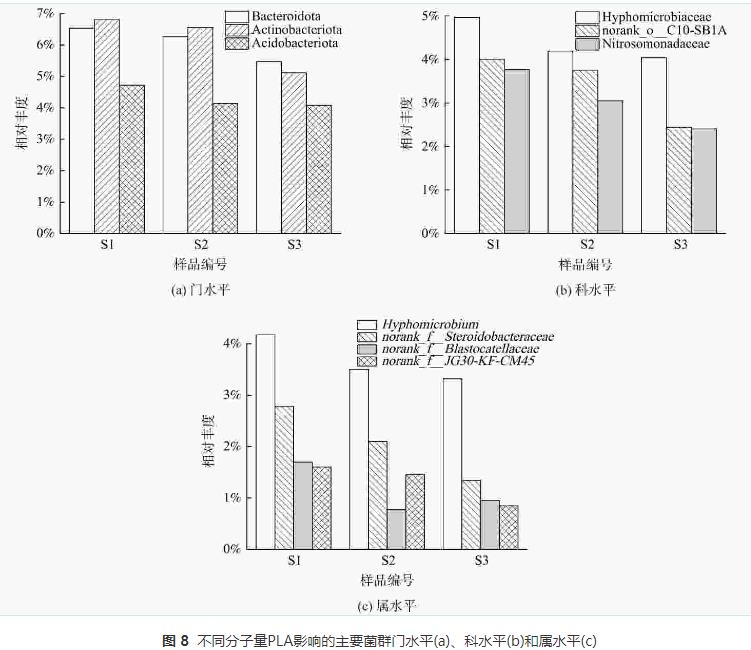
由图8 (a)可知,S1样品拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)和酸杆菌门(Acidobacteriota)相对丰度均高于S2和S3样品。拟杆菌门(Bacteroidota)下的微生物可以降解纸浆等有机物从而释放碳源,放线菌门(Actinobacteriota)下的微生物能合成胞外水解酶降解大分子有机物,其部分属能够水解PLA。随着PLA分子量的升高,拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)丰度降低。这表明5000g·mol−1分子量PLA更容易富集PLA水解相关菌门,从而释放更多碳源。酸杆菌门(Acidobacteriota)中的微生物带有narG、nirK和nirS等多种反硝化功能基因能够编码合成硝酸盐还原酶和亚硝酸盐还原酶,并能在厌氧条件下利用乙酸等有机物还原硝酸盐。
样品在科水平上的分布如图7 (b)所示,样品中共检测出32个科。前十个主要优势科是:嗜甲基菌科(Methylophilaceae)(9.82%~14.32%)、厌氧绳菌科(Anaerolineaceae)(3.44%~11.62%)、生丝微菌科(Hyphomicrobiaceae)(4.04%~4.97%)、norank_o_C10-SB1A(2.44%~3.76%)、亚硝化单胞菌科(Nitrosomonadaceae)(2.40%~3.77%)、红环菌科(Rhodocyclaceae)(1.96%~4.53%)、unclassified_p_Patescibacteria(0.18%~5.25%)、腐败螺旋菌科(Saprospiraceae)(2.37%~2.63%)、A4b(1.56%~3.94%)、暖绳菌科(Caldilineaceae)(2.18%~2.80%)。嗜甲基菌科(Methylophilaceae)、厌氧绳菌科(Anaerolineaceae)、生丝微菌科(Hyphomicrobiaceae)、红环菌科(Rhodocyclaceae)和暖绳菌科(Caldilineaceae)均为硝酸盐还原菌;亚硝化单胞菌科(Nitrosomonadaceae)是一种氨氧化菌(ammoniaoxidizingbacterium,AOB),能氧化氨氮为亚硝酸盐;腐败螺旋菌科(Saprospiraceae)是一种亚硝酸盐还原菌。上述各菌科均为反硝化脱氮过程的关键功能科,广泛存在于全球各地废水脱氮反应器中。norank_o_C10-SB1A为硝酸盐异化还原为氨(DNRA)功能菌群。A4b曾在含有PLA的反硝化系统中检测出,是一种能降解大分子有机物的微生物。
如图8 (b)所示,S1样品生丝微菌科(Hyphomicrobiaceae)、norank_o_C10-SB1A和亚硝化单胞菌科(Nitrosomonadaceae)相对丰度高于S2和S3样品。这表明含有5000g·mol−1分子量PLA的反应器中起主要反硝化作用的菌科为生丝微菌科(Hyphomicrobiaceae),且该菌生物活性较高,能在相对丰度小于5%的情况下,完成反硝化脱氮。norank_o_C10-SB1A和亚硝化单胞菌科(Nitrosomonadaceae)丰度较高,可能是因为5000g·mol−1分子量PLA能够释放较多碳源以致DNRA菌群(norank_o_C10-SB1A)繁殖,使得短时间内NH4+-N得到积累,促进了以NH4+-N为基质的亚硝化单胞菌科(Nitrosomonadaceae)的生长。因此,尽管norank_o_C10-SB1A相对丰度较高,出水NH4+-N却未见明显积累。
样品在属水平上的分布如图7 (c)所示,共检测出38个属。前十个主要优势属为:甲基娇养杆菌属(Methylotenera)(9.09%~13.26%)、norank_f_Anaerolineaceae (3.03%~10.85%)、生丝微菌属(Hyphomicrobium)(3.50%~4.17%)、norank_f_norank_o_C10-SB1A (2.44%~4.00%)、norank_f_Caldilineaceae (2.10%~2.74%)、norank_f_Saprospiraceae (1.65%~1.91%)、unclassified_p_Patescibacteria (0.18%~5.25%)、norank_f_Steroidobacteraceae (1.34%~2.78%)、norank_f_Blastocatellaceae (0.18%~1.70%)、norank_f_norank_o_norank_c_JG30-KF-CM66 (1.49%~2.62%)。其中,甲基娇养杆菌属(Methylotenera)和生丝微菌属(Hyphomicrobium)是典型反硝化菌属具有还原硝酸盐的作用,常见于反硝化活性污泥。norank_f_Anaerolineaceae、norank_f_Blastocatellaceae、norank_f_norank_o_norank_c_JG30-KF-CM66和norank_f_Steroidobacteraceae属均与复杂有机物代谢有关。norank_f_Caldilineaceae和norank_f_Saprospiraceae属是通过消耗有机物进行反硝化作用的功能细菌。norank_f_norank_o_C10-SB1A为norank_o_C10-SB1A科下的细菌为DNRA作用的关键功能属。
如图8 (c)所示,S1样品中生丝微菌属(Hyphomicrobium)、norank_f_Steroidobacteraceae、norank_f_Blastocatellaceae和norank_f_JG30-KF-CM45属相对丰度高于S2和S3样品。生丝微菌属(Hyphomicrobium)是隶属于生丝微菌科(Hyphomicrobiaceae)的微生物,是反硝化作用的关键细菌。 norank_f_JG30-KF-CM45属也是反硝化功能属,丰度与有机物浓度成正比。norank_f_Blastocatellaceae属参与代谢有机高分子物质,可能与聚合物水解过程有关。norank_f_Steroidobacteraceae属参与木质素生物降解和解聚过程,也可水解有机聚合物。属水平结果表明5000g·mol−1分子量PLA能富集更多水解功能菌群。
总体来说,不同分子量PLA脱氮系统内微生物在门、科和属水平上的分布不同。5000g·mol−1分子量的PLA更有利于富集水解功能菌群。PLA反硝化生物脱氮路径主要有两条:反硝化功能菌群利用水解大分子有机物的微生物分解PLA释放的小分子碳源作为电子供体进行异养反硝化作用;微生物利用溶解性微生物代谢产物等有机物进行反硝化脱氮。
3、结论
1)PLA作为固体碳源,在清水中能够长期稳定释放碳源,反硝化脱氮过程中释碳主要依靠生物作用。PLA反硝化脱氮效果表明,PLA分子量越低,脱氮效率越高。不同分子量PLA出水NO2−-N和NH4+-N等副产物均未见明显积累。5000g·mol−1分子量的PLA作为反硝化固体碳源更具有优势。
2)DOM组分和微生物测序结果表明,5000g·mol−1分子量的PLA更有利于富集水解相关功能菌群。PLA脱氮路径有两条:一是反硝化功能菌群利用水解微生物分解PLA释放的小分子碳源作为电子供体进行异养反硝化作用;一是微生物利用溶解性微生物代谢产物等有机物进行反硝化脱氮。(来源:中国环境科学研究院水生态环境研究所,兰州交通大学环境与市政工程学院,西北师范大学化学化工学院,甘肃省膜科学技术研究院有限公司,生态环境部环境发展中心)



