污水再生回用能够有效缓解城市水资源短缺的问题,目前我国污水处理厂主要采用“混凝-沉淀-过滤”深度处理工艺。为了解决此传统工艺处理流程较长和对溶解性有机物的去除率较低的问题,笔者所在课题组构建了臭氧混凝耦合反应体系(HOC),将臭氧氧化与混凝放在同一体系内,使两者互促增效,可促进臭氧分解生成更多的羟基自由基(·OH),进而提高对溶解性有机物的去除率。由于工业和油田的盐水排放以及农作物肥料甲基溴的使用等,部分地区的污水处理厂二级出水中Br浓度高达500~1000μg/L。当采用HOC工艺处理此类二级出水时,由于体系中臭氧氧化与·OH氧化的存在,加之初始Br浓度较高,生成溴酸盐(BrO3-)消毒副产物的风险较高。BrO3-为2B级潜在致癌物质,且在自然水体中非常稳定,一旦生成难以去除,因此,为了进一步评价HOC工艺的适用性并推广其应用范围,研究HOC工艺中BrO3-的生成特性,探索HOC体系的最佳工艺条件显得至关重要。
笔者对比了HOC工艺与单独臭氧氧化工艺对二级出水中有机物的去除特性以及处理过程中急性毒性的变化;通过分析溴类物质的浓度变化情况,探究HOC工艺中BrO3-的生成特性,进而明确HOC工艺的最佳反应条件;通过对臭氧自分解的一级动力学方程的拟合与·OH生成速率的分析,揭示HOC工艺中BrO3-的生成途径贡献率,以期为HOC体系中溴酸盐消毒副产物的有效控制提供参考。
1、材料与方法
1.1 实验用水
实验用水为纯水与污水厂二级出水加KBr,Br浓度为500μg/L,其中二级出水来自西安市某污水处理厂A2/O工艺的二沉池出水,具体水质指标如下:pH为7.34±0.18,总有机碳(TOC)为(4.576±1.236)mg/L,Br为(110±5)μg/L。
1.2 实验装置
HOC实验装置如图1所示,反应器为有机玻璃瓶,通过气体流量计控制氧气源臭氧发生器向反应体系中持续稳定通入臭氧,未反应的臭氧气体通入KI吸收瓶。
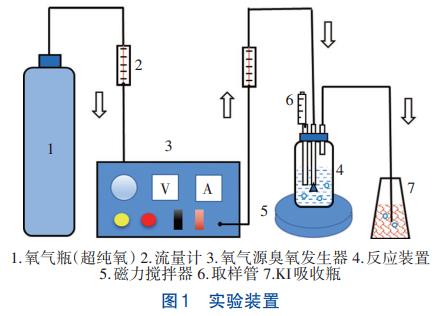
饱和臭氧水的制备装置同图1,只是把磁力搅拌器换为冰浴锅。通过气体流量计控制氧气源臭氧发生器出口流量在16L/h左右,利用冰浴锅控制温度在4℃左右,持续曝气约2h,臭氧即可达到饱和。
1.3 实验方法
HOC实验反应体系为100mL的超纯水或二级出水,向体系加入2mmol/L的磷酸盐缓冲液,采用0.2mol/L的NaOH溶液和(1+9)H2SO4溶液调节pH至5±0.2、7±0.2和9±0.2,混凝剂氯化铝与硫酸铝的投加量均为15mg/L(以Al计)。实验开始前,将反应体系置于磁力搅拌器上预先进行搅拌,加入混凝剂后立刻开始计时,快搅1min(转速为500r/min),结束后迅速向体系中通入臭氧,同时慢搅10min(转速为100r/min),并在设定时间取样,氮吹以防止其进一步氧化。
探究BrO3-的生成途径贡献率时,采用将饱和臭氧水投加到封闭体系的方法,即在混凝快搅完成后快速加入饱和臭氧水,饱和臭氧水的投加量为4.5mg/L(即1.0mg/mg,以TOC衡量),反应时间为15min。从加入饱和臭氧水开始计时,并在设定时间取样,经0.45μm滤头过滤后,快速测定臭氧浓度。测定对氯苯甲酸(p-CBA)浓度时还需提前向反应体系中加入0.5μmol/L的p-CBA,并需提前在液相小瓶中加入0.025mol/L硫代硫酸钠淬灭·OH。
1.4 分析项目与方法
臭氧浓度:液态臭氧浓度采用靛蓝比色法测定,气态臭氧消耗量采用碘量法测定。
TOC浓度:采用TOC-VCPH总有机碳分析仪(日本岛津)测定,测定前样品需经H2SO4酸化并用氮气吹脱3min,以去除水样中的大部分无机碳,保证测定结果的准确性。
Br和BrO3-浓度:采用ICS-1100Dionex型热电阴离子色谱仪测定,色谱柱为DionexIonPacTMAS23(4mm×250mm),BrO3-的检测限为3μg/L;样品使用固相萃取装置进行预处理,采用BondElut-C18小柱去除有机物的干扰,采用DionexOnGuardTMⅡAg/H小柱去除过渡金属离子与氯离子的干扰。
HOBr/BrO浓度:采用苯酚衍生法测定,即样品与苯酚在pH=3条件下于70℃水浴中加热1h后,采用高效液相色谱法测定4-溴苯酚浓度,4-溴苯酚的检测限为0.6μg/L。
·OH浓度:通过添加p-CBA作为·OH捕获剂来间接测定·OH浓度,p-CBA浓度采用高效液相色谱法测定,使用紫外检测器,色谱柱为大连依利特5μm反相C18柱(4.6mm×250mm),最低检测限为0.1μg/L。
急性毒性:使用生物发光检测仪检测样品对费氏弧菌(V.fischeri)的发光抑制性,通过发光抑制率来表示样品的毒性。毒性检测标准采用ISO11348标准,实验采用苯酚作为阳性对照、2%的NaCl溶液作为空白对照。
2、结果与讨论
2.1 HOC工艺的处理特性
2.1.1 对二级出水中有机物的去除效果
当臭氧投加量为1.0mg/mg时,不同pH条件下单独臭氧氧化工艺、HOC工艺(硫酸铝)、HOC工艺(氯化铝)对二级出水中有机物的去除效果如图2所示。
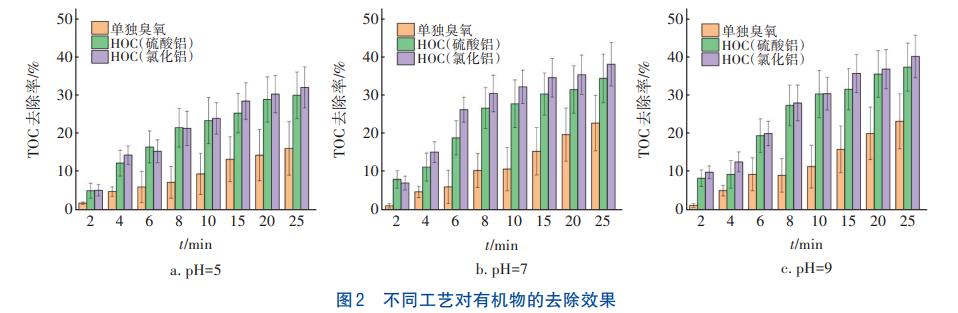
从图2可以看出,HOC工艺相比单独臭氧氧化工艺对有机物的去除效果更优,在pH=5、7和9条件下反应25min后HOC工艺(氯化铝)对有机物的去除率分别为32.0%、38.3%和40.3%,相较于单独臭氧氧化工艺分别提升了15.9%、16.8%和17.2%,这是由于HOC工艺产生了更多的·OH,·OH可无选择性地与有机污染物反应从而提高了去除率。HOC工艺(氯化铝)对有机物的去除率整体高于HOC工艺(硫酸铝),这可能是由于混凝剂氯化铝的水解产物相较于硫酸铝的水解产物表面羟基更丰富,而臭氧主要和混凝剂水解产物的表面羟基反应,表面羟基丰富则产生的·OH就更多,对有机物的去除效果就更好。
2.1.2 急性毒性的变化
污水厂二级出水的pH大多在7左右,所以该实验在pH=7条件下,研究三种工艺处理二级出水过程中急性毒性的变化情况,结果见图3。
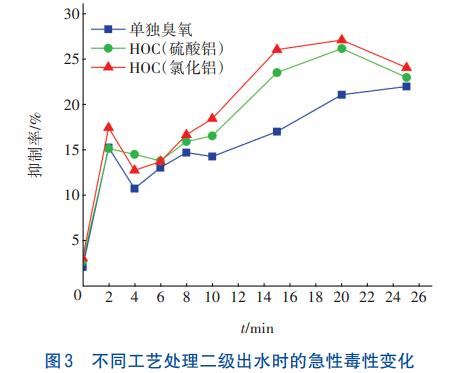
从图3可以看出,二级出水对发光细菌的抑制率随着反应的进行先略微降低后逐渐增加,其中HOC工艺的抑制率最高达到了27%,毒性较强。结合图2可知,随着二级出水中有机物浓度的降低,急性毒性增强,这可能与水中溴酸盐消毒副产物的生成有关。反应10min后HOC工艺(氯化铝)对二级出水中有机物的去除率为32.4%,比反应25min的去除率仅低了5.9%,且反应10min时毒性较低,所以综合考虑后,确定最佳反应时间为10min。
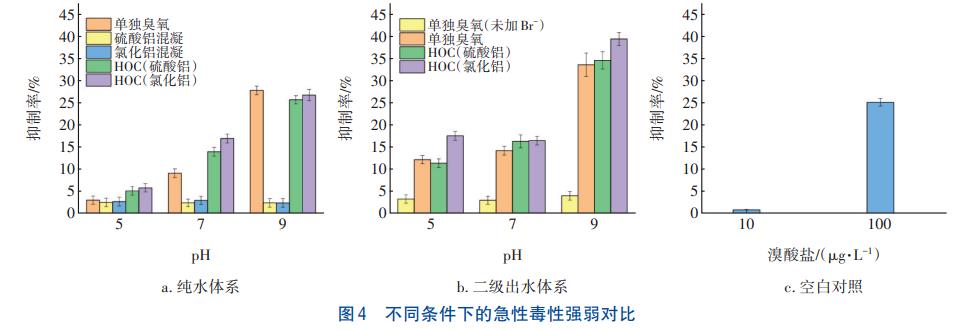
为探究二级出水深度处理过程中急性毒性增强的原因,实验在pH=5、7和9,臭氧投加量为1.0mg/mg条件下,对不同工艺反应10min后的急性毒性强弱进行比较,并在纯水中加入不同浓度的溴酸盐,测定其急性毒性作为空白对照,结果见图4。由图4(a)和(b)可知,随着pH的增大,两种体系中BrO3-生成量增大,急性毒性明显增强。纯水体系经过氯化铝单独混凝工艺和硫酸铝单独混凝工艺处理后,对发光细菌的抑制率都在3%左右,毒性极低,但经HOC工艺处理后水体的毒性都较强,所以投加混凝剂对毒性强弱的影响很小。由图4(b)可知,有机物浓度相同的二级出水经单独臭氧氧化处理后,初始Br浓度高的水体毒性明显较高,表明有机物浓度对毒性强弱的影响较小。如图4(c)所示,高浓度(100μg/L)溴酸盐的急性毒性较高,对发光细菌的抑制率达到了25.13%,而低浓度的溴酸盐的毒性几乎为0,说明溴酸盐浓度变化能够引起急性毒性的变化。综上可知,BrO3-消毒副产物是影响毒性强弱的主要原因。
2.2 HOC工艺中溴酸盐的生成特性
2.2.1 不同反应条件对溴酸盐生成的影响
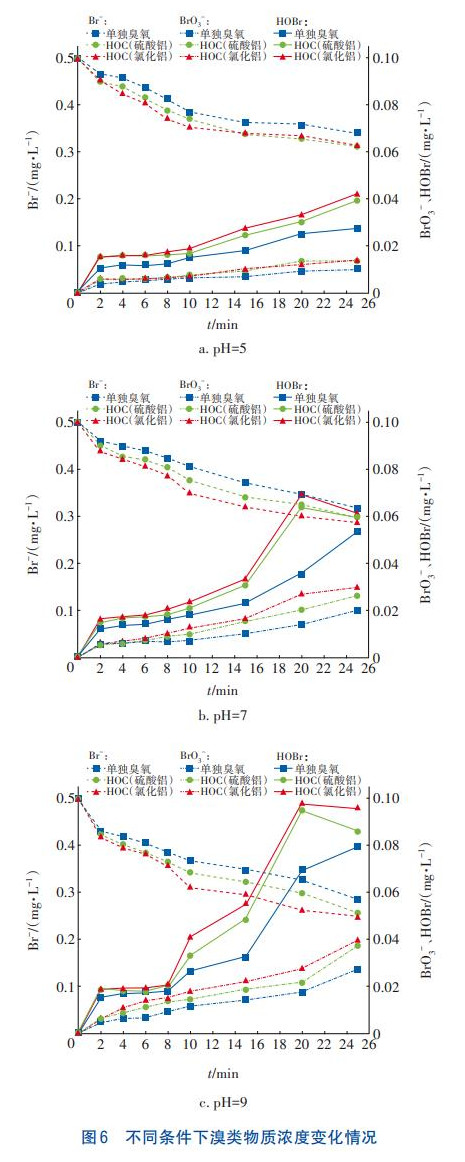
在不同pH和臭氧投加量下,采用三种工艺分别处理纯水与二级出水10min,BrO3-的生成情况见图5。可知,BrO3-的生成量随着pH的增加与臭氧投加量的增加而逐渐升高。氧化剂含量是BrO3-生成量的主要影响因素,臭氧投加量的增加与pH升高会影响臭氧的自分解反应,有利于臭氧分解产生更多的·OH,进而促进BrO3-的生成。通过对比可知,HOC工艺中的BrO3-生成量明显大于单独臭氧氧化工艺,且HOC工艺(氯化铝)大于HOC工艺(硫酸铝),这是因为HOC工艺中混凝剂通过水合作用在其表面产生大量羟基官能团,其中氯化铝产生的表面羟基更丰富,能生成更多的·OH。

对比纯水体系,二级出水体系中BrO3-的生成量明显减少,这是由于二级出水中的有机物与Br存在竞争关系,抑制了BrO3-的生成。HOC工艺处理二级出水时臭氧投加量不宜过高,当投加量低于2.0mg/mg时BrO3-的生成量相对较低。《生活饮用水卫生标准》(GB5749—2006)规定BrO3-浓度不高于10μg/L,在pH=5条件下采用HOC工艺处理二级出水时,BrO3-的生成量可以满足GB5749—2006的要求,当pH=7和9时仍需要通过控制其他反应条件来保证HOC工艺出水水质的安全性。
2.2.2 溴酸盐生成途径
在HOC工艺处理二级出水过程中,通过测定Br的剩余量、BrO3-的生成量和中间产物HOBr/OBr-的生成量,分析其中的变化关系,研究BrO3-的生成途径,结果如图6所示。可知,随着反应的进行,Br浓度逐渐降低;HOBr浓度在前8min左右较为稳定,在10~20min快速增加,到25min时略微降低;BrO3-浓度在前8min左右较低,后期缓慢增加。结合图2中有机物去除率在8min时出现拐点,可以推测在HOC工艺反应前期,有机物通过与Br竞争氧化剂并与HOBr/OBr-反应生成有机溴化物,来有效控制中间产物HOBr/OBr-的浓度,从而阻塞BrO3-的生成路径。由图5可知,在pH=7和9条件下,HOC处理二级出水过程中BrO3-超标,通过图6可以确定使BrO3-浓度满足国家标准的HOC工艺允许反应时间,在pH=7条件下,HOC工艺(硫酸铝)反应时间不超过10min、HOC工艺(氯化铝)反应时间不超过8min;在pH=9条件下,HOC工艺(硫酸铝)反应时间不超过6min、HOC工艺(氯化铝)反应时间不超过4min。
2.3 HOC工艺中溴酸盐生成的贡献率
在HOC工艺中,Br通过臭氧直接氧化与羟基自由基间接氧化两种途径生成BrO3-消毒副产物,为此,在pH=7条件下研究两种途径对BrO3-生成的贡献率。Elvoitz和vonGunten定义了一个臭氧氧化过程的参数Rct,如式(1)所示,它表示某时间段内·OH暴露量(dt)与O3暴露量(dt)的比值,Rct可通过式(2)计算。通过分析臭氧自分解反应一级动力学方程,并以p-CBA作为探针物质测定·OH的生成量,可以计算得到HOC体系反应过程中的Rct值,结果如图7(a)和(c)所示。可知,Rct的数量级为10-9~10-8,在反应过程中,Rct先迅速下降而后逐渐趋于稳定,与Elovitz等人的研究结果类似。Rct可量化臭氧氧化过程中·OH的贡献,计算HOC工艺中臭氧氧化和·OH氧化对BrO3-生成的贡献率f(O3)和f(·OH)。Br-被·OH氧化的百分比(fBr-,·OH)可由式(3)计算,Br被臭氧氧化的百分比fBr-,O3=1-fBr-,·OH。根据vonGunten等的研究可以得到kBr-,•OH和kBr-,O3的值,将Rct·代入到中,得到式(4),据此可以计算得到fBr-,·OH。纯水和二级出水体系中·OH和O3对溴酸盐生成的贡献率计算结果如图7(b)和(d)所示。

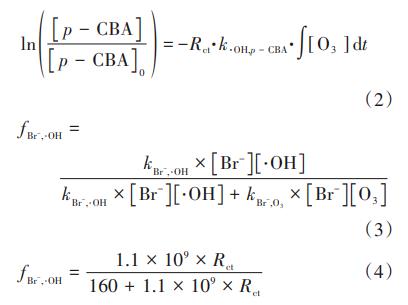
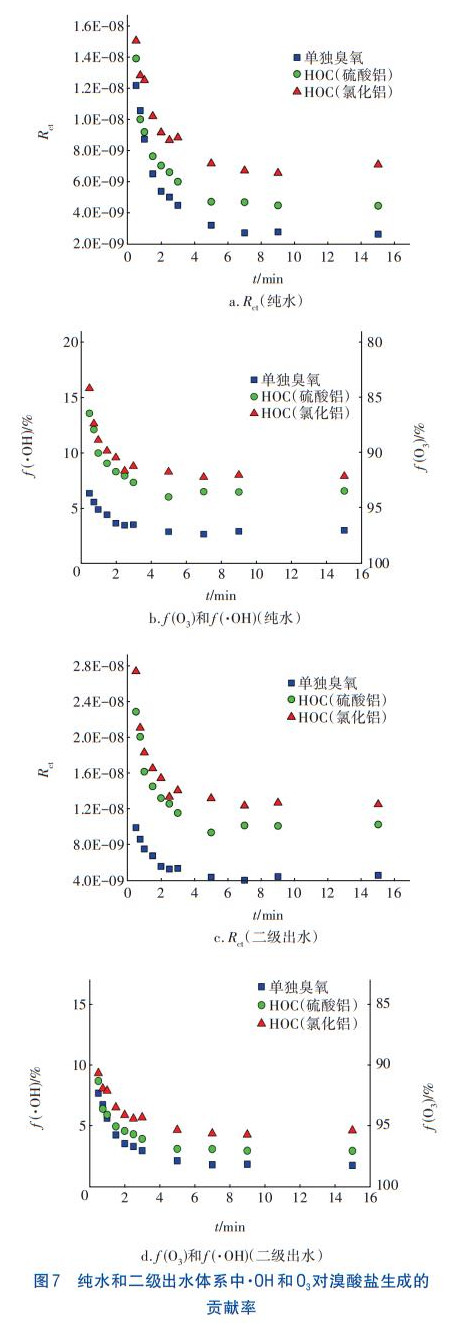
由图7可知,HOC工艺的(·fOH)大于单独臭氧氧化工艺,这是因为HOC工艺中p-CBA的去除率更高,即·OH的生成量更多。在反应初始阶段,HOC工艺的(fO3)均在80%以上,这与O3暴露浓度较高有关,且(fO3)随着氧化时间的延长而逐渐增大直至保持稳定,这与Qi等人的研究结果类似。通过对比可知,二级出水体系的(fO3)普遍比纯水体系的高,这可能是由于有机物的存在增加了O3的消耗,提高了Rct值。当HOC工艺处理二级出水5min时,(fO3)达到95%以上,说明在Br的后半段氧化反应中,O3起到至关重要的作用,比如,O3与HOBr/OBr-反应生成BrO3-。因此,在HOC工艺中,臭氧直接氧化比·OH间接氧化对BrO3-的生成有更为重要的作用。
3、结论
①HOC工艺对二级出水中的有机物去除效果较好,然而BrO3-消毒副产物的生成会导致水体的急性毒性增强。在HOC工艺中,pH与臭氧投加量的增加会促进臭氧分解生成·OH,从而导致BrO3-生成量的增加,而二级出水中的有机物对BrO3-的生成具有明显抑制作用。
②HOC工艺处理二级出水的最优条件如下:pH=7、臭氧投加量为1.0mg/mg、混凝剂采用氯化铝且投加量为15mg/L(以Al计)、反应时间为8min,在此条件下有机物去除率在30%以上,且BrO3-生成量满足《生活饮用水卫生标准》(GB5749—2006)的要求。
③在HOC工艺处理二级出水过程中,臭氧氧化是BrO3-生成的主要途径,臭氧氧化的贡献率随着反应的进行先快速升高然后保持稳定,且均在90%以上。(来源:西安建筑科技大学环境与市政工程学院,成都市市政工程设计研究院有限公司,西安交通大学人居环境与建筑工程学院)



