1 引言
铅铋冷却反应堆是加速器驱动次临界系统的首选堆型, 相比于水冷堆及钠冷堆, 铅铋反应堆具有其固有的安全特性.俄罗斯、美国、日本、欧盟及中国等均已开展了相关研究工作, 但铅铋冷却反应堆同时也面临210Po这一重要的辐射安全防护问题.210Po具有放射性且极毒, 国际放射防护委员会规定人体对210Po的一次最大允许摄入量仅为0.74 kBq.计算结果显示, 15 MW靶回路运行一年后预计产生的210Po放射性活度约为104 Ci.若对核事故条件下产生的含210Po废水不进行处理直接排放, 将会对生态环境和人体健康将构成潜在的严重威胁.因此, 含Po放射性废水的净化研究就显得尤为重要.
氧化石墨烯(GO)具有比表面积大、耐辐照、化学性质稳定和表面官能团丰富等优势, 是放射性核素吸附研究的理想滤材.Zhao等(通过研究发现, GO对U(Ⅵ)的最大吸附量达111.7 mg·g-1, 显著高于其它吸附剂.目前, 通过不同化学修饰手段, 制备对某种放射性核素具有强选择吸附能力的复合材料是GO吸附研究的主要方向.有研究表明, 利用壳聚糖、偕胺肟官能团和硫醇基等对GO进行改性后制备的复合材料分别对Cu2+、Pb2+、U(Ⅵ)、Hg2+等有毒及放射性金属具有良好的吸附效果.但到目前为止, 有关GO吸附Po(Ⅳ)的机理研究还鲜有报道.因此, 研究GO吸附Po的性能及机制, 尤其是含氧官能团对Po的吸附作用, 对石墨烯基材料改性制备吸附能力突出的复合材料具有重要的指导意义.
在自然水环境中, Po主要以Po(Ⅳ)形式存在, 其与Te(Ⅳ)化学行为的相似性也在之前的研究中有过报道.基于此, 本文以Te(Ⅳ)代替Po(Ⅳ), 首先研究氧化石墨烯对碲的吸附性能, 其次, 利用常见的吸附动力学和吸附等温线模型对GO吸附Te(Ⅳ)的动力学数据和吸附平衡数据进行拟合, 初步预测GO吸附Te(Ⅳ)的行为;在此基础上, 利用TEM、FTIR和XPS等表征方法对吸附前后的GO进行分析, 揭示GO吸附Te(Ⅳ)所涉及的机制.
2 材料与方法2.1 实验材料
氢氧化钠为分析纯级, 购自国药化学试剂有限公司;去离子水的电阻率为18.25 MΩ;GO购自南京先丰纳米材料科技有限公司, 电导率为0.034 S·m-1, 片径为0.5~5 μm, 厚度为0.8~1.2 nm;5 N超细Te粉购自国药化学试剂有限公司.
称取0.505 g GO于50 mL烧杯内, 加入30 mL去离子水, 在40 kHz下超声处理30 min后, 转入250 mL容量瓶, 并使用去离子水定容, 得到浓度为2 mg·mL-1的GO溶液, 保存于冰箱中备用;取0.50 g超细Te粉于50 mL烧杯中, 加入少量浓硝酸, 搅拌至完全转变为白色沉淀后, 加入少量浓盐酸, 在60 ℃下反复加热蒸发, 直至无棕色气体溢出, 蒸发至近干, 并用1 mol·L-1 HCl溶液定容至500 mL, 得到1 mg·mL-1的Te(Ⅳ)储备液, 实验中逐级稀释至100 μg·mL-1.
2.2 吸附实验
在吸附时间影响实验中, 向10 mL聚乙烯离心管内加入0.7 mL 100 μg·mL-1的Te(Ⅳ)储备液后, 加入5 mL去离子水, 使用微量NaOH溶液调节pH至预定值, 放入水浴恒温摇床, 在30 ℃、160 r·min-1下预平衡30 min后, 加入1.3 mL 2 mg·mL-1的GO溶液, 继续在恒温摇床内反应至预定时间之后, 反应混合液在15000 r·min-1下离心10 min, 取上清液, 利用TeBr4分光光度法分析水中残余Te(Ⅳ)浓度.
对于pH值和GO浓度影响的实验, 实验过程与吸附时间实验相同, 其它条件固定, 仅分别调节两实验pH值和GO浓度在2.0~10.0和0.05~0.60 g·L-1范围内变化.值得注意的是, 在GO浓度影响的实验中, 为确定GO与Te(Ⅳ)的最佳浓度比, 同时设置了两批Te(Ⅳ)浓度不同的实验.
以上各批次实验重复3次, 每次实验同时设置对照实验, 以确定吸附体系初始Te(Ⅳ)浓度和排除聚乙烯离心管壁对水中Te(Ⅳ)的吸附.
2.3 分析与表征
使用Tecnai G2 F20 S-TWIN型配置能谱仪的透射电子显微镜(TEM-美国FEI公司)分析吸附前后样品表面微观形貌, 加速电压为120 kV;采用Nicolet 8700型傅里叶转换红外线光谱分析仪(FTIR-美国热电尼高力公司)对吸附前后GO的微观结构进行表征;使用ESCALAB 250型X射线光电子能谱仪(XPS-美国热电)分析吸附前后GO表面元素及价态, 激发光波长为633 nm.
3 结果与讨论 3.1 GO对Te(Ⅳ)的吸附性能
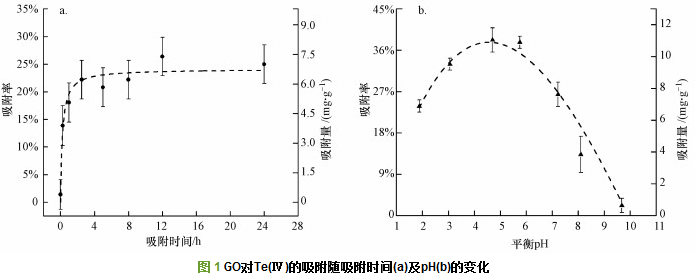
在Te(Ⅳ)浓度10 μg·mL-1、pH=1.9±0.3、GO浓度0.37 g·mL-1的条件下, GO对Te(Ⅳ)的吸附量随时间的变化如图 1a所示.在前15 min内, GO对Te(Ⅳ)的吸附率随吸附时间增加而急剧上升, 达到13.9%±3.6%.随着吸附时间进一步增加, 吸附率的上升速率变缓, 这种变化趋势在吸附1 h后更加明显.2.5 h后, GO对Te(Ⅳ)的吸附达到饱和, 吸附率基本不变, 为22.2%±3.5%.根据上述实验现象, 可将GO吸附水中Te(Ⅳ)的过程大致分为3个阶段, 即前期15 min内的快速吸附阶段、稍后的缓慢吸附阶段和吸附2.5 h后的饱和阶段.
该实验现象是吸附剂表面吸附位点随吸附时间逐渐较少的结果, 在GO刚开始接触Te(Ⅳ)离子时, GO表面存在大量的吸附活性位点, 水溶液中的Te(Ⅳ)离子可快速与这些吸附位点结合, 吸附速率较大, 吸附率快速上升.随着吸附的进行, 吸附剂表面绝大部分吸附位点占据, 可用于结合Te(Ⅳ)离子的“空”活性位点逐渐减少, 水溶液内Te(Ⅳ)离子间对吸附位点的竞争吸附作用增加, 导致吸附速率减小, 吸附率缓慢上升, 并在吸附剂表面“空”活性位点被完全占据时达到饱和.通过上述实验结果, 确定5 h为后续实验的平衡吸附时间.
pH值是影响重金属离子吸附的最关键因素之一.图 1b所示为pH对GO吸附Te(Ⅳ)的影响, 由图可知, pH=1.9时, GO对Te(Ⅳ)的吸附率仅为23.8%±1.3%.此后, 随着pH值增加, GO对Te(Ⅳ)的吸附率相应上升, 并在pH=4.7±0.2时达到最大, 约为38%, 该实验现象是水溶液内H+、重金属离子与吸附位点亲合力随pH变化的结果.吸附体系的pH值不仅可以影响吸附剂表面吸附位点的状态, 也在很大程度上影响着重金属离子的水溶液化学行为:如水解、有机/无机配体的络合、氧化还原反应、沉淀及种态形成等.Ayala等认为在pH < 2的稀Te(Ⅳ)水溶液中, [Te(OH)3]+含量最为显著, pH > 4时, [TeO(OH)]+含量在各Te(Ⅳ)离子种态中占据主导地位, pH > 8时, [TeO2(OH)2]2-则成为水溶液中的主要Te(Ⅳ)种态.同时, 在pH=0.7~8.7的范围内, 水溶液中相当一部分Te(Ⅳ)会转变为TeO2·nH2O白色沉淀, 且含量在pH=4~5范围内达到最大.据此可得, pH较低时, H+与官能团结合, 导致含氧官能团带正电, 与金属阳离子间存在静电排斥作用, 导致吸附率较低;随着pH增加, H+减少, 官能团负电荷增加, 逐渐增大的静电引力导致吸附率逐步上升;当pH=4.7时, GO对Te(Ⅳ)的吸附与TeO2·nH2O沉淀共同作用导致吸附率最大.
当pH高于4.7以后, GO对Te(Ⅳ)的吸附率随pH的增加反而下降, 在pH=9.7时降至2.2%±1.5%, 这是因为水中Te(Ⅳ)溶解度增加, 沉淀对吸附百分数的贡献逐渐减弱.当pH继续增加至8.0以上, 水溶液中Te(Ⅳ)主要以阴离子形式存在, GO表面去质子化后的负电性吸附位点与Te(Ⅳ)阴离子种态之间的静电排斥作用和Te(Ⅳ)溶解度的增加成为吸附率继续下降的主要原因.本实验确定4.7为后续实验的pH值.
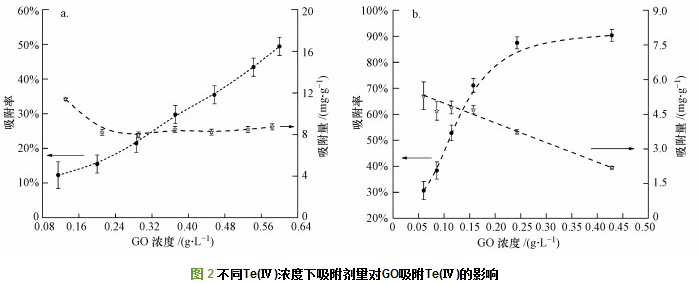
在吸附时间5 h、pH=4.5±0.3、Te(Ⅳ)浓度为10 μg·mL-1的条件下, GO浓度对Te(Ⅳ)吸附的影响如图 2a所示.GO浓度为0.11 g·L-1时, 吸附率仅为12.7%±3.8%, 随着GO浓度增加, 吸附率近似线性上升, 并在0.60 g·L-1时达到49.4%±2.6%, 这是吸附位点随GO投入量增加而增多的结果.但由于水中Te(Ⅳ)离子量相对于GO过量, 所以每克GO上吸附的Te(Ⅳ)量不变.
在Te(Ⅳ)浓度为1 μg·mL-1的条件下, GO浓度对Te(Ⅳ)吸附的影响如图 2b所示.在0.05~0.20 g·L-1的范围内, 吸附率随GO浓度增加近似线性上升, 此后, 上升趋势变缓, 并在0.30 g·L-1时达到恒定, 吸附率为85.0%±7.6%, 对应吸附量为(2.9±0.5) mg·g-1.该实验现象是吸附体系吸附剂相对于吸附质逐渐过量的结果, 当GO浓度> 0.2 g·L-1时, 吸附体系Te(Ⅳ)离子相对于GO不足, 随GO投入量增加, 溶液中可用于吸附的Te(Ⅳ)离子数逐渐减少, 吸附率上升趋势变缓, 并在其被完全吸附时达到恒定.与此同时, 吸附剂逐步过量也导致平均每克GO对Te(Ⅳ)的吸附量逐渐下降(图 2b).由述实验确定Te(Ⅳ)浓度与吸附体系GO浓度的最佳比值为5.0 mg·g-1.
3.2 吸附动力学与吸附等温线研究
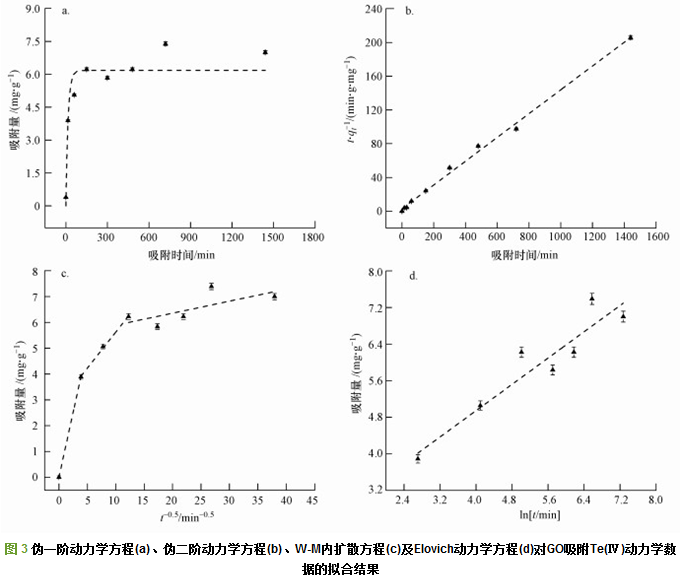
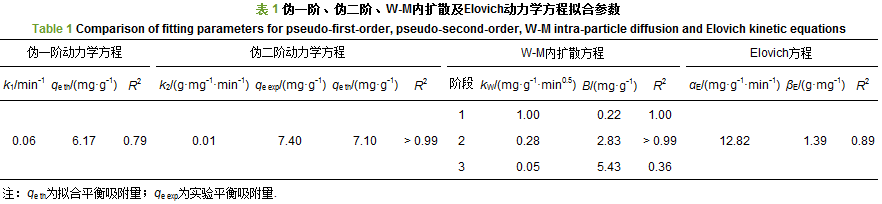
在30 ℃、pH=4.7±0.2、Te(Ⅳ)浓度10 μg·mL-1、GO浓度2 g·L-1的条件下, 采用伪一阶动力学方程、伪二阶动力学方程、Weber-Morris粒子内扩散方程(W-M内扩散方程)和Elovich吸附动力学方程对GO吸附Te(Ⅳ)的动力学数据进行拟合, 结果如图 3所示, 拟合参数如表 1所示.GO吸附Te(Ⅳ)的动力学数据明显偏离伪一阶动力学拟合曲线, 尤其在吸附后期(图 3a), 拟合可决系数仅为0.79, 表明GO吸附Te(Ⅳ)的动力学过程并不符合伪一阶动力学过程.采用伪二阶动力学方程描述GO吸附Te(Ⅳ)的动力学数据(图 3b)时, 拟合可决系数好于0.99, 理论平衡吸附量为7.10 mg·g-1, 接近于实验平衡吸附量值7.40 mg·g-1, 表明GO对Te(Ⅳ)的吸附以化学作用为主.伪二阶动力学模型涵盖了外部液膜扩散、颗粒内扩散和表面活性基吸附等过程, 为确定GO吸附Te(Ⅳ)的限速步骤和GO表面状态, 进一步采用W-M粒子内扩散方程和Elovich动力学方程对GO吸附Te(Ⅳ)的动力学数据进行拟合.
W-M内扩散方程对GO吸附Te(Ⅳ)动力学数据的拟合结果显示(图 3c), 吸附量qt随t0.5的变化呈3个阶段:第1阶段吸附过程较快, 动力学拟合曲线线性关系良好, 且非常接近原点, 表明该阶段吸附限速步骤为离子内扩散;第2阶段的吸附速率较第1阶段有所下降, 动力学拟合曲线不再通过原点, 截距增加至2.83, 说明膜扩散逐渐成为GO吸附Te(Ⅳ)的限速步骤;在第3阶段, 吸附速率进一步下降, 直线截距进一步增加, 吸附动力学数据与拟合曲线变化趋势一致, 但拟合可决系数较低, 这是水中大部分Te(Ⅳ)去除和吸附体系固相浓度作用的结果.
Elovich动力学方程对GO吸附Te(Ⅳ)动力学数据的拟合结果如图 3d所示, 吸附前期, 吸附动力学数据符合Elovich动力学方程, 但吸附后期动力学数据点明显偏离该方程拟合曲线, 表明随着吸附的进行, GO表面吸附能趋于均质分布.
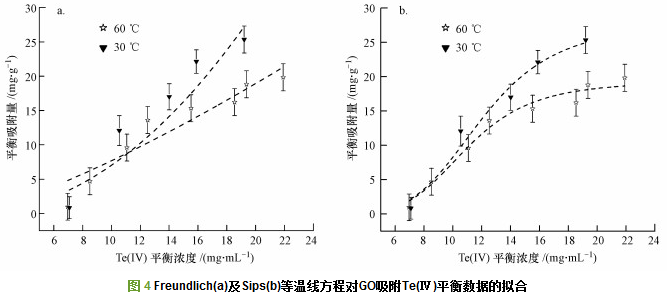
在30 ℃和60 ℃下, 采用Freundlich方程和Sips方程对GO吸附Te(Ⅳ)的平衡数据进行拟合, 结果见图 4.平衡吸附量qe随Te(Ⅳ)平衡浓度Ce的增加而上升, 且这种上升趋势随Te(Ⅳ)平衡浓度的增加而逐渐变缓, 尤其是60 ℃下的吸附平衡数据.Freundlich方程对GO吸附Te(Ⅳ)平衡数据的拟合曲线呈凹形, 与实验数据的总体变化趋势相反, 而Sips方程的拟合曲线则符合平衡数据变化的总体趋势.
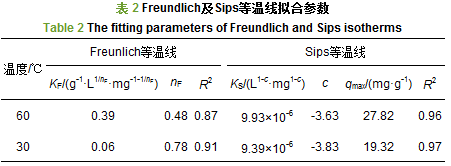
Freunlich方程和Sips方程对两种温度下GO吸附Te(Ⅳ)平衡数据的拟合参数如表 2所示.Freunlich方程对60 ℃和30 ℃下吸附平衡数据的拟合可决系数分别为0.87和0.91, Sips方程的拟合可决系数则分别为0.96和0.97, 优于Freunlich方程, 进一步表明相比于Freunlich等温线方程, Sips等温线方程更适合于描述GO吸附Te(Ⅳ)的平衡数据.Sips方程拟合结果显示, 30 ℃和60 ℃下GO对Te(Ⅳ)的最大饱和吸附量分别为19.32 mg·g-1和27.82 mg·g-1, 普遍低于GO对Cu(Ⅱ)、Zn(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)、Au(Ⅲ)等重金属离子的饱和吸附量值相应的, Freundlich方程的拟合参数nF值也不同于与文献中报道的1 < nF < 10, 反而小于1.说明GO对Te(Ⅳ)的吸附作用较弱, 这是导致吸附量偏低的主要原因.
值得注意的是, Sips方程的拟合参数c较大, 表明GO吸附Te(Ⅳ)的平衡数据完全不符合Langmuir方程, 该结果与Sitko等的研究结果不符, 表明GO表面各吸附位点不均匀, 对Te(Ⅳ)的吸附为非单层吸附, 且吸附的Te(Ⅳ)离子间也存在相互作用.
3.3 吸附机理分析
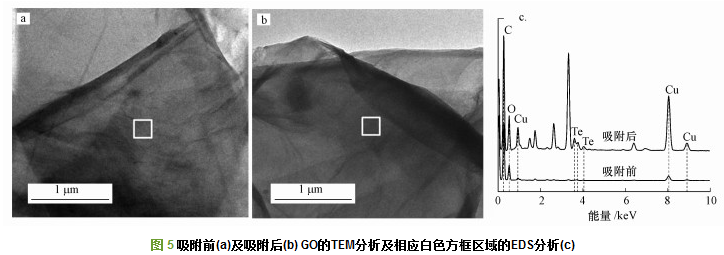
在Te(Ⅳ)浓度10 μg·mL-1、pH=4.7的条件下, 采用TEM及EDS对吸附前后的GO进行表征, 结果如图 5a和5b所示.由图可知, 吸附前后的GO微观形貌无明显变化.为确定GO表面Te(Ⅳ)的附着, 分别对吸附前后GO表面白色方框区(图 5a、5b)进行EDS分析, 结果如图 5c所示, 吸附后的GO能谱中出现明显的Te特征峰, 直观地证明了GO对Te(Ⅳ)的吸附.
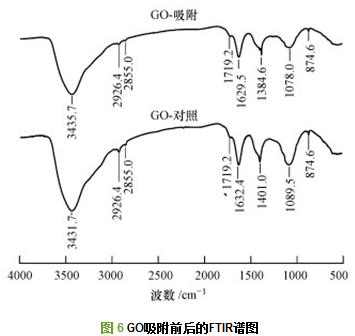
图 6为吸附和对照实验中GO的FTIR谱图.对于无Te(Ⅳ)吸附的GO, 位于3431.7、2926.4/2855.0、1719.2、1632.4、1401.0和1089.5 cm-1处的吸收峰分别对应于O—H(羟基)伸缩振动、CH/CH2(亚甲基)振动、C=O(羰基/羧基)伸缩振动、C=C伸缩振动、C—OH(羧基)弯曲振动和C—O—C(环氧基)伸缩振动.吸附Te(Ⅳ)后, 3431.7、2926.4、2855.0和1719.2 cm-1等峰位置不变, 而位于1632.4、1401.0和1089.5 cm-1处的峰则分别迁移至1629.5、1384.6和1078.0 cm-1处, 表明环氧基、羧基等含氧官能团和氧化石墨烯苯环结构对Te(Ⅳ)吸附具有重要作用.
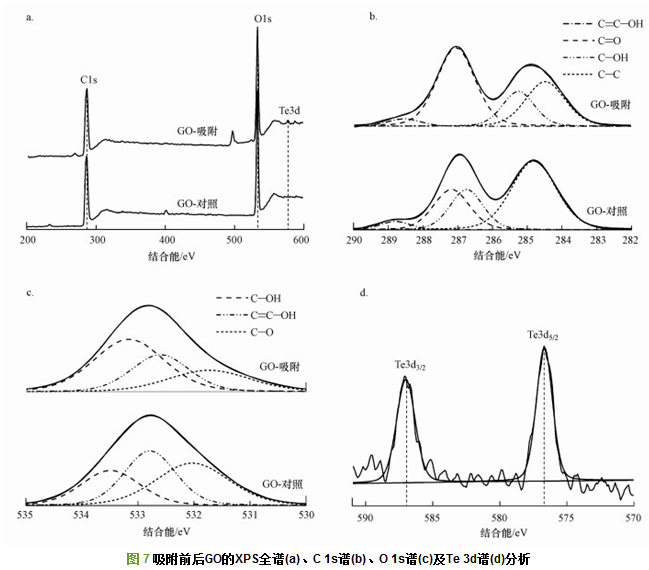
采用XPS对吸附前后的GO进行分析, 结果如图 7所示.由图 7a可知, 在200~600 eV范围内, GO的XPS全谱仅在285和573 eV处出现C 1s和O 1s峰, 吸附后, 除这两个能峰, 577.0 eV左右出现新的能峰, 对应于Te 3d结合能, 再次证明Te(Ⅳ)吸附于GO表面.
图 7b为吸附前后GO C1s区的XPS谱, 扣除Shirley本底后, 对该能谱进行反卷积分析, 最优分析结果显示, C1s谱可使用4条曲线进行拟合, 结合能依次为284.8、286.7、287.2和288.8 eV, 分别对应于C—C/C=C、C—OH、C=O及O=C—OH结构.吸附后GO的C1s谱形及峰位发生明显变化, C—C/C=C峰强减弱, C=O峰强明显增加, 且C—OH、C=O和O=C—OH峰分别迁移至285.5、287.0和288.5 eV处.与此相对应, 吸附前后GO的O1s谱也发生严重变化, 如图 7c所示,吸附后, C=O和O=C—OH峰的相对强度减弱, 而C—OH峰的相对强度增加, 且峰位别由532.1、532.8、533.5 eV迁移至531.8、532.6和533.2 eV.吸附前后C1s及O1s谱的上述变化为GO表面含氧官能团Te(Ⅳ)吸附提供了直接证据.图 7d为吸附后GO在Te 3d区的高分辨XPS谱, 反卷积分析结果显示, 吸附后的GO在576.7和587.0 eV出现能峰, 两峰间隙为10.3 eV, 分别为Te(Ⅳ)的3d5/2和3d3/2结合能, 说明GO对Te(Ⅳ)的吸附作用并不改变其化学价态.
4 结论
1) GO对Te(Ⅳ)的吸附性能良好, 吸附平衡时间为2.5 h, pH值为4.7时吸附效果最好, 当Te(Ⅳ)浓度为1 μg·mL-1、GO浓度为0.03 g·L-1时, 吸附率达到85.0%±7.6%.
2) 伪二阶动力学方程和Sips等温模型能很好地描述GO吸附Te(Ⅳ)过程.GO表面各吸附位点并不均匀, 其对Te(Ⅳ)的吸附以弱化学作用为主, 且随着吸附的进行, 吸附限速步骤由初始时期的内扩散逐渐转变为膜扩散, 非均质吸附表面逐渐转变为均质吸附表面.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
3) TEM-EDS、FTIR及XPS分析结果表明, 羧基、环氧基和C=C对GO吸附Te(Ⅳ)具有重要作用, 但该作用过程并不改变Te(Ⅳ)化学价态.