重金属废水的常规处理方法主要包括:化学沉淀法、离子交换法、蒸发浓缩法、电解法、活性炭和硅胶吸附法和膜分离法等,但这些方法存在去除不彻底、费用昂贵、产生有毒污泥或其他废料等缺点。因此,人们一直致力于研究与开发高效环保型的重金属废水处理技术和工艺。微生物处理法是利用细菌、真菌(酵母)、藻类等生物材料及其生命代谢活动去除和(或)积累废水中的重金属,并通过一定的方法使金属离子从微生物体内释放出来,从而降低废水中重金属离子的浓度。近年来,国际上在微生物处理重金属废水的研究中取得了较多成果,该技术在投资、运行、操作管理和金属回收、废水回用等方面优越于传统的治理方法,展现出广阔的应用前景。我国在微生物处理废水重金属这方面的研究尚处于起步阶段,因此,本文就微生物处理重金属废水的机理及其影响因素做一概述,以期促进国内该领域的研究。
1 微生物处理重金属废水的机理
1.1 微生物对重金属的吸附作用
微生物的吸附作用是指利用某些微生物本身的化学成分和结构特性来吸附废水中的重金属离子,通过固液两相分离达到去除废水中的重金属离子的目的。生物吸附剂为自然界中丰富的生物资源,如藻类、地衣、真菌和细菌等。微生物结构的复杂性以及同一微生物和不同金属间亲和力的差别决定了微生物吸附金属的机理非常复杂,至今尚未得到统一认识。根据被吸附重金属离子在微生物细胞中的分布,一般将微生物对金属离子的吸附分为胞外吸附、细胞表面吸附和胞内吸附。
1.1.1 胞外吸附
一些微生物可以分泌多聚糖,糖蛋白,脂多糖,可溶性氨基酸等胞外聚合物质(extracellular polymeric substances,EPS),EPS具有络合或沉淀金属离子作用。如蓝细菌能分泌多糖等胞外聚合物,一些白腐真菌可以分泌柠檬酸(金属螯合剂)或草酸(与金属形成草酸盐沉淀)。Suh等研究发现,当茁芽短梗霉(Aureobasidium pullulans)分泌EPS 时,Pb2+便积累于整个细胞的表面,且随着细胞的存活时间增长,EPS的分泌量增多,积累于细胞表面的Pb2+水平就越高,从最初的56.9 上升到215.6mg/g(干重);当把细胞分泌的EPS提取出来后,Pb2+便会渗透到细胞内,但Pb2+的积累量显著减少( 最高量仅为35.8mg/g 干重)。
1.1.2 细胞表面吸附
细胞表面吸附是指金属离子通过与细胞表面,特别是细胞壁组分( 蛋白质、多糖、脂类等) 中的化学基团( 如羧基、羟基、磷酰基、酰胺基、硫酸脂基、氨基、巯基等) 的相互作用,吸附到细胞表面。如将酵母细胞壁上氨基,羧基,羟基等化学基团进行封闭,则会减少其对Cu2+的吸收量,表明这些基团在结合Cu2+方面具有重要的作用,这也间接证明了细胞壁上蛋白质和糖类在生物吸附中的作用。
金属离子被细胞表面吸附的机制包括离子交换、表面络合、物理吸附(如范德华力、静电作用)、氧化还原或无机微沉淀等。不同的微生物对不同金属的吸附作用机制不同(表1)。Kratochvil等认为,离子交换是许多非活性真菌和藻类吸附金属离子的主要机理,主要是细胞表面的羧基,其次是硫酸脂基和氨基在生物吸附中发挥了重要作用。Davis等也认为离子交换是褐藻吸附金属离子的主要机制,特别是以前被认为的物理和化学的结合机制都可以用离子交换来解释。细胞表面功能基团中的氮、氧、硫、磷等原子,可以作为配位原子与金属离子配位络合。例如Zn、Pb可以与产黄青霉(P. chrysogenum) 表面的磷酰基和羧基形成络合物,溶液中的阴离子(EDTA、SO42-、Cl- 、PO33-等)可以与细胞竞争重金属阳离子,形成络合物,从而降低产黄青霉对Zn、Pb的吸附量,这也间接地说明细胞表面对金属离子的吸附确实存在络合机制。关于氧化还原和无机微沉淀的机制也有少量报道。如Lin采用X 射线衍射(XRD)、红外光谱(IR)以及光电子能谱(XPS)技术,研究了废弃酵母吸附Au3+的过程,发现还原性糖(细胞壁肽聚糖层的多糖水解产物) 半缩醛基团中的自由醛基,可以作为电子供体,将Au3+原位还原为Au0。

1.1.3 胞内吸附与转化
一些金属离子能透过细胞膜,进入细胞内。金属离子进入细胞后,微生物可通过区域化作用(compartmentalization)将其分布于代谢不活跃的区域(如液泡),或将金属离子与热稳定蛋白结合,转变成为低毒的形式。如活酵母吸收的Sr、Co 离子积累于液泡中,而Cd和Cu 离子位于酵母的可溶性部分(soluble fraction);同时液泡缺陷型酵母对Zn、Mn、Co、Ni 离子的敏感性增加,吸附量降低;但其对Cu 和Cd 离子的吸附与野生型则没有明显的区别。Vijver认为细胞的区域化作用主要有两种类型:形成明显的包含体和重金属与热稳定蛋白结合,后者主要指金属硫蛋白(metallothioneins,简称MT)。金属硫蛋白的分子量低(2000~10000kDa),富含半胱氨酸,可被金属Cd、Cu、Hg、Co、Zn 等诱导,并与这些金属结合。此外,谷胱甘肽(GSH)、植物凝集素(phytochelatins)和不稳定硫化物(labile sulfide) 也具有储备、调节和解毒胞内金属离子作用。GSH 是典型的低分子量硫醇,富含半胱氨酸残基和组氨酸残基,是对金属离子有高度的亲和力的肽链,因此具备金属解毒功能。目前,利用生物工程技术,在微生物细胞内表达金属结合蛋白或金属结合肽,从而制备全细胞工具(whole cell tools)来分离废水中重金属方面的研究日益受到关注。
1.2 微生物对重金属的沉淀作用
微生物对重金属离子的沉淀作用,一般认为是由于微生物对金属离子的异化还原作用或是由于微生物自身新陈代谢的结果。一方面,一些微生物可分泌特异的氧化还原酶,催化一些变价金属元素发生氧化还原反应,或者其代谢产物或细胞自身的某些还原物直接将毒性强的氧化态的金属离子还原为无毒性或低毒性的离子;另一方面,一些微生物的代谢产物(硫离子、磷酸根离子)与金属离子发生沉淀反应,使有毒有害的金属元素转化为无毒或低毒金属沉淀物(表2)。
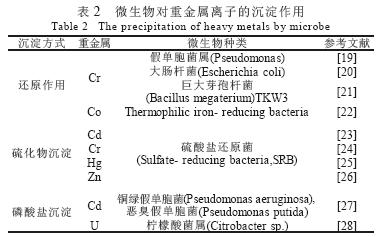 |
1.2.1 还原作用
一些微生物在其生长代谢过程中,可分泌特异的氧化还原酶,催化一些变价金属元素发生氧化还原反应,使金属离子的溶解度或毒性降低(表2)。例如,许多好氧和厌氧微生物能将如Cr6+还原为Cr3+ ,在好氧条件下,Cr6+的生物还原作用主要受可溶性酶催化,但嗜麦芽假单胞菌( Pseudomonas maltophilia)O-2 和巨大芽孢杆菌TKW3 除外,其催化Cr6+还原为Cr3+的酶为膜结合还原酶。近年来,分别已从恶臭假单胞菌MK1 和大肠杆菌纯化了ChrR 和YieF 两种可溶性Cr6+还原酶,其中ChrR 催化一个电子转运,形成中间产物Cr5+和(或)Cr4+,进一步转运两个电子,形成Cr3+;而YieF 转运四个电子,直接将Cr6+还原为Cr3+。研究者也已从巨大芽孢杆菌TKW3中分离出膜结合的Cr6+还原酶,但对其还原动力学过程还不清楚。在厌氧条件下,可溶性酶和膜结合还原酶均可催化Cr6+还原为Cr3+,Cr6+作为电子转运链中的电子受体,且细胞色素(如细胞色素a和细胞色素b)参与此氧化还原过程。同时可以查看中国污水处理工程网更多技术文档。
另外,一些微生物的代谢产物或细胞自身的某些还原物将毒性强的氧化态的金属离子还原为无毒性或低毒性的离子。例如,在硫酸盐还原菌体系中,Fe2+和S2-产物能间接地将Cr6+还原为Cr3+。一些Fe(III)同化微生物(如Geobacter metallireducens)可将U(VI)还原为U(IV),使U的溶解度降低,从而可达到去除废水中U的目的。
1.2.2 金属硫化物沉淀
在pH值为中性、一定的基质浓度和厌氧条件下,硫酸还原菌(SRB)能将硫酸根离子还原成硫离子,S2-与废水中的的Zn2+,Cd2+,Pb2+,Cu2+ 等发生沉淀反应,形成不溶性的金属硫化物,从而实现废水的净化处理。SRB广泛分布于自然界,典型的代表有脱硫弧菌(Desulfovibrio),脱硫微菌(Desulfomicrobium),脱硫杆菌(Desulfobacter),脱硫八叠菌(Desulfosarcina),脱硫肠菌(Desulfotomaculum),热脱硫杆菌(Thermodesulfobacterium),古球菌(Archaeoglobus)等。
SRB能在厌氧条件下将金属离子转化为硫化物沉淀,这对处理高浓度重金属废水有着非常重要的意义,而且利用共生的混合SRB菌株要比单一SRB菌株处理含重金属废水更有效率。然而,通常低浓度(20~200μm)的Cd2+、Zn2+、Ni2+等会对SRB 产生毒害作用,从而限制了SRB的广泛应用。通过基因过程手段,可将SRB 中的硫酸还原酶转移到其他环境菌中,使转化菌具有形成金属硫化物沉淀的能力。在这方面的首次努力的是将肠沙门氏菌(Salmonella enterica)体内的硫酸盐还原酶基因在大肠杆菌体内表达,表达后的大肠杆菌DH5α能够比控制在好氧或厌氧条件下的普通大肠杆菌产生更多的金属硫化物沉淀,且重组菌在厌氧条件下对高浓度水平(200mmol/L)Cd2+的去除率达到98%。
1.2.3 金属磷酸盐沉淀
磷酸盐是合成核酸、ATP 等重要生物分子所必需,通常生命体并不释放过量的磷酸盐。然而微生物可通过两条途径释放无机磷酸盐: 一些柠檬酸杆菌能分泌酸性磷酸酶,催化2- 磷酸甘油水解,释放无机磷酸盐,从而在细胞表面积累大量的磷酸盐,并与废水中的金属发生沉淀反应,形成金属磷酸盐沉淀。酸性磷酸酶催化的过程是与外膜和胞外的脂多糖(LPS)相偶联的,因为金属磷酸盐矿物的启动是从LPS 中的磷酸基团的核晶过程开始的,随着有机磷不断被酸性磷酸酶水解,释放出无机磷酸盐,金属磷酸盐晶体不断增大。Finlay 等研究发现,将柠檬酸菌细胞固定于生物膜反应器通过化学耦合可以去除>90%的金属U(以HUO2PO4形式沉淀);一些细菌释放无机磷酸盐并不依赖有机磷酸盐供体,而是加速细菌体内的磷酸盐循环,如约氏不动杆菌(Acinetobacter johnsonii)。在好氧条件下,细菌不断合成多磷酸盐,并作为其生长代谢的能源物质;在厌氧条件下,多磷酸盐被降解产生ATP,同时产生金属磷酸盐的沉淀。而且,一些金属离子(如Cd、UO22+) 能促进多磷酸盐的降解,产生更多的无机Pi。如通过控制大肠杆菌(E. coli)体内编码多磷酸盐激酶(polyphosphate kinase,ppk) 和多磷酸盐酶(polyphosphatase,ppx)的基因的共同表达,能降低细胞内多磷酸盐的水平和促进磷酸盐的分泌,从而增加大肠杆菌对金属的耐性。
2 影响微生物修复的因素
2.1 微生物的影响
2.1.1 微生物的种类
在微生物处理重金属废水过程中,不同微生物对同一种金属离子的去除效率不同。如表3所示,不同微生物对同一种金属离子的吸附量的差异显著。
 |
2.1.2 微生物的预处理
微生物的预处理是指在处理重金属废水之前,采用干燥、强酸和强碱溶液浸泡等物理或化学方法处理细胞。通常,预处理可提高微生物对重金属离子的去除能力和微生物的稳定性。如Cihangir等发现,干燥处理后的真菌凤尾菇(Pleurotus Sajorcaju)对废水中Cd2+的去除能力显著提高,且冷冻干燥的效果比烘箱干燥好。经过乙醇处理的废弃酵母细胞对废水中Cd2+和Pb2+的吸附量分别达15.63和17.49mg/g(干重),分别比对照增加了2倍和1倍。Celaya等发现,NaOH处理后的氧化亚铁硫杆菌(Thiobacillus ferrooxidans)对重金属离子的吸附量显著增加,其原因可能在于细胞表面的吸附位点的去质子化,从而增加金属离子的吸附位点。有废水需要处理的单位,也可以到污水宝项目服务平台咨询具备类似污水处理经验的企业。
2.1.3 微生物的存在状态
微生物的存在状态(游离的、被固定在载体上)对其处理重金属废水的效果具有显著影响。如游离的酵母细胞对Pb2+和Zn2+的吸附量分别为79.2和23.4mg/g(干重),而当用明胶载体固定后,其吸附量分别为41.9和35.3mg/g(干重)。采用固定化微生物细胞富集水体中的重金属,实际上起着生物离子交换树脂的作用,而且固定化细胞比离子交换更为经济,不受Ca2+、Mg2+、Na+和K+等离子的影响,在废水处理和受污染水环境的修复中更实用。
2.2 金属离子的影响
2.2.1 金属离子的种类
同一种微生物对不同金属离子的处理效果也不同。如在最优条件下,龟裂链霉菌对Zn、Cu 和Ni的吸收量分别为6.03、9.07和1.63mg/g(干重),泡叶藻对Zn、Cu和Ni的吸收量分别为25.6、4.89 和1.11mg/g(干重)。Iqbal等研究发现,采用多孔载体(loofa sponge)固定的黄孢原毛平革菌对Pb2+、Cu2+和Zn2+的去除率分别可达88.2%、68.7%和39.6%;吸附容量分别达135.3mg/g、102.8mg/g和50.9mg/g干重。
2.2.2 金属离子的浓度
一般来说,随着水体中重金属离子浓度的增加,微生物去除重金属离子的初始速度增大,但去除效率降低;反之,金属离子的浓度越低,去除的初始速度越小,去除效率越大。如在低浓度下,黄孢原毛平革菌对Cd2+去除速率随着Cd2+浓度而增加,但当Cd2+浓度达到一定值时(约300mg/L),去除率达到最大值,Cd2+浓度进一步增加对去除率没有影响。
2.2.3 共存离子
共存离子对微生物去除重金属的能力也有一定的影响。金属离子共存的影响主要有:促进作用、遏制作用和零作用。如Kaewsarn发现,Na+对钙扇藻(Padina sp.)吸附废水中的Cu2+几乎没有影响,而K+、Mg2+和Ca2+分别使Cu2+的去除效率减少了4%、11%和13%。Texier等研究发现,溶液中的Na+,K+,Ca2+,NO3-,SO42-,Cl-对铜绿假单胞菌吸附镧系离子没有影响,但Al3+具有强烈地抑制作用,在3mmol/L的溶液中,大约87%的Al3+被去除,而La3+、Eu3+和Yb3+ 的去除率仅为8%、20%和3%。
2.3 环境因素的影响
2.3.1 pH 值
pH 值对金属离子的化学特性、细胞壁表面的官能团(-COOH、-NH2、=NH、-SH、-OH)的活性和金属离子间的竞争均有显著影响,因此pH 是影响微生物处理重金属废水的重要因素之一。大部分研究发现,微生物对重金属的去除效果在pH 值为酸性或中性偏酸时最好。如Liu 等研究了氧化硫硫杆菌(Thiobacillus thiooxidans)对Zn2+的吸附,当pH 值为6.0 时,吸附量达到最大值(95.24mg/g),pH 值为4.0 时,吸附量为54.05mg/g,而在pH 值为2.0 时,吸附量仅为37.74mg/g。徐卫华等研究了pH 值对铜绿假单胞菌还原Cr(Ⅵ)效果的影响,结果表明,pH=7.0 最利于铜绿假单胞菌还原Cr(Ⅵ),其还原率达到61.71%,pH <7.0 或>7.0都会使还原率下降。
2.3.2 温度
温度对微生物去除重金属离子也有一定的影响,尽管某些细菌可在高温(50~70℃)或低温环境(-5~0℃)中生存,但应用于处理重金属废水的绝大部分微生物的最适宜生长的温度范围是20~30℃。在适宜的温度范围内,微生物的代谢活动随温度的增高而增强,处理效果也就越好。如Maree 等研究认为,SRB的最佳生长率在30.5℃,最佳还原温度为31℃,高温临界值为45℃,温度在38℃以上时,SRB 生长受到抑制,并且在降低温度后,SRB 不易恢复原状,温度高于50℃时中温菌在短时间内死亡[46]。然而,与其它因素相比,温度对生物吸附的影响并不明显。如20~40℃的范围内,温度对钝顶螺旋藻(Spirulina platensis)对镉离子的吸附没有影响。
3 问题与展望
虽然国际上对微生物处理重金属废水的研究取得了长足发展,确认了微生物修复的应用前景。然而,有关微生物对重金属的吸附、沉淀机理还不是很明确。此外,该项技术尚处于实验室阶段,大规模利用微生物处理重金属废水的情况还很少,很多因素限制了它的大规模使用。如废水中存在多种重金属,如何将具有不同处理功能的高效菌株混合培养? 采用生物工程技术生产出的微生物是否能适应外部环境条件? 怎样将微生物修复技术与其它环境净化技术进行有效的组装、配套? 以及如何再生生物修复剂? 随着分子生物技术和基因工程技术的迅速发展,有待于从分子水平上去研究重金属对微生物的影响机制,为进一步研究和运用微生物修复水体重金属污染提供更多的科学依据。为了加速微生物处理重金属废水的工程应用,今后有待于进一步加强以下方面的研究:
(1)加强微生物对重金属吸附、沉淀作用机理的研究,以期在基础领域取得突破;
(2)开发更多价格低廉、吸附容量大以及可再生的生物吸附剂。同时,开发新的具有金属结合性质的分子物质,如植物凝集素的类似物,选育具有较强金属亲和力的多肽,这也将会大大提高生物修复的水平。
(3)加强对基因重组技术、原生质体融合技术构建“超级工程菌”的及新型菌种的重视和研究,选择对重金属离子去除量大、平衡时间短的菌种应用于工业化;
(4)开发新的高效固定化生物反应器、建立在微生物技术基础上的新的处理工艺,最大限度的提高生物的效率。来源:谷腾水网


