苯并噻唑(BTH)是一种工业生产常用的的化工原料,广泛用于橡胶硫化促进剂、花青染料、造纸工艺的除粘菌剂、灭菌剂、除草剂、杀真菌剂以及抗生素药物的生产当中。在工业废水和城市污水中均检测到BTH,浓度高达29. 6 ~ 110 mg·L - 1 和1. 9 ~ 6. 7 mg·L - 1 。由于BTH 的难降解性、生物抑制性、疏水性和化学稳定性,导致传统的物化法和生物法对其去除率低仅达5% ~ 28% ,且耗费巨大。因此,需要选择具有高效催化效率的高级氧化技术来处理这类难降解有机物。
三维电催化高级氧化技术可以有效地增大工作电极的比表面积、提高传质效率,对难降解有机污染物的处理是有效可行的,具有非常好的发展前景 。目前,三维电催化氧化技术在重金属废水、印染废水、苯酚废水等方面的处理已经取得良好的效果。但是,对于结构复杂的难降解有机污染物的处理研究尚不成熟,缺少反应器床层设计参数以及实际运行条件,对于粒子电极制备改性及电极表面实际反应历程等方面仍缺乏深入研究。要将三维电催化反应器运用到工业废水处理的实践当中,还需要从各方面进一步研究,设计出科学节能的床体结构,优化各项结构参数、运行参数,分析电催化反应机理等,这样才能使三维电催化氧化技术成熟地运用到实际废水的处理中。
本研究设计构建了序批式复极性三维电催化反应器,并且采用自制的粒子电极。以苯并噻唑为目标污染物,通过TOC 和苯并噻唑去除率、电流效率、电能能耗效率等电化学指标考察影响反应体系的因素,从而确定三维电催化反应器的最佳运行条件。
1 材料与方法
1. 1 Fe / Fe2 O3 / Fe3 O4 / AC 粒子电极的制备
本研究以2 ~ 4 mm 的颗粒活性炭作为基体采用浸渍法进行粒子电极表面金属催化剂的制备。配制0. 74 mol·L - 1 的Fe(NO3 )3 溶液作为浸渍液,称取12 g 预处理过的活性炭颗粒浸渍与上述浸渍液中18 h,滤去剩余浸渍液。将浸渍后的载体活性炭置于鼓风干燥器中于105 ℃ 下干燥2. 5 h。最终将干燥后的载体活性炭置于箱式电阻炉中于380 ℃ 下焙烧4 h,即得改性的粒子电极Fe/ Fe2 O3 / Fe3 O4 / AC。
1. 2 电催化反应装置及检测方法
1. 2. 1 序批式复极性三维电催化反应器
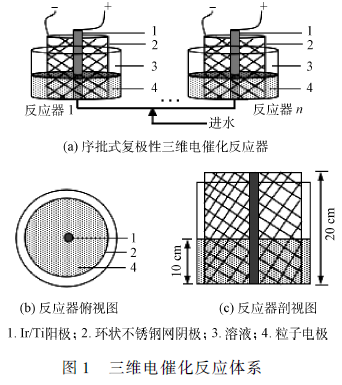
序批式复极性三维电催化反应器如图1 所示。反应器是由有机玻璃制成的圆柱状容器,内径8 cm,有效容积为500 mL。采用直流稳压电源供,外加电压为9. 9 V。阳极为钛基镀铱Ir/ Ti 柱状电极( Φ8 mm × 20 cm),阴极为不锈钢网环状电极(Φ8 cm ×20 cm),采用以阳极为中心、阴极环围阳极的电极型式,阴阳极电极间距为4. 24 cm。粒子电极采用自制的Fe/ Fe2 O3 / Fe3 O4 / AC 颗粒状电极,粒子电极填充比例为60% 。电催化实验在25 ℃ 、1 atm 条件下进行,电解液为0. 1 mol · L - 1 NaCl + 100 mg · L - 1BTH。进水通过蠕动泵由反应器下部进水,上升流速为8. 333 mL·min - 1 ;采用重力排水的方式。进水、电催化和排水通过时间继电器自动控制,具体运行参数如下:进水30 min,电催化3 h,排水10 min,每个周期3 h 40 min,1 d 运行6. 5 个周期。
1. 2. 2 循环伏安法
循环伏安曲线采用三电极体系在上海辰华仪器有限公司的CHI700E 型电化学工作站进行。以Ir/ Ti电极为工作电极(Φ8 mm × 20 cm),以环状不锈钢网为对电极,Ag/ AgCl 为参比电极,以Fe/ Fe2 O3 / Fe3 O4 /AC 为粒子电极,构成三维极化曲线测试体系。测试分别在0. 1 mol·L - 1 NaCl + 100 mg·L - 1 BTH 溶液、0. 1 mol·L - 1 Na2 SO4 + 100 mg·L - 1 BTH 溶液、0. 1 mol·L - 1 NaNO3 + 100 mg·L - 1 BTH 溶液、0. 1 mol·L - 1 Na3 PO4 + 100 mg·L - 1 BTH 溶液中进行,电位扫描速率为100 mV·s - 1 。
1. 2. 3 矿化电流效率的计算方法
矿化电流效率(mineralization current efficiency,MCE)是体现电化学反应的过程中有效矿化化学反应的参数,实验中以一定时间内的TOC 去除作为反应过程中的有效反应,计算公式如下:
式中:n 为苯并噻唑矿化过程中所消耗的电子数,44;F 为法拉第常数,96 487 C·mol - 1 ;V 为溶液体积,L;Δ(TOC)为降解过程中TOC 的降低值,mg·L - 1 ;4. 32 × 107 为换算因数( = 3 600 s·h - 1 × 12 000 mg);m为苯并噻唑分子中碳原子数,7;I 为电流,A;t 为反应时间,h。
苯并噻唑的矿化反应式如下:
C7 H5 NS + 21H2 O→7CO2 + HNO3 + H2 SO4 + 44H + + 44e -
1. 2. 4 能耗的计算方法
能耗(energy consumption,EC)指的是电化学反应过程中所消耗的电能,通常用去除废水中单位COD所消耗的电能来表示 ,单位为kW·h·(kg COD) - 1 ,计算公式如下:
式中:U 为外加电压,V;I 为电流,A;t 为反应时间,h;Δ(COD)为反应时间段内COD 的变化值,mg·L - 1 ;V 为反应溶液体积,L;1000 为换算因数。
1. 3 有机物分析检测方法
1. 3. 1 TOC 测定
本研究采用Shimadzu 公司的TOC-V CPH / CPN 总有机碳分析仪测定样品中的总有机碳含量。
1. 3. 2 苯并噻唑浓度测定
本研究利用高效液相色谱(HPLC)分析检测方法对溶液中苯并噻唑的浓度进行测定分析,采用美国Waters Acquity Ultra Performance LC 色谱仪,配备色谱柱为Acquity UPLC BEH C18(1. 7 μm,2. 1 mm ×50 mm),具体的检测条件如下:
流动相为甲醇∶ 水= 75 ∶ 25(V ∶ V),流速为0. 1 mL·min - 1 ,柱温为20 ℃ ,样品温度为20 ℃ ,进样量2 μL,紫外检测波长为254 nm。
1. 3. 3 COD 测定
本研究采用重铬酸钾消解法进行COD 的测定。
2 结果与讨论
2. 1 电解质溶液种类及浓度对反应体系的影响
2. 1. 1 电解质种类对苯并噻唑降解效果的影响
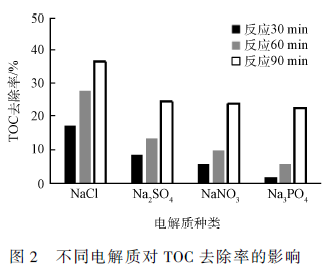
在电催化降解实验中,一定浓度的支持电解质往往会被加入到废水溶液中以提高导电能力,不同种类的电解质对电催化体系的效果有一定的影响。实验采用Na2 SO4 、NaNO3 、NaCl 和Na3 PO4 4 种电解质进行苯并噻唑的电催化降解实验,通过比较电催化反应的TOC 去除率考察电解质种类对苯并噻唑的去除效果,其结果如图2 所示。当NaCl 为电解质时,苯并噻唑的去除率最高。理论上来说,在溶液存在Cl - 的情况下,电催化过程中生成了HClO、ClO - 起到了一定的氧化作用;首先,Cl - 在电场作用下向阳极进行定向移动并在阳极表面生成Cl2 :2Cl - - 2e - →Cl2 ;随后氯气溶于水生成次氯酸:Cl2 + H2 O→HClO + H + + Cl - ;次氯酸进而水解生成ClO - 和H + :HOCl↔ClO - + H + ,其中HClO 和ClO - 均具有一定的氧化能力,对苯并噻唑及其中间产物可以起到间接氧化的作用,所以当NaCl 作为电解质时,溶液矿化度较高。当以Na2 SO4 、NaNO3 和Na3 PO4 作电解质时,溶液矿化程度均不高,随着时间的延长三者的TOC 去除率大致相同,说明该3 种电解质在苯并噻唑的电催化氧化过程中起到的作用相近;其中,以Na2 SO4 作为电解质时,TOC 的去除率略高于另两者,可能的原因主要是在SO4^2- 存在的情况下电解产生了氧化物S2 O8^2- 起到了一部分间接氧化的作用。
2. 1. 2 不同种类电解质对降解苯并噻唑的氧化作用分析
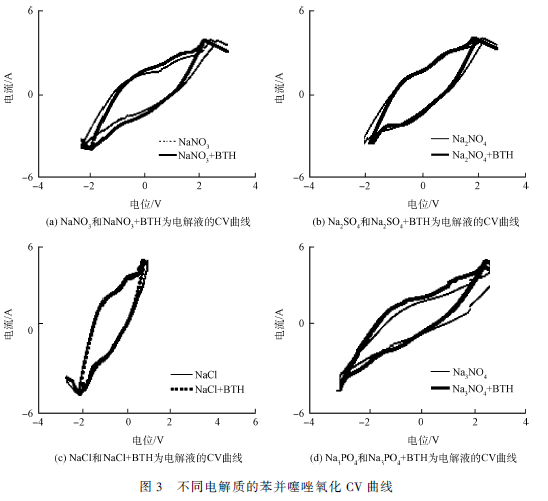
本实验采用循环伏安法初步探讨不同种类电解质对苯并噻唑氧化作用的影响。反应体系分别以0. 1mol·L - 1 的Na2 SO4 、NaCl、NaNO3 和Na3 PO4 为支持电解质,分别扫描未加入苯并噻唑和加入苯并噻唑时的循环伏安曲线,结果如图3 所示。
在未加苯并噻唑的4 种电解质溶液中,在相同的电位区域都观察到了氧化还原峰,该氧化还原峰对应的反应为阳极Ir/ Ti 电极上和粒子电极Fe/ Fe2 O3 / Fe3 O4 / AC 上的氧化还原峰。由图3(a)可知,在NaNO3溶液中析氧电位为1. 9 V。在低于析氧电位区域时,以NaNO3 + BTH 为电解质溶液的阳极电流密度大于仅以NaNO3 为电解质溶液的电流密度,这说明此时苯并噻唑在未发生析氧反应之前便已经在Ir/ Ti 阳极和Fe/ Fe2 O3 / Fe3 O4 / AC 粒子电极上发生了直接氧化作用,由苯并噻唑氧化反应贡献了一部分阳极电流。在高于析氧电位区域时,阳极上和粒子电极上主要发生如下反应 :H2O-e - → ·OH + H + ;·OH + BTH→ 中间产物;·OH + 中间产物→ CO2 + H2O;2·OH-2e - → O2 + 2H + ;这说明在高于析氧电位区域时,苯并噻唑的氧化过程是伴随着析氧过程进行的,即既存在直接氧化作用又存在间接催化氧化作用。而由于羟基自由基具有高催化活性,所以此时苯并噻唑在阳极Ir/ Ti 和粒子电极Fe/ Fe2 O3 / Fe3 O4 / AC上以·OH 间接氧化为主。当Na2 SO4 和Na3 PO4 为支持电解质时(如图3(b)和(d)),苯并噻唑的电化学氧化行为与以NaNO3 为电解质时极为相似,说明苯并噻唑在三维电催化反应体系中的降解既存在直接电极氧化过程也同时存在间接催化氧化过程。
由图3(c)可知,在以NaCl 为电解质溶液和以NaCl + BTH 为电解质溶液时的循环伏安曲线几乎重叠,在该CV 曲线上并未观察到苯并噻唑的直接氧化峰。根据2. 1. 1 中对NaCl 为电解质时的降解反应分析可知,此时苯并噻唑的氧化是伴随着析氯反应发生的。苯并噻唑被电催化生成的羟基自由基、HClO 和ClO - 间接氧化从而被降解的。由于在该间接氧化过程中,并未涉及到电化学的电子转移过程,所以两者的CV 曲线几乎一致。这说明以NaCl 为支持电解质时,整个三维电催化反应体系主要进行间接催化氧化反应,这也是当NaCl 作为电解质时催化反应效率较其他支持电解质高的原因。
2. 1. 3 电解质溶液浓度对反应体系的影响
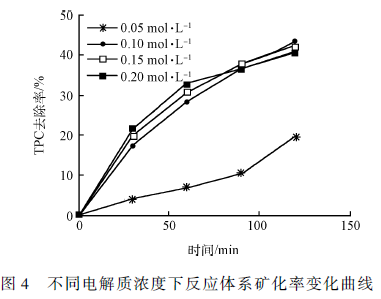
实验分别对电解质NaCl 浓度为0. 05、0. 1、0. 15和0. 2 mol·L - 1 的反应体系矿化程度进行了分析对比。本实验选取NaCl 作为电解质的主要原因是其促进了反应体系的矿化过程并且不影响对苯并噻唑降解产物的检测和分析(苯并噻唑不含有Cl 元素)。通过对2 h 的电催化反应进行取样测定分析,得到不同电解质浓度时反应体系的TOC 去除情况,如图4所示。通过总体趋势可以看出,电解质浓度越高反应体系的矿化效果越好,这是因为电解质浓度增高使反应体系的导电率升高有助于电催化反应的进行。但是,当电解质浓度超过0. 1 mol·L - 1 时,随着电解质浓度的增加TOC 去除率升高的效果不明显,从节约成本的方面考虑,电解质浓度不宜超过0. 1mol·L - 1 。此外,随着电解质浓度的增加局部的TOC 去除率有下降的现象出现,这个是由于电解质离子之间的相互作用增强,导致电导率下降,并且过多的电解质可能会大量吸附于电极表面,阻碍了有机分子与电极表面的接触,也阻碍了羟基自由基的产生。所以,最佳的电解质NaCl 浓度为0. 1 mol·L - 1 。
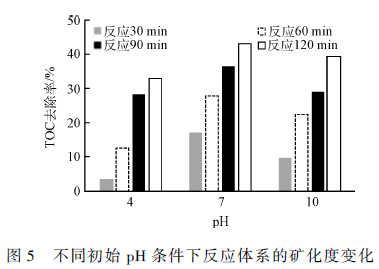
2. 2 进水pH 对反应体系的影响
溶液的pH 同样对电催化降解的效果起着重要的作用,它可能直接影响电极的电催化性和电催化反应过程。利用盐酸和NaOH 调节电解液的pH 在不同酸碱度下考察反应体系的矿化程度,实验结果如图5 所示。
可以明显看出,中性和碱性条件下的电催化效果较佳,其中中性条件更有利于反应体系中的有机污染物的去除,反而,酸性条件非常不利于反应体系的电催化降解反应。这主要是因为自制的粒子电极表面担载着Fe,Fe2 O3 和Fe3 O4 金属催化剂,这些催化剂对反应体系中催化产生·OH 起着决定性的作用,而酸性条件下该类金属及氧化物极易脱落溶解,失去了电催化性,对反应体系不利;虽然,在酸性条件下溶液中会形成芬顿试剂,在某种程度上可能会促进·OH 的产生,但是由于没有足够的H2 O2 补给,所以该催化氧化作用微乎其微。
2. 3 进水-电催化反应时间的影响
复极性电催化反应器的进水时间、电催化反应时间对污染物的去除效率和电能消耗有较大的影响,所以需要对最佳的进水-电催化时间进行确定,使反应器达到最佳的运行状态。
2. 3. 1 最佳进水时间及上升流速的确定
该实验在不同的进水时间、相同的电催化反应时间内进行,通过苯并噻唑的降解率和反应体系的矿化 程度判断最佳的进水时间。先在不外加电压的情况下进行一定时间的进水过程,在达到预定的进水时间后进行2 h 的电催化实验,使得电催化反应后的出水矿度高、苯并噻唑的电催化降解率高。通过控制上升流速使得进水时间分别达到1、3、5、20、30、45 和60 min。进水终止后进行电催化反应30 min 时,不同进水时间的苯并噻唑降解率结果如图6 所示。
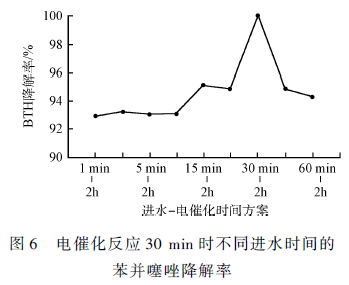
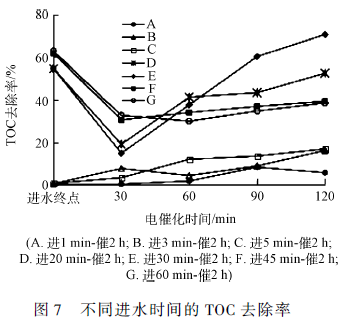
可以看出,所有进水时间方案在停止进水后电催化反应30 min 时,苯并噻唑几乎完全降解,去除率均在92% 以上。其中,进水30 min-电催化2 h 的时间方案在这一时刻苯并噻唑的去除率达到100% ,说明该方案对于苯并噻唑的降解效果较好。根据HPLC 的检测结果得知,苯并噻唑在反应过程中并没有完全矿化成无机物,产生了一些中间产物,所以还需要对不同进水时间方案的矿化度进行测定分析。不同进水时间的TOC 去除率随时间的变化情况如图7 所示。
图7 显示A、B 和C 3 种方案的TOC 去除率均非常低。这主要是因为该3 种方案的进水时间极短、上升流速较快导致了粒子电极表面因氢键的作用力形成一层水膜,阻止了溶液中的有机物与粒子电极表面及孔道的接触,使得粒子电极丧失较大部分的吸附性能和电催化性,造成TOC 的去除率很低。D、E、F 和G 4 种方案的TOC 去除率随时间变化趋势相一致,呈现先减小后增加的变化。这是由于Fe/Fe2 O3 / Fe3 O4 / AC 粒子电极具有较强的吸附性,在进水过程中将大量的苯并噻唑被吸附到粒子电极中,使得溶液中污染物的浓度降低,所以TOC 去除率较高。当开始进行电催化反应后,苯并噻唑被快速电催化降解生成多种有机中间产物,并释放到溶液中,导致溶液中污染物浓度增加,所以会产生TOC 去除率降低的过程。随着电催化反应的持续进行,反应器中的中间产物逐渐被矿化,所以TOC 去除率逐渐升高。进水30 min 时的反应体系矿化程度最佳,这与前面苯并噻唑的降解实验结果相符合,所以确定最佳的进水时间为30 min,通过计算可得对应的上升流速为8. 333 mL·min - 1 。在确定上升流速时需要注意不宜过快,否则会造成粒子电极的表面形成较强的氢键作用力阻碍对有机物的吸附和电催化作用、反应器内出现沟流现象和粒子电极的部分流化现象。综上所述,最佳的进水时间为30 min,上升流速为8. 333 mL·min - 1 。
2. 3. 2 电催化最佳时间的确定
三维电催化体系是以催化产生的·OH 进行有机污染物的催化氧化反应,由于·OH 是具有强氧化性的自由基,只要持续进行电催化反应,最终羟基自由基可将苯并噻唑及其有机中间产物完全矿化。但长时间的电催化反应会造成较大的能量损耗,并且反应后期的矿化电流效率较低,使得整个反应体系的有效化学反应减少。所以,电催化效能不能只以反应体系的矿化度作为唯一的评价标准,还需要进行矿化电流效率和能耗损失的综合考察。
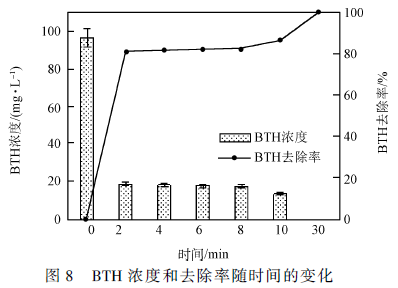
进水30 min 后开始4 h 的电催化实验,每30 min取样测定TOC、HPLC、COD 和电流It ,进行3 组平行实验,实验结果取平均值。苯并噻唑的浓度变化及去除率如图8 所示,结果显示在电催化反应进行30 min时苯并噻唑已经完全被降解。电催化反应的TOC 去除率、矿化电流效率以及能耗随时间的变化情况如图9 所示。结果表明,随着催化实验的进行,TOC 去除率不断升高,反应体系在3 h 时便几乎达到完全矿化的程度,矿化率约为92. 0% ;同时,矿化电流效率较高为5. 99% ,反应所需的电能较少,能耗为13. 00 kW·h·(kg COD) - 1 。在电催化反应3 h 以后,TOC 去除率的提高速率减缓,而矿化电流效率迅速下降到1. 06% ,且电能损耗大幅增加高达29. 20kW·h·(kg COD) - 1 ,造成这一现象的主要原因有:(1)在电催化反应后期,反应体系中存在的有机污染物的浓度已经很低了。此时的反应速率常数小于羟基自由基催化反应的平衡常数,不利于反应的正向进行,所以降解速率较慢、电流效率低,为推动反应的继续正向进行需要消耗更多的电能;(2)随着反应的不断进行,反应体系中可能生成了更难被氧化降解的中间产物,较多的副反应出现,也会造成处理效率不高、电能损失大。对反应过程中TOC 和苯并噻唑的测定值进行误差分析,结果显示3 次实验的测定值具有较高的一致性,绝对误差在0. 08 ~ 0. 12 之间,说明三维电催化体系的运行稳定性较好。
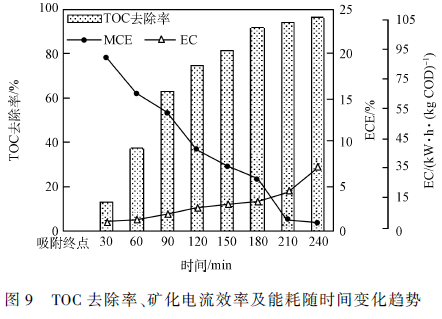
综合上述讨论,可以得出序批式复极性三维电催化反应器的最佳进水时间为30 min,此时上升流速为8. 333 mL·min - 1 ,最佳电催化反应时间为3 h。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
1)序批式复极性三维电催化反应器的最佳运行条件为0. 1 mol·L - 1 的NaCl 作为电解质溶液,进水pH 为7,进水时间为30 min,电催化反应时间为3 h。此时,苯并噻唑完全被降解,反应体系的矿化率达到92. 0% ,矿化电流效率为5. 99% ,能耗为13. 00 kW·h·(kg COD) - 1 。
2)当以Na2 SO4 、Na3 PO4 和NaNO3 为电解质时,苯并噻唑的降解过程主要为阳极、粒子电极的直接氧化作用和羟基自由基的间接氧化作用;以NaCl 为电解质时,苯并噻唑的降解过程主要为羟基自由基和HClO、ClO - 的间接氧化作用。