1 引言(Introduction)
水环境中的重金属污染已经成为一个日益突出的环境问题, 尤其是工业废水和城市污水等造成的重金属污染具有长期性和不可逆的特点.微生物对重金属具有良好的吸附和转化作用, 可以将其从废水中去除, 达到治理污染、回收重金属和处理后水体回用的目的.近30年来, 国内外的科研工作者对重金属废水的微生物吸附处理技术开展了较广泛的研究, 已发现的用于重金属离子吸附的微生物数量众多, 主要由细菌、真菌和藻类组成.研究表明, 吸附剂的性能主要由生物量的特性、目标重金属的物理化学性质及反应发生的小环境等因素决定.研究微生物吸附剂对重金属的吸附特性, 对于净化重金属污染环境具有重要的理论和实际意义.
现有研究多集中于单一重金属离子的生物吸附作用, 而对多组分重金属离子的同时吸附过程研究不多.由于重金属离子的复杂性, 多种金属共存时的联合作用会改变其被吸附性, 研究表明, 共存重金属对于微生物吸附目标离子存在促进作用、抑制作用或蒸馏效应等.鉴于此, 本研究采用课题组前期工作中分离得到的铜绿假单胞菌(Pseudomonas aeruginosa)为实验菌株, 考察其对水体中Cu2+和Pb2+的去除效果及其影响因素, 分析2种重金属共存条件下菌体对目标重金属的吸附能力变化, 研究微生物对复合重金属的吸附效应, 以期为重金属场地的微生物修复提供理论依据.
2 材料与方法(Materials and methods) 2.1 实验试剂与材料 2.1.1 实验试剂
牛肉膏、蛋白胨、NaCl、Cu(NO3)2、Pb(NO3)2等购自上海化学试剂厂, 均为AR级.1000 mg·L-1Cu2+和Pb2+母液分别由Cu(NO3)2和Pb(NO3)2溶于高纯水得到.
2.1.2 菌株与培养基
菌株:由本课题组从受污染严重的苏州市原江苏化工农药集团地块土壤中筛选得到, 经16S rDNA序列比对, 鉴定为铜绿假单胞菌(P. aeruginosa).营养培养基:牛肉膏3 g, 蛋白胨10 g, NaCl 5 g, 蒸馏水1000 mL, pH值为7.2~7.4;培养基在121 ℃下灭菌30 min.
2.2 实验方法 2.2.1 菌株培养
接种P. aeruginosa于培养液中, 于(30±1) ℃、150 r·min-1摇床中振荡培养24 h.取菌液按1%体积比接种于新鲜培养液中, 在上述条件下培养24 h, 6000 r·min-1离心10 min获取菌体, 用0.05 mol·L-1的磷酸缓冲液(pH=7.3) 清洗菌体3次, 备用.
2.2.2 不同因素对P. aeruginosa吸附Cu2+和Pb2+的影响
吸附时间的影响:于pH=7.0的纯水体系中加入一定量的P. aeruginosa菌悬液, 投菌量为1 g·L-1;再向体系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使体系中重金属离子浓度分别为1 mg·L-1 Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1 Pb2+, (30±1) ℃下置于150 r·min-1恒温摇床中处理0、0.5、1、2、4、8、12 h后取样;样品转入离心管, 于6000 r·min-1离心10 min, 取上清液测定重金属浓度.
投菌量的影响:于pH=7.0的纯水体系中加入一定量的P. aeruginosa菌悬液, 投菌量分别为0.1、0.25、0.5、1、2 g·L-1;再向体系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使体系中重金属离子浓度分别为1 mg·L-1Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1Pb2+, (30±1) ℃下置于150 r·min-1恒温摇床中处理2 h后取样, 测定2种重金属的浓度.
pH的影响:分别于pH=3.0、4.0、5.0、6.0、7.0和8.0的纯水体系中加入一定量的P. aeruginosa菌悬液, 投菌量为1 g·L-1;再向体系中加入一定量的Cu(NO3)2和Pd(NO3)2溶液, 使体系中重金属离子浓度分别为1 mg·L-1Cu2+、1 mg·L-1Pb2+和1 mg·L-1Cu2++1 mg·L-1Pb2+, (30±1) ℃下置于150 r·min-1恒温摇床中处理2 h后取样, 测定2种重金属的浓度.
2.2.3 重金属共存下P. aeruginosa吸附性能
Pb2+共存下活菌对Cu2+的吸附:向含1 mg·L-1 Cu2+、pH=7.0的纯水体系中加入一定量的P. aeruginosa菌悬液, 投菌量为1 g·L-1;再向体系中加入一定量的Pb(NO3)2溶液, 使体系中Pb2+浓度分别为1、2、5、8、10 mg·L-1, 于(30±1) ℃置于150 r·min-1恒温摇床中处理2 h后取样, 测定Cu2+的浓度.
Pb2+共存下戊二醛固定后菌体对Cu2+的吸附:取菌体配制成菌液, 用最终浓度为2.5%的戊二醛固定24 h后, 用双蒸水清洗至pH中性.吸附实验同同上.
Cu2+共存下菌体对Pb2+的吸附:体系中Pb2+浓度为1 mg·L-1, Cu2+浓度分别为1、2、5、8、10 mg·L-1, 吸附实验同上, 测定Pb2+的浓度.
Cu2+共存下戊二醛固定后菌体对Pb2+的吸附:体系中Pb2+浓度为1 mg·L-1, Cu2+浓度分别为1、2、5、8、10 mg·L-1, 吸附实验同上.
2.2.4 重金属浓度测定
重金属浓度利用火焰原子吸收分析仪进行测定.
2.2.5 吸附率和吸附量的计算
吸附率R和吸附量q的计算公式如下:
式中, c0和ce分别为吸附前后溶液中重金属的浓度(mg·L-1), m为吸附剂用量(g), V为溶液总体积(L).
2.2.6 扫描电镜(SEM)实验
分别将空白菌体和吸附1 mg·L-1Cu2++1 mg·L-1Pb2+菌体进行脱水、冷冻干燥和喷金等前处理, 利用FEG 520型扫描电镜观察菌体形态.
2.3 数据分析
用SPSS13.0软件对数据进行统计分析, 结果用平均值±标准差(Means±SD)表示.
3 结果与讨论(Results and discussion) 3.1 处理时间对P. aeruginosa吸附Cu2+和Pb2+的影响
大多数有关重金属生物吸附的研究表明, 生物材料对重金属离子的吸附分为2个阶段:第一个阶段是一种快速的表面吸附, 通常在几十分钟内即达到最终吸附量的70%左右;第二个阶段为缓慢吸附阶段, 是重金属离子向细胞内的转移, 受胞内代谢、细胞扩散过程的控制(Soleymani et al., 2015), 这一阶段常常需要数小时甚至更长的时间才能达到饱和吸附量.图 1结果表明, P. aeruginosa对Cu2+和Pb2+均有较好的吸附效果, 吸附率随处理时间的变化有相似趋势.菌体与重金属接触的前2 h, 吸附率随时间的增加而上升, 2 h时已完成大部分重金属的吸附.在随后的10 h(第2~12 h), P. aeruginosa对2种重金属的吸附效果变化不大.从图 1还可以看出, P. aeruginosa对1 mg·L-1Pb2+的吸附效果要优于其对相同浓度Cu2+的吸附, 2 h时二者的吸附率相差约26%.同一菌株对不同重金属的吸附有较大差异, 窦敏娜等(2007)对菌HQ-1吸附Cd与Ag进行了比较研究, 结果表明, 该菌株对Ag的吸附能力要优于Cd, 且对Cd的吸附行为符合Langmuir模型, 对Ag的吸附行为符合Freundlich模型.

图 1 处理时间对P. aeruginosa吸附Cu2+、Pb2+的影响
从图 1还可以看出, 共存重金属条件下, P. aeruginosa对目标重金属吸附效果随时间变化的趋势与单一污染物的相似.分别对单一和复合吸附Cu2+、Pb2+进行差异性分析, 结果表明, 共存重金属对目标重金属的吸附效果影响不显著(p>0.05).因此, 随着吸附时间的变化, 菌株对Cu2+、Pb2+的吸附能力在1 mg·L-1重金属共存时是基本不变的.
3.2 投菌量对P. aeruginosa吸附Cu2+和Pb2+的影响
投菌量是影响重金属生物吸附的重要因素之一.图 2显示, P. aeruginosa对2种重金属的吸附率随着投菌量的增加呈现先迅速增加, 然后趋于平稳的趋势, 即吸附量不再随着投菌量的增大有显著增大.这一现象可能与两方面的原因有关:① 投菌量过高时, 菌体向细胞外分泌的物质会改变吸附体系的pH值, 从而改变菌体表面的物化性质或影响金属离子在水中的存在形态, 并进一步削弱菌体对金属离子的吸附效果;菌体向细胞外分泌的阳离子也可能会与目标吸附质发生吸附竞争;② 微生物对过量的重金属具有生物解毒的能力, 当部分重金属被积累到体内后, 菌体会产生多种适应机制, 如把积累进体内的重金属运输出体外;或者改变细胞膜的物质运输通道, 使细胞外的重金属更难运输进体内;而且这些机制需要在合适的吸附质与吸附剂比例下才能成功激活和运行(Zhou et al., 2014;Ye et al., 2010).然而, 2种重金属吸附效果达到稳定时的投菌量不同, 对于1 mg·L-1Cu2+, 投菌量为1 g·L-1时吸附效果较为理想, 而吸附1 mg·L-1Pb2+达到平稳时的投菌量为0.5 g·L-1.不少研究有类似结果, 陈永华等(2015)从铅锌矿渣盆栽根际土样中分离筛选出3株耐铅锌菌株, 利用其对Pb2+和Zn2+进行吸附实验, 结果表明, 蜡样芽孢杆菌对于50 mg·L-1Pb2+吸附的最佳投菌量为0.02 g(以干重计), 而对于同样浓度Zn2+吸附的最佳投菌量为0.06 g, 解硫胺素芽孢杆菌和藤黄微球菌对于2种重金属吸附的最佳投菌量同样有较大差异.

图 2 投菌量对P. aeruginosa吸附Cu2+(a)和Pb2+(b)的影响
图 2结果表明, 当体系中只含有单一重金属时, 单位质量菌体对Cu2+、Pb2+的吸附量随投菌量的增加呈下降趋势.其主要原因是随着投菌量的增加, 吸附质与吸附剂的比例减小, 从而导致单位质量菌体可以吸附的重金属量减少.从图 2还可以看出, 共存重金属对菌体吸附目标离子有影响.对于吸附率, 其变化趋势与单一重金属体系随投菌量的变化趋势相似, 仅吸附效果略有降低;对于单位吸附量, 投菌量较低时(≤0.25 g·L-1), Pb2+对菌体吸附Cu2+的影响要大于Cu2+对菌体吸附Pb2+的影响.当投菌量为0.1 g·L-1时, Pb2+共存下, 单位质量菌体吸附1 mg·L-1 Cu2+的量下降约61.9%, 而Cu2+共存下, Pb2+单位吸附量下降26.2%.这一结果表明, P. aeruginosa对Pb的吸附能力强于Cu, 当吸附剂的数量不足时, 菌株优先以Pb为吸附目标.方差分析结果表明, 投菌量对2种重金属的吸附影响极显著(p < 0.01).共存重金属离子对菌株吸附率无显著性影响(p>0.05), 但对单位质量菌体的吸附量有较显著的影响(p < 0.05).
3.3 pH对P. aeruginosa吸附Cu2+和Pb2+的影响
初始pH对P. aeruginosa吸附重金属的影响见图 3.pH为3时, 菌体对Cu2+和Pb2+的吸附效果较差, 吸附率仅分别为7.4%和10.3%, 而当pH为5~8时, 2种重金属的吸附效果较理想且变化较平稳.这是由于在含有重金属的吸附液中, 首先与重金属接触的是细菌细胞壁, 在细胞壁上有许多带负电荷的官能团, 其中, 羧基和氨基是活性位点, 当pH过低时, 菌体表面的质子化会抑制重金属离子的吸附, 即H3O+会占据大量的吸附活性位点, 阻止阳离子与吸附活性位点的接触, 因此, 质子化程度越高, 吸附剂对重金属离子的斥力越大, 从而导致吸附量下降;而且, 过酸的环境对菌体正常生理功能会产生影响, 削弱菌体对铜的生物积累能力.随着pH值升高, 细胞表面官能团开始脱质子化, 官能团的负电荷逐渐暴露出来, 因此, 镉与活性位点结合量增加(Vale et al., 2016);当pH值过高, 达到重金属离子的Ksp值后, 很多金属离子会生成氢氧化物沉淀, 无法体现生物吸附作用对金属的去除效果(贾成光等, 2014).方差分析结果表明, pH对菌体吸附2种重金属均有有较为显著的影响(p < 0.05).但随着pH值的变化, P. aeruginosa对Cu2+和Pb2+的吸附能力在两者共存时的变化不显著(p>0.05).
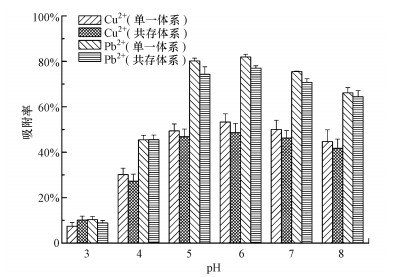
图 3 pH对P. aeruginosa吸附Cu2+、Pb2+的影响
3.4 不同浓度重金属共存下P. aeruginosa吸附性能
通过改变共存重金属的浓度考察P. aeruginosa对目标重金属的吸附效果变化规律, 结果如图 4所示.从图 4a可以看出, Pb2+的加入对菌体吸附Cu2+有抑制作用, 且抑制效果随着Pb2+浓度的增加而增大, 主要原因是Pb2+的加入占据了菌体吸附位点, 从而影响其对目标离子的吸附.图 4b表明, Cu2+的加入对菌体吸附Pb2+的影响无明显规律, 仅当Cu2+浓度为5和10 mg·L-1时其吸附率有较显著的变化(p < 0.05).造成上述结果的可能原因是P. aeruginosa对于2种重金属的吸附机理不同.菌体对Pb2+的吸附不但与其表面性质有关, 可能还与菌体理化性质等有关, Cu2+的加入虽然占据了吸附位点, 但同样会改变菌体分泌物与细胞结构, 从而影响其对目标离子的吸附.周维芝等(2009)研究了深海适冷菌胞外多糖(EPS)对Pb2+和Cu2+的吸附性能, 结果表明, EPS对Pb2+和Cu2+的吸附量随EPS投加量的增加而减小.为了验证这一猜测, 考察了Pb2+和Cu2+对P. aeruginosa EPS产量的影响, EPS的提取与检测方法参照文献(Wang et al., 2012).实验结果(具体数据未列出)表明, 较高浓度(10 mg·L-1)的Pb2+和Cu2+均会抑制菌体EPS的分泌(Cu和Pb对EPS的抑制率分别为43.7%、11.4%).
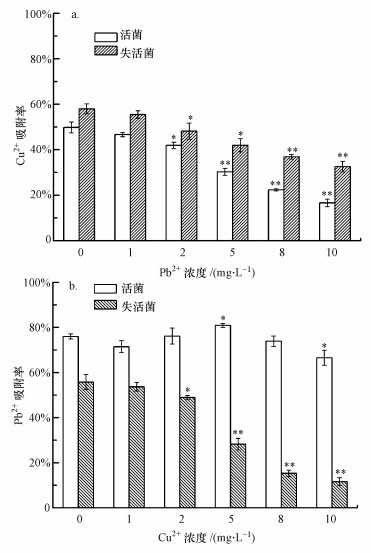
图 4 共存重金属对P. aeruginosa吸附Cu2+(a)和Pb2+(b)的影响 (*表示与对照相比p < 0.05, **表示与对照相比p < 0.01)
为进一步说明上述结论, 研究了不同浓度重金属共存下失活菌体的吸附性能.本实验利用戊二醛作为失活剂固定菌体, 可以将细胞活性状态时的结构和菌体表面的功能基团完整地保留, 并终止菌体正常的生理生化功能, 从而考察菌体表面吸附与内部扩散作用对重金属生物吸附贡献大小.从图 4a可以看出, 当体系中无Pb2+存在时, 失活菌对Cu2+吸附率较活菌有较显著的提高(p < 0.05), 这一结果与白洁琼等(2013)的研究结果一致, 说明P. aeruginosa对Cu2+的吸附作用不仅包括菌体表面吸附, 还包括跨膜的主动运输、菌体表面脱附和菌体对金属的主动释放等作用.失活后的菌体对Cu2+的吸附仅为表面吸附, 不存在主动释放与运输Cu2+的过程, 因此, 吸附率较活菌有提高.图 4b表明, 当体系中无Cu2+存在时, 失活菌对Pb2+吸附率较活菌有显著的降低(p < 0.01).原因是Pb2+的生物吸附存在表面吸附和胞内积累行为, 失活后, 菌体不具备对Pb2+进行胞内积累的能力, 从而导致了吸附率的下降.Zhu等(2016)研究了失活前后Mucoromycotesp. XLC对Cd2+和Ni2+吸附能力的差异, 结果表明, 造成活菌与失活菌吸附差异的主要原因是其胞内金属离子的含量变化.
综合图 4可知, 对于活菌, 外源重金属的浓度对P. aeruginosa吸附Pb2+和Cu2+的影响有较大差异;而对于失活菌, P. aeruginosa吸附Pb2+和Cu2+的效果均随外源重金属浓度的增大而降低, 且Cu2+对Pb2+的影响要比Pb2+对Cu2+的影响更为显著.这一现象同样说明P. aeruginosa对于2种重金属的吸附机理不同, 菌体对Pb2+的吸附作用与菌体活性密切相关.研究表明, 生物吸附机理可分为代谢依赖型和非代谢依赖型(Wang et al., 2009), P. aeruginosa对于Pb2+的吸附属于前者, 而对于Cu2+的吸附属于后者.
3.5 P. aeruginosa吸附重金属前后形态变化
图 5为P. aeruginosa吸附重金属离子前后的SEM图.总体上看, 吸附前后大部分菌体均能保持正常形态, 未出现细胞干瘪或破裂的情况.通过比较可以发现, 吸附后的菌体聚集性更好, 而吸附前的细胞较为分散.原因可能是重金属离子的存在使细胞分泌物增加, 从而增强了细胞之间的凝聚性和粘附性.相关研究指出(Yin et al., 2008), 重金属能与菌体分泌到细胞外的生物大分子发生螯合后形成复合物.由于这些生物大分子的主要成分是多糖和蛋白质, 具有很好的粘性, 可以促进重金属吸附于菌体细胞表面, 是金属离子与微生物吸附剂间的桥梁.此外, 这些分泌物与重金属发生螯合后, 可以有效降低重金属的毒性, 从而使吸附后的菌体仍保持饱满的细胞结构.

图 5 菌体扫描电镜图 (a.吸附前, b.吸附Cu2+和Pb2+后)
4 结论(Conclusions)
1)P. aeruginosa对Cu2+和Pb2+的吸附效果随处理时间呈先上升后平稳的变化趋势, 2 h后吸附效果达到稳定.吸附率随投菌量的增加先迅速增加, 后趋于平稳.对于Cu2+, 投菌量为1 g·L-1时吸附效果达到稳定, 而Pb2+吸附率达到平稳时的投菌量为0.5 g·L-1.单位质量菌体对Cu2+、Pb2+的吸附量随投菌量的增加呈下降趋势.pH为3时, 菌体对Cu2+和Pb2+的吸附效果较差, 而当pH为5~8时, 2种重金属的吸附效果较理想.随着处理时间、投菌量、pH值的变化, 共存重金属离子对菌株吸附率均无显著性影响, 仅对单位质量菌体的吸附量有较显著的影响.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
2) 对于活菌, Pb2+的加入对菌体吸附Cu2+有抑制作用, 且抑制效果随着Pb2+浓度的增加而增大;而Cu2+的加入对菌体吸附Pb2+的影响无明显规律.对于失活菌, P. aeruginosa吸附Pb2+和Cu2+的效果均随外源重金属浓度的增大而降低, Cu2+对Pb2+的影响要比Pb2+对Cu2+的影响更为显著.
3) SEM实验观察发现, 菌体吸附前后均能保持正常形态, 未出现细胞干瘪或破裂的情况, 吸附后的菌体较吸附前聚集性更好.


