1 引言 (Introduction)
四环素类抗生素 (Tetracyclines) 是由放线菌产生的一种广谱抗生素,广泛应用于医药行业、畜牧业和水产养殖业.四环素类抗生素的生产和使用量目前位居全球抗生素类第二然而,在使用过程中,四环素仅有部分被动物体吸收并发生代谢,其余抗生素仍然以活性形式 (母体或代谢产物) 随粪便和尿液排出体外,对生态系统和人类的健康造成极大的危害.因此,控制和降低盐酸四环素在环境中的残留已经引起了环境科学界乃至公众的广泛关注.吸附法是抗生素废水处理较为经济、简便的方法之一.然而,在实际操作过程中,吸附剂的性质、操作条件 (如温度、pH) 等都会影响吸附效果,且传统吸附剂材料存在着吸附量低、易团聚、极易产生二次污染、分离困难和循环性差等瓶颈问题.针对上述问题,近年来有研究表明,Fenton反应技术与吸附耦合可有效解决吸附剂饱和后的再生难题.该路线可在常温、常压下进行,反应条件温和,再生吸附剂过程可通过调剂H2O2浓度实现调控,吸附位点可实现原位再生.例如,研究了TiO2@酵母炭微球吸附有机染料及其原位再生,再生实验结果显示通过光催化再生反应,富集刚果红和亚甲基蓝的TiO2@酵母炭微球得到了很好的原位再生效果研究了Fe3O4@沙棘枝炭吸附去除强力霉素及其非均相Fenton氧化再生,再生实验通过构造非均相Fenton反应体系,使得表面富集有强力霉素的Fe3O4@沙棘枝炭吸附剂可实现有效再生,重复使用.
海藻酸钠 (Sodium Alginate) 因具有原材料来源广泛且易于提取、表面具有丰富的化学吸附位点、吸附速率高及不会对环境造成二次污染的特点,成为目前研究中广泛应用的一种优良的吸附剂.因此,海藻酸钠不仅能够处理含有重金属离子的废水,其衍生物还在医药行业中有所应用.例如, 通过构建类Fenton体系,使得海藻酸钠/Fe@Fe3O4壳核纳米结构高效去除诺氟沙星.近年来多项研究证实,以海藻酸钠为基体,负载金属离子,可使得海藻酸钠的吸附功能和金属离子的催化功能在微观尺度上得到耦合.例如,研究了海藻酸钙包覆纳米Ni/Fe颗粒用于同时去除水中铜离子和氯苯.研究了海藻酸锰固定化细胞的乙醇发酵,结果表明, 海藻酸锰比海藻酸钙耐磷酸盐能力高、固定化细胞稳定.然而,将海藻酸钠螯合金属锰离子作为类Fenton催化剂用于废水处理的研究还未有报道.
基于上述考虑,本研究以海藻酸钠为基体,螯合金属锰离子后制备了Mn@海藻酸微球复合吸附剂,并对其进行FE-SEM、FT-IR表征,将其应用在吸附处理盐酸四环素模拟废水中.随后,以表面吸附富集盐酸四环素的Mn@海藻酸微球为类Fenton体系的催化剂,在加入H2O2后,构建形成类Fenton体系,实现废水中盐酸四环素的氧化降解,最终达到吸附剂的再生和循环.研究结果可为含有盐酸四环素废水的处理提供理论依据,且研究具有重要的参考价值.
2 实验部分 (Experiment) 2.1 试剂与仪器
实验仪器:TDL-60B-W台式高速离心机 (湖南星科仪器有限公司); 752N紫外可见分光光度计 (上海精密科学仪器有限公司); 多功能磁力搅拌器 (杭州仪表电机厂); TE124S电子天平 (赛多利斯科学仪器 (北京) 有限公司);pH计 (上海精密仪器厂); Hitachi S-4800冷场发射扫描电镜; 101-1AB恒温干燥箱 (天津泰斯特仪器有限公司); DZF-6050真空干燥箱 (上海一恒科学仪器有限公司).
实验试剂:海藻酸钠 ((C5H7O4COONa)n,CR) 购自天津市东丽区天大化学试剂厂;硫酸锰 (MnSO4,AR) 购自天津永昊精细化工有限公司;乙醇 (C2H5OH,AR) 购自天津市富宇精细化工有限公司;盐酸四环素购自阿拉丁化学股份有限公司,结构式见图 1.实验用水为蒸馏水,所有试剂均为分析纯.
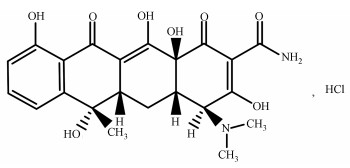
图 1 盐酸四环素结构式
2.2 吸附剂的制备
准确称取一定量的海藻酸钠溶解在蒸馏水溶液中形成2.5% (W/V) 的海藻酸钠溶液,恒温磁力搅拌0.5 h,待用.称取一定量的硫酸锰,加入到上述的海藻酸钠溶液中,得到硫酸锰/海藻酸钠混合溶液 (混合体系中硫酸锰的浓度为0.05 mol·L-1),恒温磁力搅拌1 h,静置10 h.反应后的溶液经过离心机分离,把固体沉淀物用蒸馏水和乙醇反复冲洗.冲洗后的沉淀物烘干,制得Mn@海藻酸微球复合吸附剂.
2.3 吸附实验
常温常压下,pH为6时,在250 mL锥形瓶中加入一定量的Mn@海藻酸和盐酸四环素溶液,每隔一段时间吸取10 mL样品进行离心分离,取上清液于波长370 nm处测其吸光度,单位吸附量 (Qe,mg·g-1) 及去除率 (η) 可有下列公式计算得出:
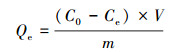

式中,Qe为达到平衡时的平衡吸附量 (mg·g-1);η为相对应的去除率;C0和Ce分别为四环素的初始浓度和吸附平衡时的平衡浓度 (mg·L-1);V为溶液体积 (L);m是加入的吸附剂质量 (g).用同样的方法探究不同条件下Mn@海藻酸对盐酸四环素的吸附性能.且待样品分析完毕,立即倒入反应体系.
2.4 Mn@海藻酸微球复合吸附剂的原位再生
把50 mg复合吸附剂加入到50 mL的10 mg·L-1盐酸四环素溶液中,pH为6,室温搅拌0.5 h, 待吸附平衡后测定溶液的吸光度,计算溶液中盐酸四环素的去除率.然后用离心机分离Mn@海藻酸和上清液,吸附剂用蒸馏水清洗干净,烘干后于同体积、同浓度、同pH的盐酸四环素溶液中,加入1 mL 30%的H2O2,构建类Fenton体系,使吸附在Mn@海藻酸微球上的盐酸四环素氧化降解,反应2 h之后,再次离心.沉淀物用蒸馏水洗净之后,来处理50 mL的10 mg·L-1pH为6的盐酸四环素溶液,测定溶液的吸光度并计算吸附率.按此方法循环3次.
3 结果与讨论 (Results and discussion) 3.1 Mn@海藻酸微球的形成及结构表征
海藻酸钠吸附金属Mn2+的形成见图 2.海藻酸钠固体颗粒加入水中之后,在水溶液中发生水解反应,生成小分子的M单元和G单元.G单元中羧基位于碳/碳/氧的三角形的顶上,比M单元具有更大的活性.当溶液中加入Mn2+后,Mn2+与海藻酸钠G单元经过协同作用相结合,海藻酸钠分子链与链之间通过Mn2+的相互作用而形成三维的网络结构.在这个三维网络结构中,Mn2+占据了中间的亲水空间,同时Mn2+与G单元上的多个O原子之间发生螯合作用,导致链与链之间结合的更加紧密,协同作用更加强烈,最终形成稳定的三维网络结构 (Fang et al., 2007).
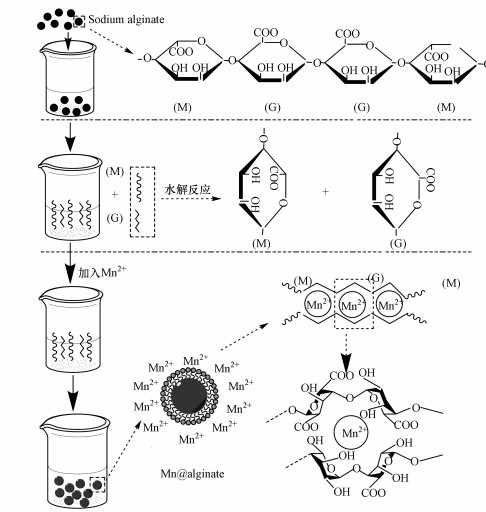
图 2 海藻酸钠微球吸附Mn2+形成图
海藻酸钠微球、Mn@海藻酸微球及其表面选择区域的FE-SEM和EDS如图 3所示.图 3a是海藻酸钠微球的形貌,该微球为实验制备的空白平行样.从图中可以看出其具有明显的球形度,分散性好,且破损较少,说明海藻酸钠微球具有较好的机械强度.海藻酸钠微球的尺寸分布均匀,直径范围为 (40±0.5)~(60±0.5) μm.图 3b是一个放大了的海藻酸钠微球,可以清楚的看到样品保持了海藻酸钠的球形形态,表面粗糙.图 3d是Mn@海藻酸微球的FE-SEM照片,可以看出Ma@海藻酸钠微球大小较均匀, 直径范围为 (23±0.5)~(35±0.5) μm, 较海藻酸钠微球直径减小了约42%,这是由于锰离子与海藻酸钠发生螯合作用,海藻酸钠大分子中间的亲水空间被多价金属离子占据,使得海藻酸链间结合得更紧密,协同作用更强.图 3e是一个典型的Mn@海藻酸微球,样品保持了海藻酸钠球形形貌,表面光滑.采用EDS对海藻酸钠微球 (图 3c) 和Mn@海藻酸微球 (图 3f) 的元素成分进行分析,结果表明在Mn@海藻酸微球的EDS能谱中出现了锰的衍射峰,说明锰离子已经成功的负载到海藻酸钠微球上.

图 3 海藻酸钠微球 (a, b)、Mn@海藻酸微球 (d, e) 的SEM及EDS (c, f) 分析
反应得到的海藻酸钠微球和Mn@海藻酸微球复合吸附剂的FT-IR结果见图 4.海藻酸钠表面具有丰富的羧基 (—COOH) 官能团和羟基 (—OH) 官能团.具体表现在图 4曲线a和b的FT-IR中,1000~1200 cm-1处为C—O的伸缩吸收峰 (Ryu et al., 2010);1500~2000 cm-1和1200~1500 cm-1处分别为CO和CC振动吸收峰 (Shin et al., 2008).波数范围在3000~3700 cm-1为羟基或者羧基内的羟基 (O—H) 的伸缩振动吸收峰,而波数范围在2500~3000 cm-1为C—H伸缩振动吸收峰 (Rakshit et al., 2013).从海藻酸钠微球和Mn@海藻酸微球复合吸附剂的红外谱图对比可以看出,曲线a中O—H的吸收峰较曲线b中的吸收峰向低波数区移动,这是因为羟基上的氧原子与Mn2+之间发生了螯合作用,使得O—H的弯曲振动吸收减弱;C—H面内弯曲振动吸收峰向低波数区移动,这是因为海藻酸钠大分子链之间的螯合作用形成了网状结构,使得C—H吸收峰较弱.因此,当溶液中加入Mn2+后,海藻酸钠大分子链上的氧原子与Mn2+发生螯合作用,形成了稳定的网状结构,即“蛋盒”结构.
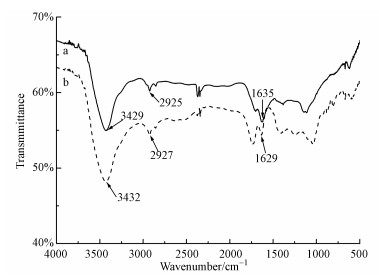
图 4 Mn@海藻酸钠微球 (a)、海藻酸微球 (b) 的FT-IR分析
3.2 吸附时间及初始浓度的影响
图 5为0.1 g Mn@海藻酸微球处理50 mL初始浓度分别为5、8、11、14、17 mg·L-1盐酸四环素废水的吸附曲线.
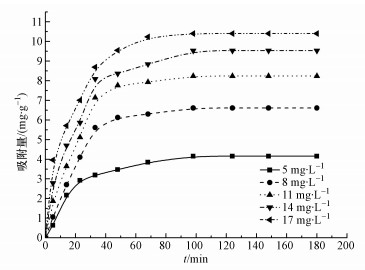
图 5 初始浓度和时间对Mn@海藻酸微球吸附盐酸四环素效果的影响
从图中可以看出,系统在2.5 h之后达到平衡状态,吸附剂对盐酸四环素的吸附量随着盐酸四环素浓度的增加 (从5 mg·L-1增加到17 mg·L-1) 而增大 (从3.575 mg·g-1增加到10.404 mg·g-1).这是因为当盐酸四环素浓度增加时,溶液与吸附剂之间的作用力逐渐增强,盐酸四环素小分子与吸附剂表面的有效碰撞次数增多 (Chen et al. , 2013).吸附过程分为2个吸附阶段,即前期的快速吸附阶段和后期的缓慢吸附阶段.在吸附开始的50 min内,Mn@海藻酸微球对盐酸四环素分子的吸附速率较快,吸附量增大显著.50 min后,随着时间的延长,吸附剂和盐酸四环素分子之间的相互排斥且位阻效应逐渐增强,吸附剂表面剩余的空位点很难被占据,使得吸附趋势变缓,最终2.5 h后逐渐达到吸附平衡状态 (Ma et al., 2012).
3.3 pH的影响
向一系列锥形瓶中加入50 mg的Mn@海藻酸微球复合吸附剂,来处理50 mL浓度为8 mg·L-1的盐酸四环素溶液,分别调节pH值分别为2、3、4、5和6(因为盐酸四环素溶液在碱性溶液中颜色加深,因此本文不讨论其在碱性条件下的吸附性能),每隔一段时间吸取10 mL溶液进行离心分离,测其吸光度.溶液pH与平衡吸附量Qe及去除率η的关系如图 6所示.
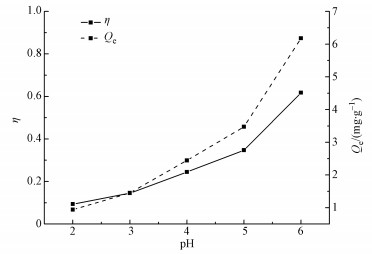
图 6 pH对Mn@海藻酸微球吸附盐酸四环素效果的影响
从图中可以看出,Mn@海藻酸微球复合吸附剂对盐酸四环素的吸附受pH影响较大,平衡吸附量和去除率均随着pH值的增大而增大,当酸性较强时不利于吸附反应的进行.随着pH值的增大,吸附剂对盐酸四环素的平衡吸附量从0.938 mg·g-1(pH=2) 增加到6.178 mg·g-1(pH=6),去除率从9.38% (pH=2) 增大至61.78% (pH=6).这是因为吸附剂表面电性、盐酸四环素电离程度和离子存在形式受pH影响较大 (Chang et al., 2012).酸性较强时,盐酸四环素以阳离子TCH3+的形式存在,Mn@海藻酸微球吸附剂上的氧基官能团也带正电荷,因此,吸附剂和盐酸四环素之间主要以静电斥力为主,使得吸附反应较弱 (邹星等, 2011).然而,随着酸性的减弱,盐酸四环素以两性离子形式存在溶液中,吸附剂与盐酸四环素分子之间的静电斥力逐渐减弱,吸附作用逐渐增强 (Wang et al., 2010).由图 6可知,强酸不利于Mn@海藻酸微球吸附盐酸四环素.
3.4 吸附动力学
在同温同压下,通过改变盐酸四环素溶液的初始浓度,按照相同的实验操作步骤,测定溶液平衡浓度和平衡吸附量,并用Origin软件拟合吸附等温曲线.再利用准一级 (式 (3))、准二级 (式 (4)) 动力学方程及颗粒内扩散模型对Mn@海藻酸微球复合吸附剂吸附盐酸四环素的机理进行分析.
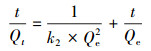
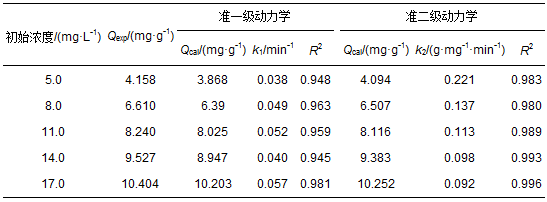
式中,k1和k2分别为准一级动力学 (min-1) 和准二级动力学 (g·mg-1·min-1) 的速率常数,Qt为任意t时刻的吸附量 (mg·g-1).速率常数k1可由ln (Qe-Qt) 对t作图的斜率求得,k2可由t/Qt对t作图的截距求得 (图 7).从图 7可以看出,在不同浓度的盐酸四环素溶液中,准二级动力学明显优于准一级动力学拟合出的线性关系.
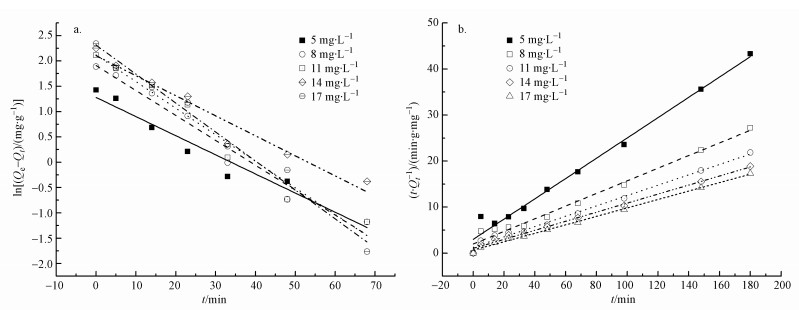
图 7 盐酸四环素在Mn@海藻酸微球上的吸附动力学 (a.准一级动力学; b.准二级动力学)
通过实验所得的吸附动力学平衡吸附量及相关参数如表 1所示.Qcal和Qexp分别代表平衡吸附量的理论值与实际值.
由表 1可知,准二级动力学模型的可决系数明显高于准一级动力学模拟的可决系数.准二级动力学模型的可决系数均在0.98以上,最大值为0.996, 准一级动力学模型的系数范围在0.945~0.981之间.且准二级动力学模型计算出的吸附量与理论值更为接近.因此,Mn@海藻酸微球复合吸附剂对盐酸四环素的吸附过程更加复合准二级动力学模型,拟合效果较好.
本文在准二级动力学模型拟合的基础上,进一步探讨了利用颗粒内扩散模型来拟合Mn@海藻酸微球对盐酸四环素的吸附速率.颗粒内扩散方程表示为:
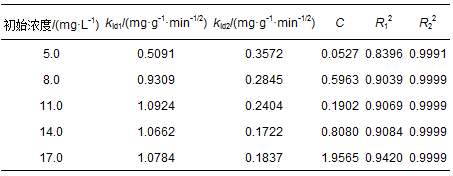
式中,kid为颗粒内扩散的速率常数 (mg·g-1·min-1/2),常数C表示为与边界层厚度有关的常数,通常,C值越大,表示边界层效应越大.kid和C可通过Qt对t0.5作图的斜率和截距求得.
图 8为不同浓度的盐酸四环素在Mn@海藻酸微球上的颗粒内扩散拟合.从图 8可以看出,颗粒内扩散拟合出的直线均未通过坐标原点,说明吸附速率不是仅由颗粒内扩散控制的,边界层扩散作用对吸附速率也有一定的影响.从拟合曲线可以看出,整个吸附过程可分为2个线性阶段.第1阶段为吸附初始阶段,吸附过程主要为表面吸附和边界层扩散,吸附速率较快.随着吸附反应的进行,第2阶段为颗粒内的扩散.随着溶液中剩余盐酸四环素浓度的降低,吸附剂表面空位点较少,而已经吸附在吸附剂表面上的盐酸四环素分子向Mn@海藻酸微球的内部扩散,吸附速率较慢,吸附反应逐渐达到平衡状态.
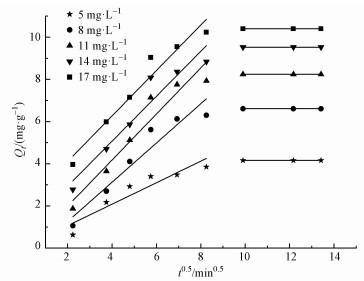
图 8 不同浓度的盐酸四环素在Mn@海藻酸微球上的颗粒内扩散拟合
表 2为颗粒内扩散拟合结果.数据显示,第1阶段扩散速率常数kid1值均高于第2阶段速率扩散常数kid2值.说明随着吸附反应时间的延长,Mn@海藻酸微球吸附剂表面孔道被大量的盐酸四环素分子占据,吸附剂的吸附速率降低.同时,常数C随着浓度的增大而增大.说明随着盐酸四环素溶液浓度的增加,边界层吸附的厚度逐渐增大,边界层效应的影响也随之增大.
表 2 不同初始浓度颗粒内扩散模型拟合结果
3.5 吸附等温线
在相同的温度和压力下,改变溶液中盐酸四环素的初始浓度,测定溶液的平衡浓度和平衡吸附量,并对吸附等温曲线进行拟合.Langmuir (式 (6)) 和Freundlich (式 (7)) 吸附等温方程成为近年来被广泛使用的吸附模型来探索吸附机理.本文按照Langmuir和Freundlich吸附等温方程对Mn@海藻酸微球吸附盐酸四环素的数据进行非线性拟合.
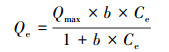
式中,Qmax为吸附剂的单层饱和吸附量 (mg·g-1),b为Langmuir常数 (L·mg-1),表示吸附亲和力, Kf表示吸附能力平衡常数,n代表不均匀系数.Freundlich吸附等温方程是一个经验公式,其n值越大,吸附性能越好.一般认为1/n在0.1~0.5之间,容易吸附;1/n大于2时吸附较难进行.图 9为常温下Mn@海藻酸微球吸附剂吸附盐酸四环素的吸附等温线.
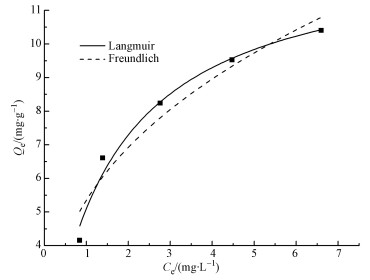
图 9 常温下盐酸四环素的吸附等温线
由图 9和表 3可知,Langmuir吸附等温模型的可决系数为0.978,较Freundlich吸附等温模型 (可决系数为0.922) 能更好的说明Mn@海藻酸微球吸附剂吸附盐酸四环素的吸附过程,拟合更为合理.同时,Freundlich模型拟合出的常数1/n小于0.5,吸附易于发生,表明盐酸四环素易被Mn@海藻酸微球吸附.为了验证吸附过程是否满足优惠吸附,引入无量纲分离因子RL,表达式见式 (8).
(8)

式中,RL为分离系数,表示吸附过程的性质,0 < RL < 1,表示吸附过程为优惠吸附;RL > 1则表示吸附过程不是优惠吸附;RL=1,吸附过程能够可逆进行;RL=0,则为不可逆吸附.通过对实验所得数据计算,RL为0.161,说明Mn@海藻酸微球对盐酸四环素的吸附为优惠吸附.
3.6 吸附热力学
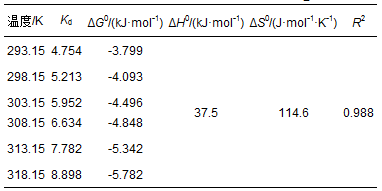
为了考察温度对吸附过程的影响,向锥形瓶中加入制得的Mn@海藻酸微球0.1 g,处理浓度8 mg·L-1的盐酸四环素废水50 mL.在T=293.15、298.15、303.15、308.15、313.15、318.15 K下进行进行吸附试验.吸附过程中的热力学参数如吉布斯自由能变 (ΔG)、焓变 (ΔH) 和熵变 (ΔS) 可通过如下方程得到:
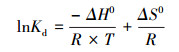
式中,Kd是扩散系数,ΔH0是焓变 (kJ·mol-1),ΔS0是熵变 (J·mol-1·K-1), ΔG0为吉普斯自由能 (kJ·mol-1),T是开尔文温度 (K),R是理想气体常数 (8.314 J·mol-1·K-1).lnKd对1/T作图,可分别由斜率和截距求得ΔH0和ΔS0.ΔG0由式 (11) 求得.所得结果见表 4.由表中结果可知,ΔG0为负值,在-20到0 kJ·mol-1之间,吸附主要通过物理作用进行,作用力以范德华力为主 (Guan et al., 2011),吸附的发生主要为自发反应.同时,随着温度的升高,ΔG0的绝对值也随之增大,表明吸附过程受温度的影响显著.ΔH0小于40 kJ·mol-1,物理吸附占主导.说明该吸附过程为吸热反应 (Li et al., 2010).Mn@海藻酸微球吸附盐酸四环素的ΔH0为37.5 kJ·mol-1,表明盐酸四环素与Mn@海藻酸微球的吸附机理为物理吸附 (Saha et al., 2010).ΔS0为正值说明吸附过程不可逆,且随着吸附的进行,Mn@海藻酸微球表面吸附了大量的盐酸四环素分子,盐酸四环素周围的水分子逐渐减少,自由水分子增多,固液界面混乱度增加.
表 4 Mn@海藻酸微球吸附盐酸四环素的热力学参数
3.7 吸附剂的原位再生
Fe和Mn等3 d轨道过渡金属具有相似的化学性质,Fe2+和H2O2反应产生羟基自由基的反应于1894年被称为Fenton反应.其他过渡金属如Mn等也已被证实可以参与类Fenton反应 (Kasprzak, 2002;Liochev, 1999).许多文献报道,在Mn和帕金森氏症相互关系的研究下,Mn可表现出促氧化损伤活性 (Yamada et al., 1986; Gerlach et al., 1994).本文采用H2O2-Mn2+协同作用构建类Fenton体系再生方法,实验结果如图 10所示.从图 10可以看出,Mn@海藻酸微球复合吸附剂吸附盐酸四环素的初始吸附率为83.2%,吸附率随着循环次数的增加而降低.第3次循环结束时,未经再生的Mn@海藻酸微球复合吸附剂对溶液中盐酸四环素的吸附率下降至23%.这是因为随着吸附循环次数越多,吸附剂表面的活性位点逐渐被盐酸四环素分子占据,使得吸附剂的吸附能力逐渐减弱 (Kyzas, 2012).加入H2O2后,体系中H2O2和Mn@海藻酸微球构成类Fenton体系,经协同作用再生的吸附剂对盐酸四环素溶液的吸附率在循环3次后能达到59%,比未再生的Mn@海藻酸微球的吸附率高36%.这是由于Mn2+与H2O2构成类Fenton体系,Mn2+为反应体系提供了催化剂,加速了H2O2的分解.

图 10 Mn @海藻酸微球吸附剂再生实验
Mn2+与H2O2的反应主要包括3个阶段 (方茹等, 2007; 于怀东等, 2005;Yim et al., 1990).第1阶段为二价锰离子在H2O2的作用下生成三价锰离子和羟基自由基,见反应式 (12).此时,Mn2+周围富集的盐酸四环素分子与羟基自由基不断反应,生成CO2和H2O及一些矿物酸.第2阶段为海藻酸钠表面富集的盐酸四环素分子不断向Mn2+周围移动,促进反应的进行.随着反应的进行,H2O2与羟基自由基反应生成的超氧阴离子O2·-.第3阶段为三价锰离子在超氧阴离子的作用下还原成二价锰离子,促使体系继续反应,且整个体系反应时间较长,并有持续的·OH产生,见反应式 (13)、(14).
另外,H2O2本身是一种强氧化剂,一方面其可作为电子受体俘获电子而产生羟基自由基;另一方面,H2O2本身可吸收电子产生羟基自由基 (·OH),反应体系中·OH的浓度增加,促进反应的进行.羟基自由基可氧化几乎所有的有机物,并在1O2的作用下生成CO2和H2O,反应式如下:
体系中具有强氧化性的氧基基团与有机物发生的氧化反应是整个盐酸四环素降解的重要的步骤,海藻酸钠的吸附性能有效地为H2O2-Mn2+类Fenton作用提供较高的底物浓度,提高再生反应速率,促进有机物的降解.催化剂的再生过程依据反应动力学可分为吸附、迁移和降解3个过程,该反应过程远高于海藻酸钠直接吸附并降解的过程,因此,Mn@海藻酸复合催化剂在Mn2+和H2O2的协同作用下,提高了对污染物的去除率,同时实现有机物的降解和吸附剂的再生的目的,且再生效果良好.
4 结论 (Conclusions)
1) 以海藻酸钠为基体,通过加入Mn2+制备了Mn@海藻酸微球复合吸附剂.复合吸附剂保持了海藻酸钠的球体形貌, 表面光滑, 颗粒分布均匀,粒径约为 (23±0.5)~(35±0.5) μm,分散度好.
2) 以盐酸四环素废水为处理对象,探讨了初始浓度、pH、吸附时间对吸附去除性能的影响.结果发现,强酸不利于吸附,吸附量随着盐酸四环素初始浓度的增大而增加.吸附初始阶段为吸附速率较快的外表面吸附,吸附第2阶段为吸附速率较慢的颗粒内扩散吸附.体系在2.5 h后逐渐接近吸附平衡状态.同时,通过对准一级、准二级吸附动力学模拟,表明吸附剂的吸附过程更符合准二级动力学方程.吸附过程可用Langmuir型等温模型拟合,0 < RL < 1说明该吸附过程易于进行.通过热力学模拟,表明吸附剂吸附盐酸四环素的过程是自发进行的,主要为物理吸附.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3) 通过H2O2构建的类Fenton氧化体系的原位再生实验表明,Mn2+和H2O2的加入能使溶液中产生强氧化性的羟基自由基,能氧化废水中的盐酸四环素,显著提高降解效率,使表面富集有盐酸四环素的Mn@海藻酸微球吸附剂可实现有效再生,重复使用.