人工湿地具有成本低、操作维护简单、二次污染小等优点, 被应用于各类废水处理.然而, DO的缺乏限制了人工湿地的广泛应用.人工曝气作为一种提高DO浓度的有效手段, 被用于提高湿地系统处理性能.由于持续曝气运行成本高, 且易引起硝化和反硝化的矛盾, 因此, 间歇曝气作为一种降低运行成本的优化方法, 可以创造交替好氧和厌氧环境, 提高脱氮性能.
然而, 间歇曝气人工湿地中氧扩散效率较低, 易造成系统DO分布不均, 导致温室气体N2O的排放量增加.Schulthess等发现当DO浓度由0升至4mg·L-1时, N2O占气态产物的比率由0上升至6%.生物炭作为一种多功能的环保材料, 近年来逐渐被应用于人工湿地污水处理过程.Sun等将生物炭和污泥基质应用于间歇曝气地下污水渗滤系统, 实现13.5%TN去除效果的提升.Zhou等将生物炭应用于垂直潜流人工湿地中, 提高了系统的脱氮性能, 降低了系统N2O释放通量.尽管已有生物炭对传统潜流人工湿地污染物去除及温室气体排放的影响的相关研究, 但国内外关于生物炭在间歇曝气人工湿地中的应用的研究还非常有限.故本实验通过构建曝气生物炭潜流人工湿地系统, 探究了生物炭对系统脱氮及N2O释放的影响, 以期为生物炭在人工湿地中进一步的应用提供依据.
1 材料与方法1.1 实验装置
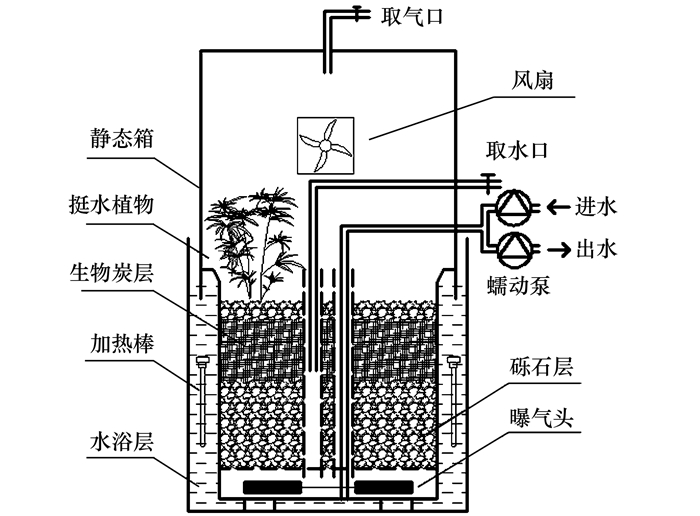
本实验装置为聚乙烯塑料圆筒(图 1), 每个容器表面积为0.1 m2, 深为35 cm.根据侯洁[12]的研究结果, 按40%的体积比投加生物炭构建微型湿地系统, 并以无生物炭添加的常规湿地系统作为对比, 分别命名为SW和CW.湿地系统中, 按照比例填充砾石(平均粒径2 mm)和生物炭.系统中两根PVC穿孔管用于虹吸排水、取样及各种物理和化学参数的测定.系统外壁设5 cm水浴层, 并利用加热棒加热保持室温(26±1)℃.系统底部设有曝气头, 利用气泵进行人工曝气增氧, 利用气体质量流量控制器(AST10-DX, 阿斯特, 北京)精确控制流量(660±5)mL·min-1, 时间开关控制曝气时间.
图 1
图 1 实验装置示意
本实验生物炭原料为芦竹秸秆, 洗净烘干后置于气氛炉(SMX1100-20, 上海尚群, 中国)中, 以10℃·min-1的升温速率, 在终温500℃热解炭化2 h获得.所获得生物炭的比表面积为345.92 m2·g-1, 孔径为1.95 nm, 孔容为0.2467 cm3·g-1.湿地植物选用旱伞草(Cyperus alternifolius L.), 经实验室驯化后以36株·m-2的种植密度植入湿地系统.污泥取自某生活污水处理厂, 经实验室驯化后接种湿地系统.
1.2 系统运行
人工湿地进水采用自来水配置, 并经蠕动泵(BT-300EA, 重庆杰恒, 中国)进行周期进出水, 每升进水包括:蔗糖114 mg; 蛋白胨7.5 mg; 233 mg C6H12O6; 160 mg NH4Cl; 200 mg NaHCO3; 11 mg KH2PO4; 18 mg K2HPO4·3H2O; 10 mg MgSO4·7H2O; 10 mg FeSO4·7H2O; 7.6 mg CaCl2和1 mL微量元素液.每升微量元素液包括:0.15 g H3BO3; 0.03 g CuSO4·5H2O; 0.18 g KI; 0.12 g MnCl2·4H2O; 0.06 g Na2MoO4·2H2O; 0.12 g ZnSO4·7H2O; 0.15 g CoCl2·6H2O和10 g EDTA-Na2.进水水质包括:(405±9)mg·L-1 COD, (35.5±0.6)mg·L-1 NH4+-N, (39.4±0.6)mg·L-1 TN, 进水pH控制为7.6±0.3.曝气方式为间歇曝气, 停留时间24 h, 包括4个阶段, 每个阶段曝气3 h(曝气段)、闲置3 h(闲置段), 曝气段DO控制为(2.0±0.3)mg·L-1.湿地有效进水量为12 L.
1.3 样品收集及测定方法1.3.1 水质分析
本实验为期半年, 系统稳定运行期间每2~3 d进行一次水质测定; 典型周期内水质测定在系统稳定期进行, 时间间隔为0.5~3 h(视反应情况而定).其中, 进出水污染物COD、NH4+-N、NO2--N、硝态氮(NO3--N)、总氮(TN)浓度均按照标准方法进行测定; DO和水温(T)使用溶解氧仪(YSI-550A, 美国DAKODA公司)测定; pH值使用pH计(PB-10, 德国Sartorius公司)测定.
1.3.2 N2O采集与测定
根据姜秀丽的研究方法, 气态N2O采集采用静态箱法:在反应周期的闲置段保证反应器完全密闭, 曝气段采样口开放以排气; 每间隔10~30 min抽取反应器上部空间混合器于气体采样袋中.溶解态N2O采用上部空间法:于反应器内取30 mL混合液缓慢加入顶空瓶中, 立即加入1 mL 3 g·L-1的HgCl2溶液(抑制微生物活性), 通入氮气排尽空气后迅速塞好橡胶塞, 置于恒温振荡器(ZWYR-2101, 上海智城, 中国)上振荡1 h, 取出后稳定15 min, 抽取上部空间气体于采样袋中.收集后的气体24 h内经气相色谱仪(7890D, Agilent, 美国)测定.计算公式如下.
缺氧段:

好氧段:

累积释放量:

溶解态浓度:

式中, W:N2O释放速率, g·(m2·min)-1; P:大气压强, Pa; Vair:反应器内上部空间体积, L; M:N2O摩尔质量, 44.02 g·mol-1; Cn:第n次采样N2O的体积分数; R:气体常数, 为8308.65 L·Pa·(K·mol)-1; T:气体温度, K; Δt:第n次和第n-1次采样的时间间隔, min; AS:湿地床表面积, m2; Q:曝气流量, L·min-1; C:气样中N2O的体积分数; M:周期内N2O的释放量, g·m-2; Wn:第n次采样相应的释放速率, g·(m2·min)-1; cdis:溶解态N2O的浓度, g·L-1; K0:N2O的Ostwald系数; β:顶空瓶内空气体积与溶液体积的比值; C′:平衡状态下气相中N2O的体积分数.
1.4 数据统计与分析
全部样品水质和气体分析测试平行3次, 数据表达采用平均值±标准差.本实验数据通过Origin 8.1整理作图, 并由SPSS 18.0进行数据分析.对象之间的差异性分析采用单因素方差分析(one-way ANOVA, 水平包括显著P < 0.05和极显著P < 0.01), 相关性分析采用Pearson检验(水平包括显著P < 0.05和极显著P < 0.01).
2 结果与讨论2.1 系统有机物污染去除效果及脱氮效果
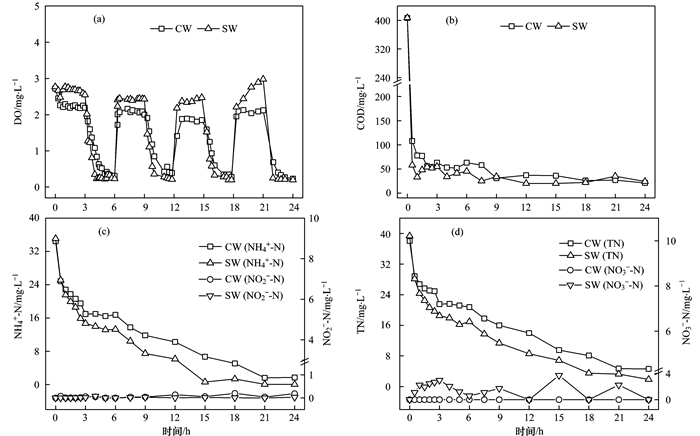
系统稳定运行期间运行效果如图 2所示.SW系统曝气段平均DO浓度为2.66 mg·L-1, 较CW系统提高了0.43 mg·L-1 [图 2(a)], 生物炭的投加改善了系统DO条件.由图 2(b)可知, CW和SW系统出水COD浓度在25 mg·L-1左右, 去除率接近95.0%, 生物炭的投加对系统COD去除效果无显著影响(P>0.05).这是由于曝气潜流人工湿地系统COD去除能力强, 生物炭的投加对系统COD去除的促进作用并不明显.
图 2
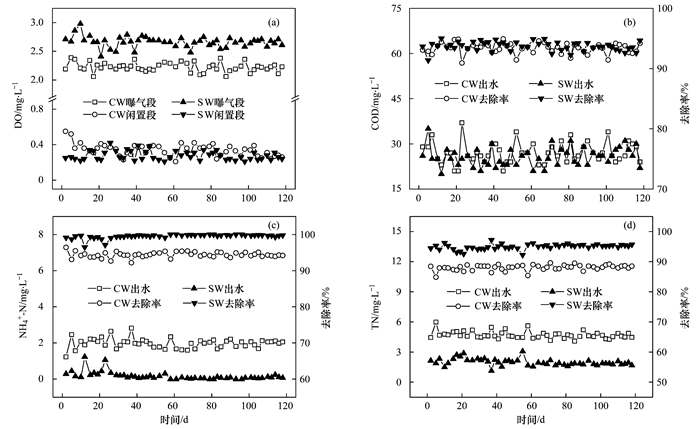
SW系统出水NH4+-N稳定低于0.5 mg·L-1, 平均去除率为99.5%, 较CW提高了5.1% [图 2(c)].另外, CW和SW系统稳定运行期间, 出水中均无NO3--N和NO2--N检出, SW系统TN平均去除率(95.0%)较CW(88.1%)降低了6.9% [图 2(d)], 与Gupta等结果相一致.生物炭具有较大的孔隙率和比表面积, 其添加可促进系统内气水充分接触, 改善系统DO条件, 并强化生物膜的附着能力及微生物的活性, 促进硝化作用, 从而提升系统脱氮性能.
2.2 典型周期内有机物污染去除效果及脱氮效果
系统周期内水质跟踪测定结果如图 3所示.CW和SW进水后半个小时内系统DO迅速降至2.11 mg·L-1和2.67 mg·L-1, 随后CW和SW系统曝气段DO稳定在2.2 mg·L-1和2.5 mg·L-1, 闲置段DO水平约为0.3 mg·L-1和0.2 mg·L-1.闲置段初期, SW系统DO下降速度明显快于CW系统.生物炭相对砾石来说, 其发达的空隙结构和比表面积不仅改善了系统通气性, 促进了气水的充分接触; 其较强的生物膜附着能力及较大的微生物附着量, 也有助于水中DO被微生物充分利用.两系统典型周期内COD变化无显著差异(P>0.05), 好氧-厌氧的交替环境为微生物提供了良好的生活环境.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
图 3
图 3 不同湿地系统典型周期内DO、COD、NH4+-N及TN浓度变化
湿地系统脱氮主要依靠完整的硝化反硝化作用, 而系统内不同DO条件和充足碳源是保证硝化反硝化进行的关键.由图 3(c)可知, SW系统NH4+-N降解速率明显快于CW.SW系统在进水15 h后NH4+-N浓度已基本稳定在0.03 mg·L-1, 24 h后出水NH4+-N降解率达到99.9%;而CW系统在进水21 h后才趋于稳定, 出水NH4+-N浓度1.72 mg·L-1, 降解率为95.0%.CW和SW系统运行初期, 充足的DO和碳源为硝化反硝化反应提供了有利条件, NH4+-N被快速转化, 同时反硝化微生物进行厌氧/缺氧反硝化和好氧反硝化去除NO3--N.CW系统周期运行过程中无NO2--N和NO3--N积累, SW只有少量NO3--N积累[图 3(c)和3(d)].CW和SW系统TN去除效果同NH4+-N类似, 周期出水TN浓度分别为4.59 mg·L-1和1.85 mg·L-1, 生物炭的投加强化了湿地系统脱氮效果.CW和SW系统脱氮主要通过曝气段同步的硝化反硝化过程, 这与现有的相关研究吻合.在间歇曝气潜流人工湿中同时存在好氧、缺氧和厌氧区, 而生物炭的投加不仅能够促进系统通气性能, 生物炭层内部形成的不同DO梯度也能够改善系统好氧厌氧环境, 有利于系统脱氮.
2.3 生物炭对系统N2O排放的影响
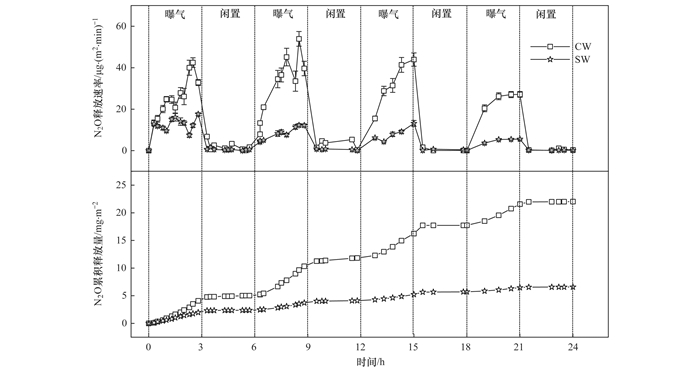
由图 4可知, CW和SW系统的N2O释放主要集中在曝气段, 且SW系统各阶段N2O释放速率与积累量均显著低于CW.其中, CW和SW系统N2O最高释放速率分别为53.92 μg·(m2·min)-1和17.62 μg·(m2·min)-1; 相较于CW系统24 h的N2O累积释放量(22.03 mg·m-2), SW系统(6.58 mg·m-2)减排达到70.0%.CW和SW系统N2O平均释放速率分别为0.92 mg·(m2·h)-1和0.27 mg·(m2·h)-1.Zhou等的研究发现, 在进水COD和NH4+-N浓度分别为200 mg·L-1和40 mg·L-1条件下, 生物炭曝气湿地N2O平均释放速率为0.27 mg·(m2·h)-1, 与本实验的结果一致.
图 4
图 4 不同湿地系统典型周期内N2O释放速率及累积释放量
不完全的硝化反硝化是人工湿地系统中N2O产生的主要途径.在CW中, 局部低氧条件导致自养氨氧化细菌(AOB)好氧反硝化产生N2O, 而闲置段高DO浓度抑制了Nos的活性, 造成N2O的释放[25, 26].在SW中, N2O释放速率与系统内NO3--N浓度呈显著正相关(R2=0.754, P < 0.05).曝气段高DO浓度抑制了细菌Nos的活性, 导致N2O的积累.然而, 生物炭的投加增加了系统通气性, 改善了系统内部低氧区的DO条件, 减少了AOB好氧反硝化过程, 实现N2O的减排.在闲置段, 生物炭的投加使DO迅速降低[图 3(a)], 利于厌氧反硝化过程的完全进行, 降低N2O释放量.有研究发现, 生物炭的添加还能增加Nos基因丰度, 促进N2O还原为N2.另外, 生物炭作为潜在的碳源, 也可以促进反硝化过程中N2O还原为N2, 减少N2O的排放.
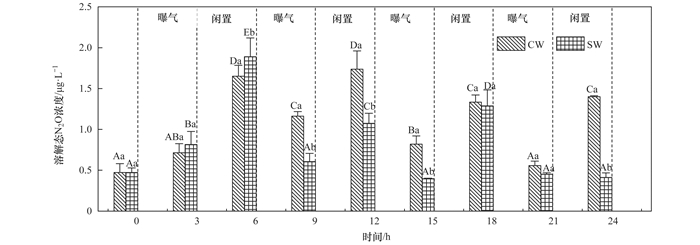
CW和SW各阶段末端溶解态N2O浓度如图 5所示.CW和SW系统平均溶解态N2O浓度分别为1.05 μg·L-1和0.83 μg·L-1.闲置段末端各系统溶解态N2O浓度明显高于曝气段末端, 这是由于闲置段溶解于水中的N2O在曝气过程中被吹脱释放所致.由于水中N2O溶解度有限, 反应初期各湿地N2O释放速率均较大, CW和SW内部溶解态N2O含量差异不显著(P>0.05);随着反应进行, SW较低的N2O释放速率使得其内部溶解态N2O浓度低于CW.系统N2O排放主要集中在曝气段, 而产生的N2O溶解于水中又被吹脱出来, 故系统中溶解态N2O只占释放总量的极少部分.
图 5
图中不同字母揭示不同处理的差异性(P < 0.05), 其中大写字母揭示不同阶段之间差异, 小写字母揭示不同湿地之间差异图 5 不同湿地各阶段末端溶解态N2O浓度
(1) 生物炭湿地系统曝气段DO较对照组湿地提高了0.43 mg·L-1, 且生物炭湿地系统闲置段DO下降速度快于对照组湿地.
(2) 各系统COD去除效果无明显差异, 去除率接近95.0%.生物炭的投加提高了系统5.1%的NH4+-N和6.9%的TN去除效果.
(3) 生物炭湿地系统N2O平均释放速率为0.27 mg·(m2·h)-1, 24 h累积释放量为6.58 mg·m-2, 较对照组湿地实现N2O减排70.0%.(来源:环境科学 作者:王宁)