近几十年来, 由于氟聚合物优异的耐高低温性、化学稳定性、绝缘性、低摩擦性、不燃性、润滑性等性能, 促进了氟化工行业迅猛发展, 其氟聚合物产品被广泛应用于制冷、航空航天、石油化工、机械、电子、冶金等领域(高明华等, 2004).与此同时, 水环境中有机氟化物的污染也日益严重, 对人类的健康和生存构成了威胁.因此, 需要更多的研究来解决氟化工废水处理过程中遇到的难题(Frömel et al., 2010;Giesy et al., 2010).
氟化工废水具有有机物浓度高、毒性强、可生化性差、成分复杂、色度高、有异味、强酸强碱性等特点(王萍等, 2012), 在废水处理时, 大大限制了生物法的应用.与处理费用较高且出水效果不佳的纯物理化学方法相比, 物化+生物的组合技术相对更加经济高效.潘伟刚等(2010) 采用微电解-ClO2催化氧化-生化复合废水处理技术对含氟废水进行预处理, 再用A/O生物法处理的工艺, 取得了较为理想的出水效果.因此, 物化预处理+生物法组合工艺技术的应用, 将大大提高氟化工废水的处理效果和经济可行性.不可否认, 该组合技术的核心元素仍然是生物法, 而找到耐毒性强、降解效果好的微生物将成为水质达标排放的关键因素.
在废水可生化性研究中, 用传统的BOD5/CODCr比值法来评价废水的生物处理可行性尽管方便, 但比较粗糙, 因为废水的BOD5/CODCr值不可能直接等于可生物降解的有机物占全部有机物的百分数, 还受到水质特征和杂质干扰的影响(韩玮, 2004;郭文成等, 1998).与此相比, 好氧呼吸速率的大小可直接反映活性污泥的生物活性, 使得用呼吸速率来评价废水可生化性的方法越来越受到人们的关注.Strathtox呼吸仪在监测废水中污泥的适应性及可生化性方面具有操作简单、实验周期短、准确度高的特点.Aspray等(2007) 利用Strathtox呼吸仪检测土壤泥浆呼吸运动状况, 说明了微生物在土壤中的适应性及土壤修复情况;Hartmann等(2013) 利用Strathtox呼吸仪检测活性污泥中微生物的呼吸状况, 说明金属物质会抑制活性污泥的活性及污泥的适应状况.因此, 在氟化工废水处理系统中, 对该类废水有降解作用的好氧或兼氧微生物, 必将加快溶解氧的消耗速率, 并能通过呼吸仪监测反映出来.
本研究以氟化工废水为研究对象, 通过Strathtox活性污泥呼吸仪测定3种活性污泥在不同类型氟化工废水中的呼吸速率, 进而说明3种污泥在该废水中的适应能力和废水的可生化性.同时, 采用PCR-DGGE及克隆技术分析3种污泥中微生物多样性和菌种特征, 以期获得在氟化工废水中具有耐毒性、降解效果好的优势菌种, 为进一步提高氟化工废水生化处理效能提供理论依据和新途径.
2 材料与方法(Materials and methods) 2.1 废水及材料来源
试验所用的氟化工废水取自浙江某大型氟化工厂污水处理厂, 3种污泥分别为采自该氟化工污水处理厂一期工程的活性污泥S1(A/O工艺的二沉池污泥)、二期工程的活性污泥S2(二级A/O工艺的二沉池污泥)及城市污水处理厂的活性污泥S3.污泥均为二沉池回流污泥, 初始污泥浓度控制在2000 mg·L-1.用来配制模拟废水的葡萄糖(分析纯)购于国药集团公司, SPE萃取小柱(150 mg, 6 mL)购于CNW公司.
2.2 试验方法
3种污泥曝气2 h后, 分别与葡萄糖模拟废水、原始氟化工废水、经过SPE-HLB小柱萃取后的氟化工有机模拟废水混合, 设置污泥负荷分别为0.1、0.2、0.5 g·g-1·h-1(以每g MLSS中的COD计, 下同)3个梯度, 用于测定其呼吸速率, 污泥浓度维持在2000 mg·L-1.
2.3 分析方法 2.3.1 生化分析
COD采用COD快速消解仪(上海雷磁)测定, TOC采用TOC仪(日本岛津)测定, 污泥呼吸速率使用Strathtox呼吸仪(德国)测定, 重金属由原子吸收光谱仪(AA-6300C日本岛津)测定, pH 值采用pH 计(OHAUS Starter 3C, 美国奥豪斯) 测定, 盐度值采用便携式盐度计(哈希HQ40) 测定, 光学显微镜观察污泥生物相种类、数量及生长状况.
2.3.2 PCR-DGGE
采用离心式DNA 快速提取试剂盒(Qiagen, 美国)提取细菌的总DNA, 采用细菌通用引物8F-GC、518R对总细菌16S rDNA 进行两轮PCR扩增.第一轮PCR反应采用50.0 μL的反应体系, 其组分包括:9.0 μL的去离子水, 25.0 μL的2×KODFx buffer, 10 μL的dNTP (10 mmol·L-1), 1.5 μL的8F引物 (10 μmol·L-1), 1.5 μL的引物798R(10 μmol·L-1), 1.0 μL的KODFx(1 U·μL -1, Toyobo), 以及2.0 μL的DNA 模板.第一轮PCR反应条件如下:94 ℃预变性2. 0 min;98 ℃变性10 s, 58 ℃退火15 s, 68 ℃延伸1.0 min(每个循环温度降低0.1 ℃), 共循环25次;最后在68 ℃条件下延伸10.0 min.第二轮PCR反应采用50.0 μL 的反应体系, 其组分包括:10.0 μL的去离子水, 25.0 μL的2×KODFx buffer, 10 μL的dNTP(10 mmol·L-1), 1.5 μL的F341引物(10 μmol·L-1, 含GC-clamp), 1.5 μL的引物R518(10 μmol·L-1), 1.0 μL的KODFx(1 U·μL-1, Toyobo), 以及1.0 μL的第一轮DNA 产物.第二轮PCR反应条件如下:94 ℃预变性2.0 min;98 ℃变性10 s, 58 ℃退火15 s, 68 ℃延伸30 s(每个循环温度降低0.1 ℃), 共循环35次;最后在68 ℃条件下延伸10.0 min.
DGGE在D-code系统(Bio-Rad, 美国)上进行, 聚丙烯酰胺凝胶浓度为8.0%, 电泳条件:凝胶变性梯度40%~60%, 电泳缓冲液为1×TAE, 电泳温度60 ℃, 电压100 V, 电泳时间20 h.电泳结束后, 快速银染后, 进行DGGE凝胶图片的拍照.
2.3.3 克隆测序
选择DGGE 胶板上含有目的DNA 的条带, 用灭菌后的手术刀切下并迅速转移至离心管中, 用灭菌后的刀片将胶块压碎, 称重后, 加入2倍体积的diffusion buffer;50 ℃水浴30 min, 离心(12000 r·min-1, 1 min), 保留上清;过滤柱过滤上清, 保留流出液;估计体积, 加入6倍体积的Buffer QX1和10 uL QIAEX II, 室温混匀10 min;离心(12000 r·min-1, 1 min)后, 500 μL Buffer PE漂洗2次;干燥沉淀, 加入10 μL Tris Buffer(pH 8.0) 进行溶解.取5.0 μL上清液为模板, 采用总细菌引物8FGC和518R进行PCR扩增.扩增产物采用1.5%琼脂糖凝胶进行电泳, 检测回收产物, 用QIAquick PCR纯化试剂盒对扩增产物进行纯化, 送往TaKaRa公司进行测序.
2.3.4 DGGE图谱统计分析
采用Shannon-wiener多样性指数H′表征微生物种群多样性, 其计算公式如下(Gafan et al., 2005):
| (1) |
式中, Pi=ni /N;ni为第i个条带的强度;N为所有条带强度总和.
2.4 活性污泥降解氟化工有机物废水验证实验
本实验利用自行设计的总容积为7.5 L的SBR反应器进行驯化实验.以取自浙江某大型氟化工企业中的化工废水为原料, 经0.45 μm滤膜过滤后, 滤液经过活化平衡后的SPE-HLB小柱, 上样、淋洗和洗脱得到有机污染物, 小柱对氟化工有机物的回收率为96%.将分离后的有机污染物用超纯水配制成母液, 用TOC仪测定TOC, 并配制TOC浓度分别为50、100、200、300、400、500 mg·L-1的模拟废水进行污泥负荷逐步增加的驯化实验.
3 结果与讨论(Results and discussion) 3.1 不同活性污泥在不同类型废水中呼吸速率的变化特征
由表 1可知, 氟化工原始废水中含有Cu、Ni、Pb、Cd、Cr、Mn、As等重金属, 且盐度值高达53400 mg·L-1;经过SPE小柱萃取所得的氟化工有机物模拟废水, 其重金属含量都在检测限以下, 盐度值为365 mg·L-1, 不同废水水质差异明显.
污泥的呼吸速率大小可以表征污泥活性的强弱, 说明污泥中毒的程度, 从而论证废水生物降解的可行性.由表 2可知, 污泥S1在葡萄糖配制的模拟废水中, 随着污泥负荷从0.1 g·g-1·h-1增加到0.5 g·g-1·h-1时, 其呼吸速率由41.10 mg·L-1·h-1上升到174.00 mg·L-1·h-1, 最后又下降到58.20 mg·L-1·h-1.说明在以葡萄糖作为碳源的废水中, 污泥负荷过高、过低都不利于污泥达到最佳活性, 且在污泥负荷为0.2 g·g-1·h-1时, 呼吸速率最大.当污泥负荷较低时, 由于营养元素的不足, 导致污泥中微生物竞争较为激烈, 影响微生物酶系统的正常代谢(袁青彬等, 2014), 随着污泥负荷的增加, 微生物所需的营养元素得到满足, 促进了新陈代谢;此时再提高模拟废水浓度, 可能使得微生物处在高浓度环境中, 破坏了细胞内的水质平衡, 进而影响酶活性系统, 导致正常代谢受阻, 呼吸速率下降.
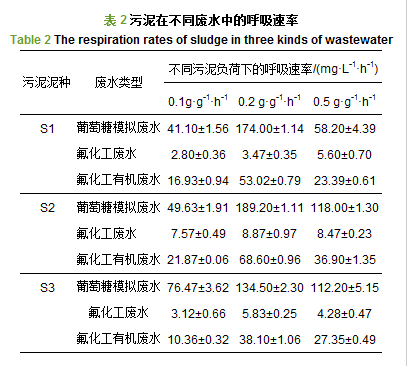
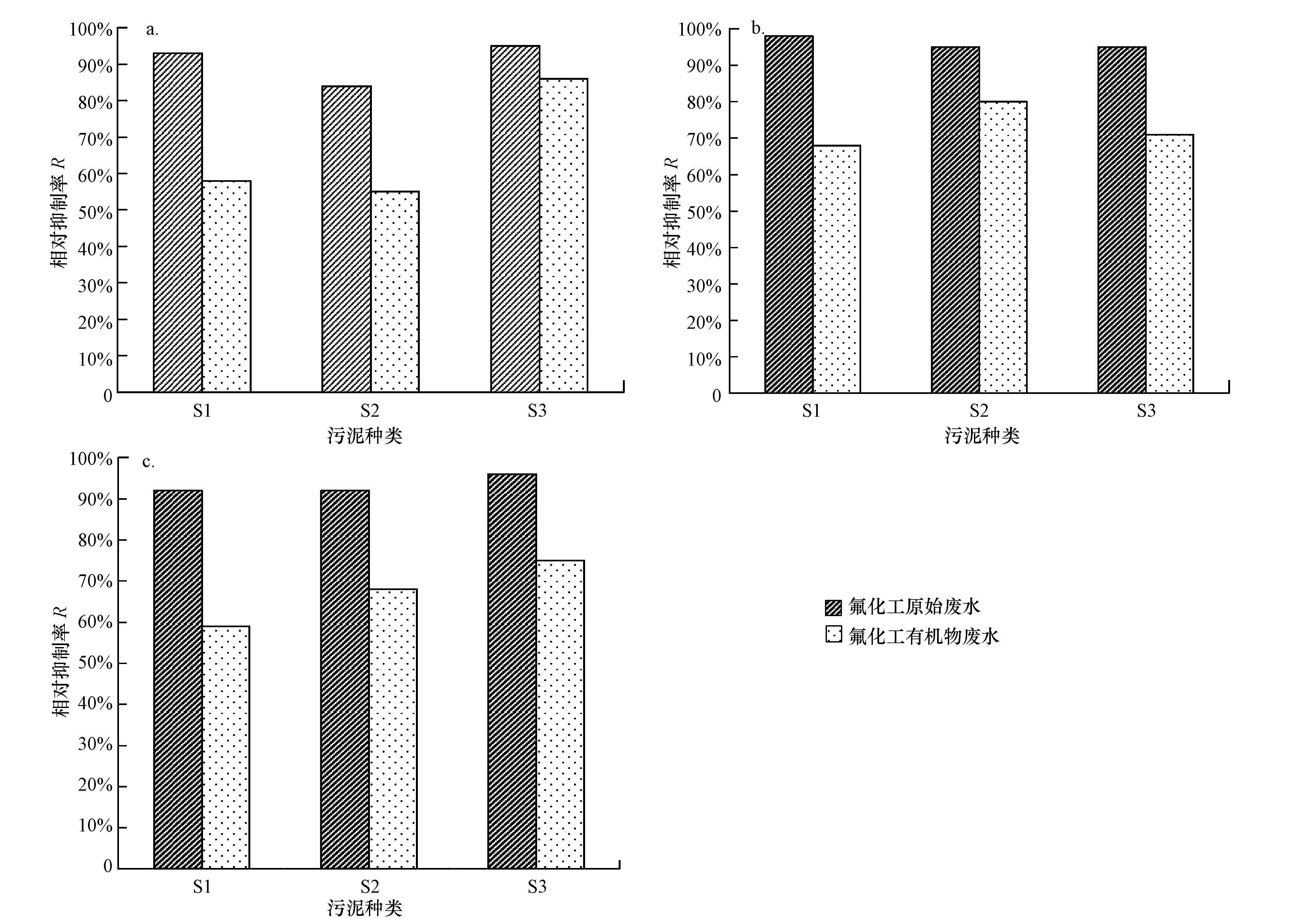
污泥S1在原始氟化工废水中, 微生物的呼吸速率降至最低, 在3种不同的污泥负荷下, 呼吸速率分别是2.80、3.47、5.60 mg·L-1·h-1, 由图 1可知, 其相对抑制率((1-污泥在其他废水中的呼吸速率/污泥在葡萄糖模拟废水中呼吸速率)×100%)分别达到了93%、98%、92%.由于原始氟化工废水中高盐度及重金属的存在, 加上高浓度的有机污染物, 使得污泥中毒较深, 微生物的代谢作用受到严重抑制甚至停止(梁凯, 2011).污泥负荷的提高从某种程度上增加了微生物可利用的营养元素, 但同时也增加了污泥的中毒程度, 因此, 随着污泥负荷的增加, 呼吸速率并没有显著提高.此时, 废水的生物处理是不可行的.这与之前众多学者报道的结论相一致:氟化工废水的生化性较差.与之相对的, 污泥在氟化工有机物废水中, 在污泥负荷由0.1 g·g-1·h-1增加到0.5 g·g-1·h-1时, 污泥呼吸速率由16.93 mg·L-1·h-1增加到53.02 mg·L-1·h-1, 并没有增加到本实验中呼吸速率的最大值174.00 mg·L-1·h-1, 随即降低到23.39 mg·L-1·h-1;污泥活性在该废水中受到抑制, 说明有机物在提供给微生物碳源的同时, 也增加了污泥的中毒程度, 在促进与抑制的平衡过程中, 抑制起主导作用.与此同时, 污泥呼吸速率与氟化工原始废水中的呼吸速率相比, 已有明显提高, 呼吸抑制率也分别下降到58%、68%、59%, 说明污泥在氟化工的有机废水中, 微生物有一定的抗毒性, 通过自我调节可适应低毒环境.污泥S2和污泥S3在不同废水中污泥呼吸速率的变化趋势与S1类似, 但3种污泥在不同废水中的最佳呼吸速率并不相同.葡萄糖中污泥S1的最佳呼吸速率为174.0 mg·L-1·h-1, 污泥S2为189.20 mg·L-1·h-1, 污泥S3为134.50 mg·L-1·h-1, 呼吸速率大小为S2> S1> S3;在氟化工有机物模拟废水中, 污泥S1的最佳呼吸速率为53.02 mg·L-1·h-1, 污泥S2为68.60 mg·L-1·h-1, 污泥S3为38.10 mg·L-1·h-1, 呼吸速率大小为S2> S1> S3.显然, 污泥S2在氟化工有机物模拟废水中的活性最佳, 抗毒性最好.但3种污泥的相对抑制率分别为68%、80%、71%, 抑制率大小为S2>S3> S1, 表明污泥S1的抗冲击能力比较强, 在不同废水环境的适应能力更强.与此同时, 我们也可以做出假设, 3种污泥在不同废水中表现出呼吸速率之间的差异, 可能与活性污泥中微生物群落结构、菌种及菌种多样性有关.
图 1(Fig. 1)
|
|
|
图 1 不同污泥负荷下的污泥呼吸速率相对抑制率 (a.0.1 g·g-1·h-1;b.0.2 g·g-1·h-1;c.0.5 g·g-1·h-1) |
3.2 不同活性污泥中微生物群落结构分析 3.2.1 不同活性污泥中微生物的DGGE图谱
3种污泥9个样本PCR产物的DGGE电泳结果见图 2(每种泥样取空间分布不同的3个采样点).从图 2a中可以看出, 每个样品的电泳条带数目、条带强度和条带迁移速率均存在一定的差异, 进而表征了污泥样品中微生物多样性的不同.采自污泥S1生化池不同区域的3个样品的条带基本相似, 且条带a和条带b相对比较粗黑, 是优势菌群.采自污泥S2生化池不同区域的3个样品的条带不同, 共同的微生物种属如图中标注的F、G, 各自特有的种属如图中标注的g、h、j, 说明了菌种在空间区域分布上存在一定差异.采自污泥S3生化池不同区域的3个样品的条带也不相同, 三者既有共同的一些微生物种属, 如图中标注的I、M, 也各自特有的种属, 如图中标注的n、o、p.在3类污泥的图谱对比中发现, S1的条带最为丰富, 菌种最多, 三者的微生物多样性存在差异, 这与3种污泥在废水中呼吸速率表现出差异的情况是一致的.由图 2b可知, 在两种处理不同水质的污泥里, 通过DGGE技术分离得到的优势菌种存在明显的差异.S1是处理化工废水的污泥, 其优势菌群如图所示为q、r、s、t、u;S3是处理城市生活污水的污泥, 其优势菌如图所示为v、w、x、y;两种污泥各自特有的微生物种群是在处理各自特征废水过程中, 经过长期演替而适应的优势菌种;也从微观上揭示了S3与S1、S2在氟化工废水中生物活性相差较大的原因.
图 2(Fig. 2)
|
|
|
图 2 污泥总细菌DGGE指纹图谱 |
3.2.2 不同活性污泥中微生物聚类分析
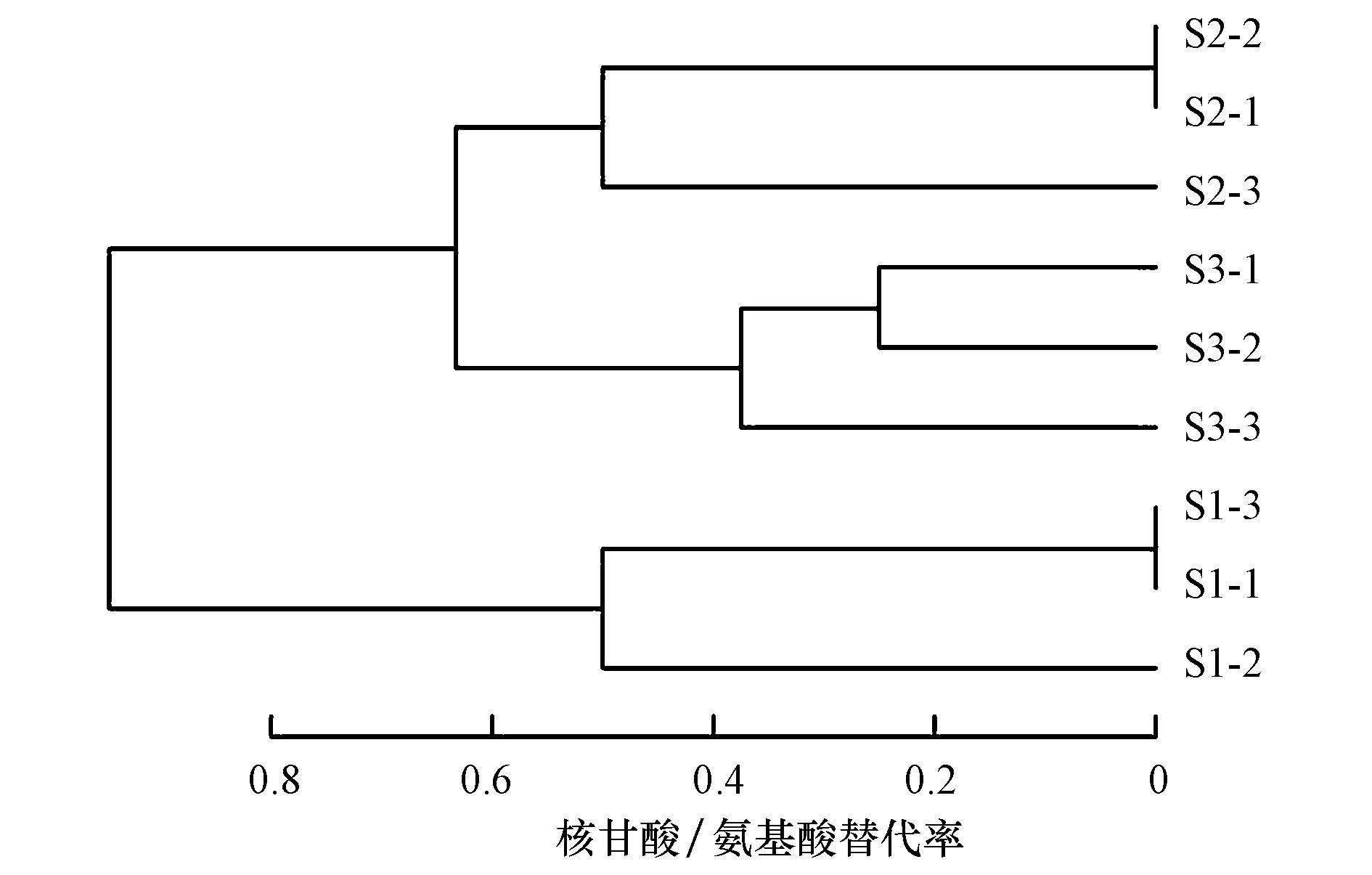
为进一步比较各个样品间微生物群落多样性相似程度, 对9个样品进行UPGMA聚类分析, 构建样品的聚类树, 研究它们之间的相似性.UPGMA聚类结果如图 3所示, 从图中可得, S2-1、S2-2、S2-3聚在同一树枝上, 说明这3个样品之间的菌种相似性较高;同理可得, S3-1、S3-2、S3-3样品之间的菌种相似性较高, S1-1、S1-2、S1-3样品之间的菌种相似性较高.研究发现, 9个样品基本上分成了三大种族, 每一种族代表了一种泥样, 显示了它们在微生物结构特征上的差异, 该差异也是它们在处理相同废水时, 产生不同呼吸速率并且表现出不同适应性的重要原因.
图 3(Fig. 3)
|
|
|
图 3 三类污泥中总细菌群落结构的聚类分析 |
3.2.3 不同活性污泥中微生物香浓指数多样性分析
利用Band view分析软件, 得到一系列衡量样品多样性的指标, 结果如表 3所示.由表 3可知, S1-1、S1-2、S1-3的香浓指数最高都为1.61, 说明S1样品中的菌群数量最为丰富, 微生物种类更多且各种间数量分布更均衡;同时, S2-2、S3-2的香浓指数最低都为0.69, 说明这两个样品中菌群数量相对贫乏.与3.1节3种污泥在3种废水中的呼吸速率变化差异是一致的.由于S1的物种最为丰富, 从葡萄糖模拟废水到氟化工有机废水, 其呼吸速率在不同废水水质中的变化相对稳定, 其相对抑制率是最小的.污泥S2和S3的物种丰富度相对较低, 因此, 影响了它们对于水质变化的适应性.
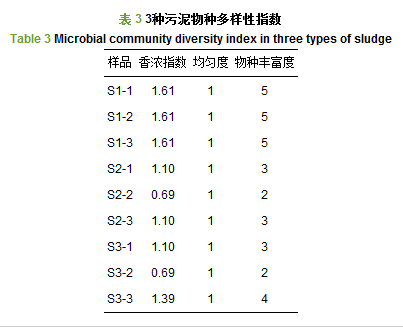
根据文献报道, 表 4列出了活性污泥在处理6类化工废水时, 活性污泥微生物丰富度的变化情况, 丰富度大小依次是采油废水(裘湛等, 2006)>造纸废水(郭建国等, 2014)>苯胺废水(余彬彬等, 2009)>苯酚废水(段佩玲等, 2015)>味精废水(于鲁冀等, 2014)>氟化工废水(本研究).显然, 菌种丰富度最低的是氟化工废水处理工艺中的活性污泥, 进一步反映出氟化工废水较差的可生化性.

3.2.4 不同活性污泥中优势菌种的鉴定
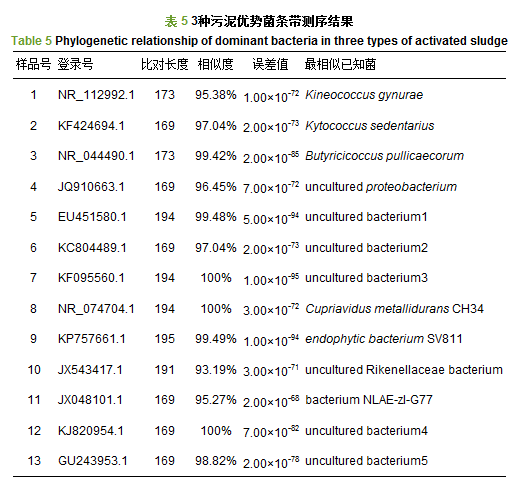
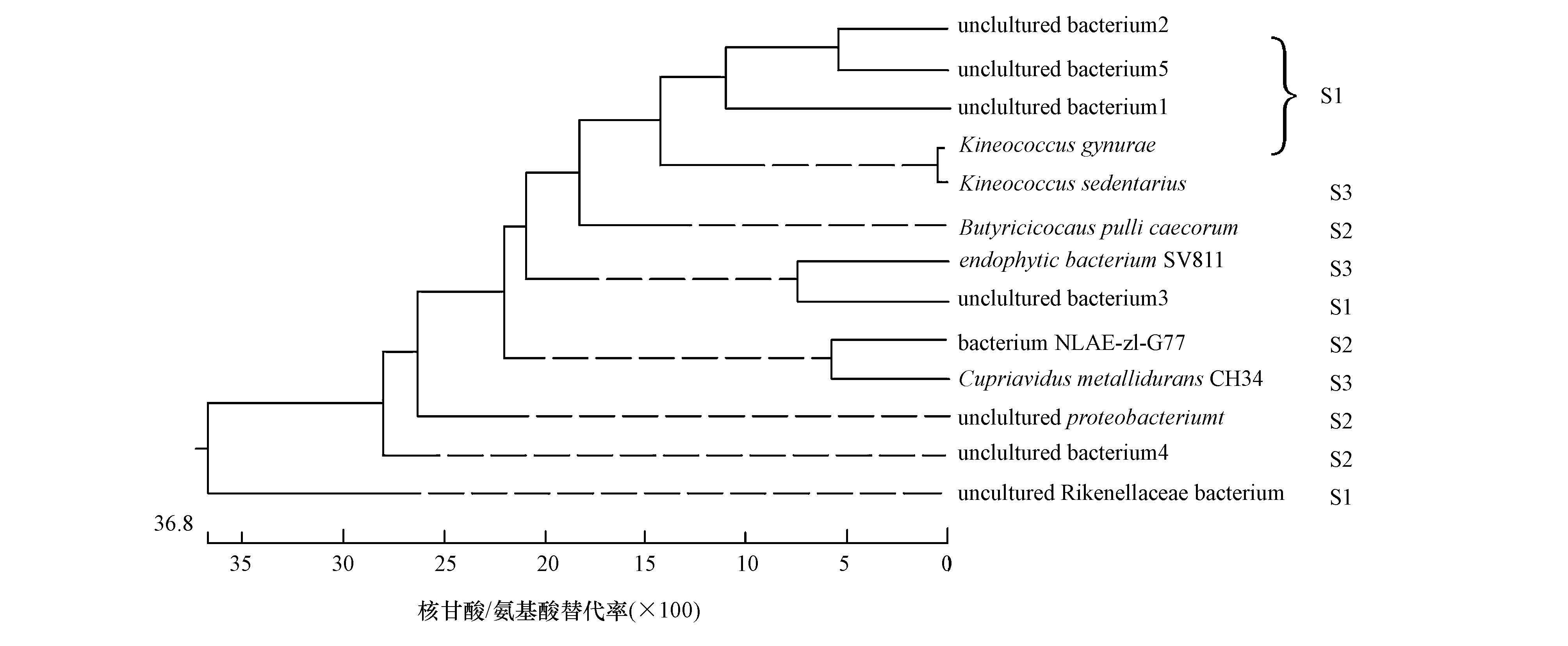
为进一步探明不同污泥样品中细菌微生物群落的多样性和差异性, 对DGGE 图谱中所感兴趣的条带进行切胶回收、重新PCR、克隆转化、筛选等一系列操作后进行测序, 通过NCBI利用Blast进行同源性搜索及相关信息检索, 并与数据库中已有序列进行比对, 得到各条带所代表的细菌类型及其相似程度的结果如表 5所示.同时, 通过Megalign软件作出系统发育树进行分析, 结果如图 4所示.从图 4可以看出, 污泥S1中的菌种与S3中的菌种相距较近, 表明这两种污泥的亲缘性相近, 这与图 3污泥样品聚类分析的结果相一致.
|
|
|
|
|
|
图 4(Fig. 4)
|
|
|
图 4 微生物群落系统进化树(比例尺中数字5表示每100个核甘酸/氨基酸中有5个不同) |
从表 5可知, 3种污泥中的优势菌种不同, 与其相关的菌种功能也存在差异.条带1、5、6、7、13属于污泥S1样品中的菌属, 分别代表了Kineococcus gynurae、uncultured bacterium1、uncultured bacterium2、uncultured bacteriu3、uncultured bacterium5, 其中, Kineococcus gynurae菌种属于球菌属(陆鹏等, 2016), 可在强辐射、高盐、高浓度金属离子及强化学毒性等多种严酷环境中存活.由此可见, Kineococcus gynurae是污泥S1在氟化工废水中尚存在较弱生物呼吸速率的重要优势菌种, 并与其它不可培养的菌种共同作用, 使得S1污泥能够在氟化工有机废水中维持生物活性, 表现出一定抗毒性.条带3、4、11、12属于S2样品中的菌属, 分别代表了Butyricicoccus pullicaecorum、uncultured bacterium4、Butyricicoccus pullicaecorum、bacterium NLAE-zl-G77, 其中, bacterium NLAE-zl-G77对木糖降解具有较好的效果(Makinen et al., 2013) ;Butyricicoccus pullicaecorum属于丁酸弧菌属(Geirnaert et al., 2014), 在低pH值条件下, 能够降解脂肪酸, 生成丁酸盐;在缺氧状态下还原硝酸盐, 具有脱氮功能.因此, 该菌种可能对氟化工废水中的有机物中间产物存在降解作用, 并且对废水中的硝酸盐类起脱氮作用.该菌与其它不可培养菌种共存, 使得污泥S2在氟化工有机废水中能够通过自我调节适应低毒环境.条带2、8、9属于污泥S3样品中的菌种, 分别代表了Kytococcus sedentarius、Cupriavidus metallidurans、endophytic bacterium SV811, 其中, Kytococcus sedentarius属于微球菌(Kampfer et al., 2009), 它能够在低pH环境中降解脂肪酸, 生成肉豆蔻酸、棕榈酸和硬脂酸.Cupriavidus metallidurans CH34是一种重金属耐受性细菌(李莉等, 2012), 能在以苯酚、甲苯酚、苯甲酸、苯胺等芳香族化合物为唯一碳源和能源的培养基中生长;其他学者通过分离纯化, 发现该菌株对有机物吲哚也具有很好的降解作用(Qu et al., 2015);还能在重金属存在下, 高效降解对氯硝基苯(Wu et al., 2011).endophytic bacterium SV811属于内切植菌(Babu et al., 2013) , Babu等(2013) 实验验证了该菌株具有降解吲哚及去除重金属的功能.因此, 这些菌种的存在大大提高了污泥S3在氟化工废水中的生存能力.由于氟化工原始废水的生化性较差, 对功能菌种在该废水中的耐毒性和降解能力研究较少, 因此, 本文中涉及的菌种, 对于其降解氟化工废水的具体效果和机理有待进一步的研究.同时, 这些菌种的发现及它们在氟化工有机废水中表现出的适应性, 能够为后期功能菌种筛选和提高氟化工废水可生化性研究提供重要依据.
3.3 活性污泥降解氟化工有机废水的验证实验
选取3种污泥中对氟化工有机废水具有较高耐毒性的泥种(S2) 进行驯化实验, 污泥驯化采用逐步增加负荷的方法来提高微生物对废水的适应能力.污泥接种后, 以氟化工有机废水为进水水样, 驯化过程以TOC浓度和污泥性状作为调节指标, 视系统对TOC的去除率和污泥驯化情况逐步提高反应器负荷, 以使微生物对有机物具有良好的降解性能.
由图 5可知, 驯化初期, 活性污泥在低浓度废水中适应情况较理想, TOC降解速率比较快, 去除率在80%以上;随着进水TOC浓度的升高, 活性污泥的降解能力下降, 在TOC为250 mg·L-1时, 生物活性降至最低, 通过对进水浓度的调控, 污泥中的功能微生物渐渐适应, 并大量繁殖, 使得活性污泥对废水中的TOC保持较高的降解率, 去除率在70%以上.
图 5(Fig. 5)
|
|
|
图 5 污泥S2为期1个月的驯化情况 |
在污泥驯化初期, 反应器中污泥颜色发黑, 功能微生物处于复苏、适应阶段;第1周的镜检结果表明, 反应器中的微生物体型较小;实验进入第2周, 由于进水的TOC浓度达到了污泥的适应极限, 反应器内出现大量浮泥, 镜检中发现了大量丝状菌, 此时的SVI为178 mL·g-1, 明显高于正常情况下的SVI(120 mL·g-1), 发生污泥膨胀;随着进水TOC浓度的回落, 到了驯化的第3、第4周, 实验发现活性污泥呈絮状结构, 菌胶团数量增多, 颜色由黑色变成黄褐色, 同时发现较多的原生动物及草履虫、轮虫等微型后生动物, 表明此时污泥对该TOC浓度下的废水已基本适应, 驯化得以完成.
从验证实验结果可得, 选取的污泥对氟化工有机废水具有一定耐毒性, 并且在TOC为250 mg·L-1范围内, 经过一定时期的驯化培养, 其降解性能表现较好, 为氟化工废水的后期生化处理提供了理论依据.
4 结论(Conclusions)
1) Strathtox呼吸速率仪测定结果表明, 3种污泥在氟化工原始废水中的呼吸速率受到明显抑制, 氟化工原始废水的可生化性极低;但在氟化工有机废水中, 污泥的呼吸速率显著提升, 大大增加了氟化工有机废水的可生化性.
2) PCR-DGGE结果表明, 采自不同污水处理厂的污泥, 其微生物种类、微生物结构及微生物多样性不尽相同, 进而对氟化工废水的适应能力表现不同;微生物种类越丰富, 结构越复杂, 其对氟化工有机废水的耐毒性就越强.具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3) 通过克隆测序, 从3种污泥的样品中成功鉴定获得Kineococcus gynurae等13种微生物的16S rDNA 序列, 并作为其在各自污泥中的优势微生物, 表明这些优势菌对氟化工废水毒性具有一定的耐受性.
4) 污泥验证实验表明, 氟化工原始废水在经过前期的脱盐、消除重金属的物化处理后, 氟化工废水的可生化性将大大增强.