减少废水中的氮化合物是改善水环境和水质的重要措施之一。与传统硝化/反硝化工艺相比,短程硝化/厌氧氨氧化(partialnitrification/anaerobicammoniaoxidation,PN/A)工艺可以将脱氮需氧量降低50%,有机碳需求量降低100%,污泥产量降低90%。因此,PN/A工艺被认为是最经济、最有前景的脱氮工艺。
反应器内生物质的保留能力对厌氧氨氧化(Anammox)工艺的启动周期有着重要影响。据报道,颗粒和生物膜污泥都具备良好的生物质截留能力 ,但已知这两种污泥形式分别单独运行时都会存在较长的启动时间。生物膜系统形成周期短,但长期运行后载体上太厚的生物膜会导致生物质脱落并被水流冲刷。Anammox颗粒污泥的形成是一个漫长的过程,但可以有效地拦截污泥流失并保持较高的生物量。因此,生物膜和颗粒污泥的组合应用可能最大程度上保留反应器内生物质,从而实现PN/A的快速启动和功能菌的高效富集。然而,将好氧生物膜和厌氧颗粒相结合来启动PN/A工艺目前尚未见报道。
不同于传统的单阶段和两阶段PN/A反应器,在多级PN/A反应器中,交替的缺氧室和好氧室不仅为(anaerobicammoniaoxidizingbacteria(AnAOB)和ammoniaoxidizingbacteria(AOB)这2种功能细菌的同时生长和富集提供了空间条件,而且在缺氧区亚硝酸盐氮(NO2--N)和氨氮(NH4+-N)共存的环境有利于厌氧氨氧化菌的自然富集。此外,实现PN/A工艺的关键不仅需要同时富集AOB和AnAOB,还必须尽可能抑制亚硝酸盐氧化菌(nitriteoxidizingbacteria,NOB)活性。据报道,间歇曝气和pH控制等策略可以有效控制PN/A工艺中不同菌群的活性(富集AnAOB和AOB,抑制NOB)。然而,具有间歇曝气、pH控制、多级反应器和生物膜/颗粒污泥系统等优点的组合PN/A反应器的运行策略仍需要研究。
本研究构建了由3个好氧反应柱和3个厌氧反应柱组成的新型多级好氧生物膜/厌氧颗粒反应器(multistageaerobic-biofilm/anaerobic-granularsludgereacto,MOBAPR),以同时促进AnAOB和AOB的富集。本研究的主要目的为:拟通过MOBAPR实现PN/A工艺的快速启动和高效运行;考察MOBAPR各反应柱的氮转化过程;探索不同MOBAPR柱中功能菌丰度的变化和微生物群落结构的差异;通过优化气液比(gas/liquidratio,G/L),进一步提高PN/A工艺的脱氮效率(nitrogenremovalefficiency,NRE)。
1、材料与方法
1.1 进水水质与接种污泥
接种物取自中国江西省赣州市白塔生活污水处理厂的剩余污泥(普通活性污泥)。在第1天分别向每个反应柱加入100mL接种物,其活性污泥浓度(MLSS)大约为5100mg·L-1。
本研究采用模拟废水(含150mg·L-1 NH4+-N),其改编自前人研究。主要成分包括0.708g·L-1 (NH4)2SO4,1.05g·L-1 NaHCO3,0.02g·L-1 KH2PO4,0.022g·L-1 MgSO4,0.008g·L-1 CaCl2,1.25mg·L-1营养液I(5g·L-1 EDTA、0.00625g·L-1 FeSO4)和营养液II(15g·L-1 EDTA、0.43g·L-1 ZnSO4·7H2O、0.25g·L-1 CuSO4·5H2O、0.19g·L-1 NiCl2·6H2O、0.99g·L-1 MnCl2·4H2O、0.24g·L-1 CoCl2·6H2O、0.22g·L-1 NaMoO4·2H2O、0.014g·L-1 H3BO4)。
1.2 实验装置
MOBAPR的示意图如图1所示。该反应器由6个高30cm、直径4.5cm的有机玻璃柱相互串联构成,总有效容积为2.5L。从进水到出水的6个反应柱(reactioncolumn,Rc)分别标记为Rc1、Rc2、Rc3、Rc4、Rc5和Rc6(隔室数量可根据出水水质增减)。在好氧反应柱(Rc1、Rc3和Rc5)中添加无纺布作为填料,并采用间歇曝气。厌氧隔室(Rc2、Rc4和Rc6)采用低速搅拌装置。当PN工艺成功启动后停止搅拌。曝气量由玻璃转子流量计调节,并采用自动断电定时器电路实现间歇曝气。根据之前的报道 ,由蠕动泵(Langer,BT101L,UK)、pH控制器(WEIPRO,pH-2010B,China)和NaOH溶液组成的pH控制系统将MOBAPR中的pH保持在8.2~8.5。在每次曝气15min后开始检测DO(dissolvedoxygen)质量浓度。
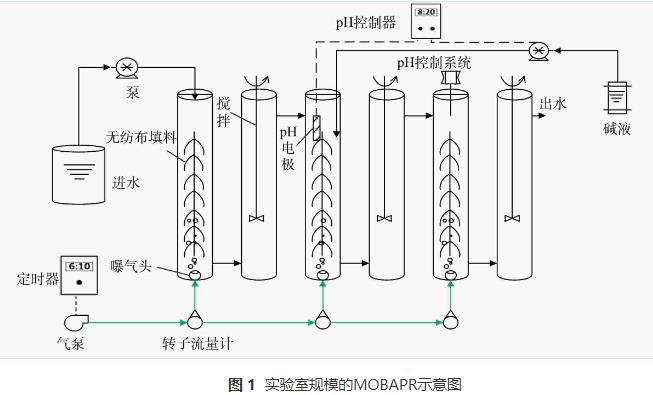
1.3 运行条件
本研究在MOBAPR中依次启动PN和PN/A工艺。第I阶段(1~7d),为快速恢复硝化细菌(AOB和NOB)的活性,在好氧区((Rc1、Rc3和Rc5)中连续曝气,并在厌氧区(Rc2、Rc4和Rc6)连续搅拌。此外,此阶段由于污泥处于悬浮状态,会随着进水流动,因此,启动污泥回流以保证反应器内充足的生物质含量。第II阶段(8~15d)为抑制NOB,在好氧区中使用间歇曝气。第III阶段(16~60d)好氧区微生物已成功挂膜生长,基本没有污泥流失,停止回流。此外,为进一步抑制NOB,第29天水力停留时间(hydraulicresidencetime,HRT)降低至8h(16~28d的HRT为12h)。第IV阶段(61~86d)为避免搅拌影响厌氧区AnAOB富集,厌氧区停止搅拌。第V阶段(87~110d),调整曝气量以保证反应器内充足的NO2--N。各阶段运行参数详见表1。在第VI阶段(111~162d),在进水NH4+-N为150mg·L-1和好氧/厌氧时间为90min/30min条件下,分别调节曝气量和HRT来探讨不同G/L对NRE的影响。
1.4 分析方法
实验中反应器内NH4+-N、NO2--N、NO3--N的检测分析均根据《水和废水检验标准方法》中制定的方案,使用实验室规模的紫外/可见分光光度计(SQ2800,意大利UNICO)进行测定,包括纳氏试剂分光光度法(NH4+-N)(1-萘基)-乙二胺分光光度法(NO2--N)和氨基磺酸紫外分光光度法(NO3--N)。此外,为了更好地揭示MOBAPR中PN/A过程的氮转化机理,每天对各反应柱的氮质量浓度进行检测,并分析其亚硝酸盐积累率(nitriteaccumulationrate,NAR)、氨氮去除率(ammonianitrogenremovalrate,ANR)、氮去除率(NRE)、氮负荷率(nitrogenloadrate,NLR)和氮去除负荷(nitrogenremovalloadrate,NRR)。
1.5 16SrRNA基因测序与微生物菌群分析
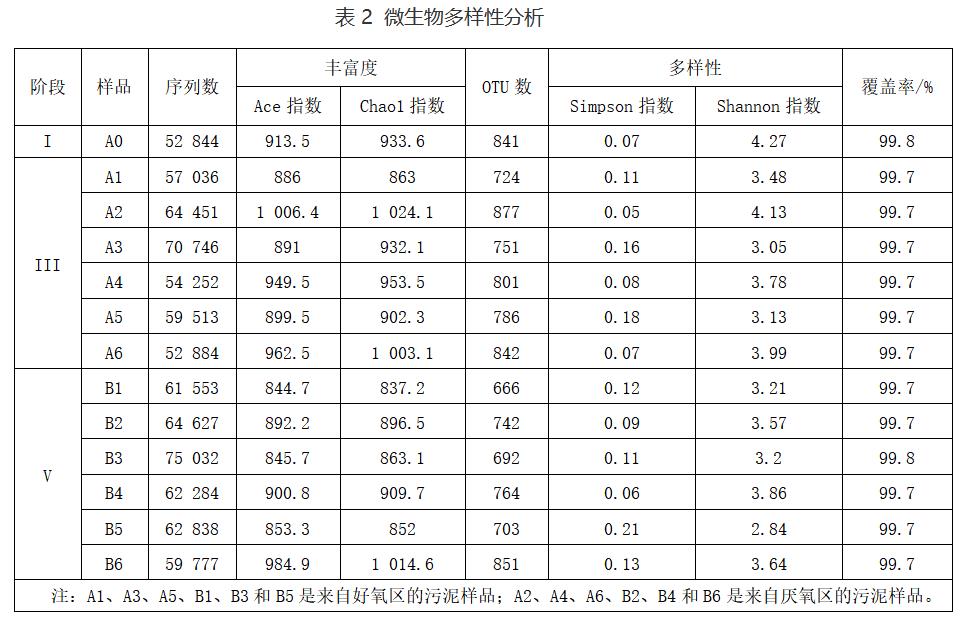
为探索MOBAPR中不同阶段微生物群落的演变,阐明连续多阶段PN/A过程中所涉及的生物学机制,分别对接种物、第56天(阶段III)和第110天(阶段V)的泥样进行微生物功能菌群分析。接种物命名为A0,第III阶段在Rc1~Rc6收集的污泥样品分别命名为A1、A2、A3、A4、A5和A6,第V阶段分别命名为B1、B2、B3、B4、B5和B6。这些样本保存在-20℃,直到提取DNA结束。
在成功提取样本内微生物的DNA后,使用16SrRNA基因的通用扩增引物进行PCR扩增,并且PCR产物使用AxyPrep™DNA凝胶提取试剂盒(AxygenBiosciences,UnionCity,USA)按照制造商的说明进行纯化。然后通过IlluminaMiSeq测序平台(PE300)对样品高通量测序,并得到原始测序序列。为了解样本测序结果中的菌种、菌属、物种功能等信息,将在Miseq测序得到的原始序列数据利用cutadapt(version1.18)和PRINSEQ(version0.20.4)软件进行去除引物接头序列、拼接、识别的处理以得到各样本的有效数据。然后利用Usearch(version11.0.667)按照97%相似性对非重复序列(不含单序列)进行OTU聚类。然后利用RDPclassifier(version2.12)等软件进行OTU物种分类,并根据得到的OTU序列进行微生物菌群分析与功能预测。
1.6 优化MOBAPR操作
由于在第V阶段DO值较低,MOBAPR的性能无法通过DO来进行控制。因此,在第VI(111~162d),阶段,为了代替DO控制(当DO低至无法控制),本研究提出了一种新型控制参数—气液比(式(1))。分别在2、4、6和8h的HRT条件下调控曝气量(0.05、0.1、0.15和0.2L·min-1),从而得到G/L比为2.4、4.8、7.2、9.6、4.4、19.2、21.6、28.8和38.4。并且在每次操作条件调整后,MOBAPR连续运行3~4d。此外,利用高斯模型预测了G/L与NRE之间的相关性(式(1))。

式中:q为G/L值;t为HRT,h;v为曝气速率,L·min-1;V为MOBAPR的总有效容积,L。
2、结果与讨论
2.1 MOBAPR中PN/A工艺的脱氮性能
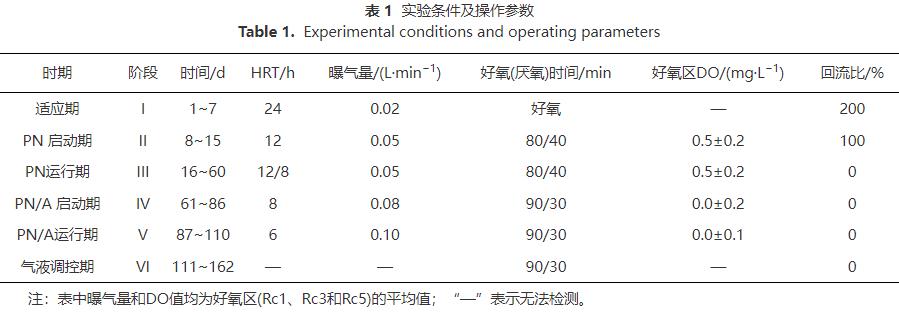
1)接种物驯化。阶段I(1~7d)在进水NH4+-N为150mg·L-1、曝气速率为0.02L·min-1、DO为2~4mg·L-1和HRT24h的条件下运行MOBAPR。如图2所示,出水NO3--N由64.03mg·L-1增加到122.71mg·L-1。这说明在被重新接种后,硝化细菌(AOB和NOB)的活性在高DO水平下得到了快速恢复。此外,在阶段I中NRE大多低于零(图2(c))。这可能是一些细菌(主要是异养菌)不能适应无碳源下的MOBAPR,细菌死亡后细胞溶解释放出额外的氮源到反应器内。
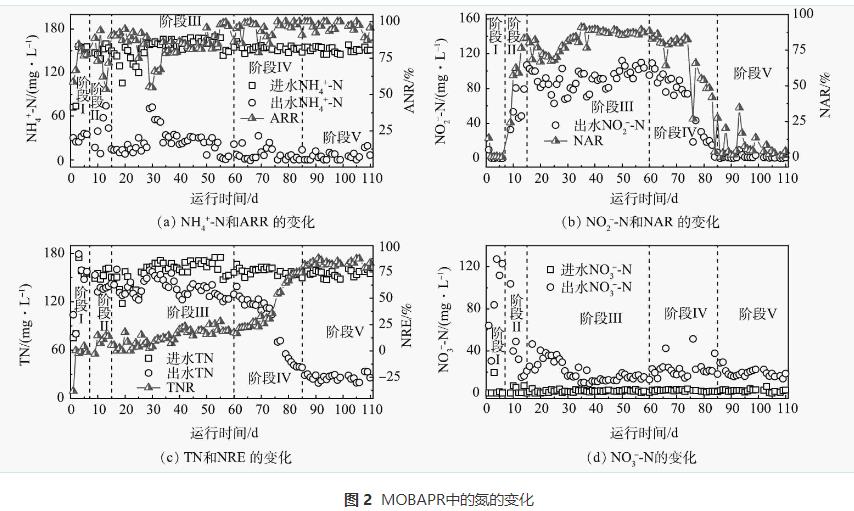
2)PN工艺的启动。在阶段II(8~15d),MOBAPR的pH为8.3,好氧区平均溶解氧为0.5mg·L-1,间歇曝气(好氧/厌氧时间为80min/40min)。结果表明,NO2--N由0mg·L-1增加到106.89mg·L-1(图2(b)),NO3--N由122.71mg·L-1减少到20.92mg·L-1(图2(d)),这表明NOB被有效抑制的同时AOB成功富集。因此,此阶段PN工艺在MOBAPR成功启动。此外,PN工艺中的NO2--N稳定供应是实现Anammox工艺的前提 ,其关键是高效稳定地抑制反应器中的NOB活性。有研究表明,控制pH和间歇曝气是抑制NOB活性的重要手段。因此,将以上2种抑制策略的结合是实现PN过程快速启动的关键。
在阶段III(16~60d),出水NO3--N逐渐增加,第16~28天处于较高水平(30~46mg·L-1)。因此,要实现PN过程的稳定运行,需要对控制条件进行调整。在第17天好氧区在已经形成稳定生物膜结构后,MOBAPR停止回流。结果NAR短暂升至81%,然后逐渐下降(图2(b))。在第20~28天,出水NO3--N相对稳定(30~41mg·L-1),说明综合控制策略仍能有效抑制NOB活性。第29天,HRT由12h缩短到8h,出水NO3--N由29.2mg·L-1逐渐降至16.7mg·L-1,NAR也增加到90%。因此,HRT是影响PN工艺稳定性的重要参数,HRT过长会产生额外的NO3--N。
随着PN过程成功启动和AOB被富集积累 ,反应器中DO被AOB大量消耗,这导致厌氧区室中的DO质量浓度降低至0.2mg·L-1左右,从而为厌氧菌提供了适宜的生长环境。由图2(c)可知,NRE由5.51%逐渐增加到25.52%。这表明AnAOB可能在此阶段自然富集。有研究表明,AOB是从微需氧甚至厌氧的祖先进化而来的,在亚硝酸氧化还原酶(NXR)和其他反射蛋白的形式上与AnAOB高度相似。MIAO等的研究结果同样表明接种硝化污泥可以缩短Anammox的启动时间。因此,基于PN工艺,AnAOB可能更容易富集。此外,高通量测序结果表明阶段III中AnAOB的增加。
3)PN/A工艺的启动与运行。有研究 表明,较大污泥絮凝物中的AnAOB具有更高的活性。厌氧区中污泥絮体的生长可能会受到搅拌的限制,从而抑制AnAOB的活性。因此,在阶段IV(61~86d)停止搅拌以增加AnAOB的活性。并且有研究表明,NO2--N质量浓度越高越有利于Anammox的积累。因此,延长好氧区的相对曝气时间以进一步增加反应器中NO2--N质量浓度。在第IV阶段,厌氧区中停止搅拌,并且好氧区中好氧/厌氧时间从80min/40min变为90min/30min。在第61天后,MOBAPR的TN质量浓度逐渐下降,由126.96mg·L-1(第61天)降低至(32.79±6.21)mg·L-1(77~86d),NRE也从21.5%迅速增加到(78.86±4.6)%(图2(c))。这表明在本研究采用的操作策略下,61d内成功实现PN/A工艺的快速启动。
此外,随着AnAOB成功富集,MOBAPR中脱氮速率增加,导致进水中大部分的NH4+-N在Rc1~Rc4中已经被去除,而Rc5和Rc6中功能微生物缺乏营养物质。因此,有必要适当缩短HRT以保证MOBAPR中功能微生物的进一步富集。在阶段V(87~110d),HRT由8h缩短至6h。此阶段反应稳定后(102~110d),出水NO2--N、NO3--N和NH4+-N质量浓度分别为(0.63±0.50)、(16.72±1.78)和(8.29±6.65)mg·L-1。其中,出水NO3--N质量浓度(NO3--N产生/NH4+-N去除=0.12)与Anammox的NO3--N理论产生值(NO3--N产生/NH4+-N去除=0.11)接近,这表明NOB被稳定抑制。此外,PN/A工艺的NRE、ANR和NRR分别为(83.41±2.45)%、(97±3.61)%和(0.41±0.09)kg·(m3·d)-1(图2)。这表明该操作策略可用于MOBAPR,以实现PN/A过程的长期高效稳定运行。
有趣的是,在第IV和第V阶段(曝气量分别为0.08L·min-1和0.10L·min-1),所测得DO质量浓度接近0。有研究 表明,当AOB的耗氧速率高于曝气效率,反应器曝气后的DO质量浓度仍会保持在较低水平。因此,在MOBAPR中非曝气后,好氧区的曝气会被AOB等好氧细菌及时转化,从而维持反应器内低DO水平。此外,在MOBAPR中,AOB的富集是AnAOB快速启动的关键。AOB不仅可以为AnAOB创造环境,还提供营养物质。然而AOB主要在好氧区活性较高。因此,在整个启动期间,基本不对厌氧区进行直接调控(搅拌停止后)。
2.2 各阶段微生物群落演替分析
为了探索MOBAPR中微生物群落的变化规律,对接种物、第56天(第III阶段末期)和第110天(第V阶段)末期采集的污泥样品进行微生物群落进行分析。其中PA1为接种物A0,PA2为第III阶段各反应柱(A1、A2、A3、A4、A5和A6)内微生物丰度的平均值,PA3为第V阶段(B1、B2、B3、B4、B5和B6)微生物丰度的平均值。高通量测序得到的优质细菌序列被划分为不同的分类类别(门和属),结果如图3(a)和图3(b)所示。Proteobacteria包括具有硝化反硝化功能的细菌 ,是门水平上的主要细菌(图3(a))。Proteobacteria在接种物中的丰度为68.15%,而在阶段III和阶段V后分别下降到44.68%和40.39%(图3(a))。这表明在变形菌门中许多异养硝化或反硝化细菌由于有机物的缺乏而被淘汰。有研究表明,Planctomycete门中不仅拥有一些专性好氧菌,还包含了所有已知的AnAOB。接种物(PA1)中的Planctomycete相对丰度接近第III阶段(PA2),分别为4.07%和3.71%。而到了第V阶段(PA3),Planctomycete丰度达到10.85%,这表明Planctomycete主要在第III阶段后被富集。此外,在属水平上PA1的CandidatusKuenenia的相对丰度极低,约0.05%(图3(b))。这表明在接种物中几乎不含AnAOB。与接种物(PA1)相比,PA2和PA3中Armmonadetes和Chloroflexi的丰度显著增加(图3(a))。有研究表明,在Armarmadetes和Chloroflexi中的许多细菌含有与氮代谢相关的功能基因(Nar、NirK或Nos)。因此,Armatimonadetes和Chloroflexi可能含有多种AOB和AnAOB协同细菌,为PN/A工艺的启动和运行做出了贡献。
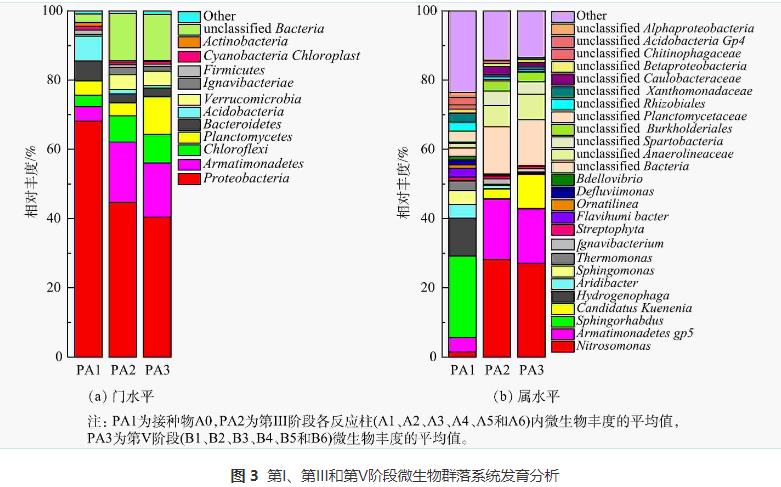
图3(b)反映了PN/A工艺中所有样品在属水平上的微生物群落。在第III阶段Nitrosomonas的丰度由1.49%增加到28.20%(图3(b)),证实了该操作策略可以成功富集AOB。并且,16s结果表明CandidatusKuenenia是MOBAPR中主要的AnAOB,其由接种物PA1(0.05%)增长到2.97%。这表明随着PN工艺的长期运行,此阶段(第56天)AnAOB开始富集。在第V阶段,PN/A工艺启动成功并长期运行后,Nitrosomonas (27.09%)和CandidatusKuenenia(9.99%)的丰度得到了较高程度富集,这表明AOB和AnAOB在MOBAPR中可以同时富集。因此,通过第IV和第V阶段的综合运行策略,AOB和AnAOB作为优势菌被富集,并形成细菌协同关系完成脱氮。此外,NOB的主要菌属Nitrobacter、Nitrospira和Nitrospina等可能由于含量太低(<0.1),均未被检测到。
2.3 不同阶段各反应柱内的氮转化途径
1)氮转化途径分析。为了更深入地了解MOBAPR各反应柱内PN/A工艺的氮转化过程,对PN(阶段III)和PN/A工艺(阶段V)长期运行阶段分别进行测试分析,结果如图4所示。在第III阶段,出水NO2--N质量浓度从Rc1到Rc6逐渐增加,NH4+-N相应降低(图4(a))。这表明各反应柱内均参与到氨氧化过程中。每个反应柱内都含有NH4+-N和NO2--N(图4(a)),这为AnAOB的富集提供了必要条件。并且由于氨氧化过程需要氧气参与,好氧区(Rc1、Rc3和Rc5)内的ANR显著高于厌氧区(Rc2、Rc4和Rc6)(图4(c))。此外,NO3--N浓度一直处于较低水平(<10mg·L-1)(图4(a)),这表明通过本研究采用的操作策略,NOB活性长期受到有效抑制。在这一阶段,MOBAPR的平均氮损失约为30mg·L-1(图4(a)),证实了反硝化细菌或AnAOB的增加。特别是Rc1、Rc3和Rc5中NRE的增加也显著高于Rc2、Rc4和Rc6(图4(e)),说明好氧区内氮损失主要是反硝化细菌或AnAOB造成的。
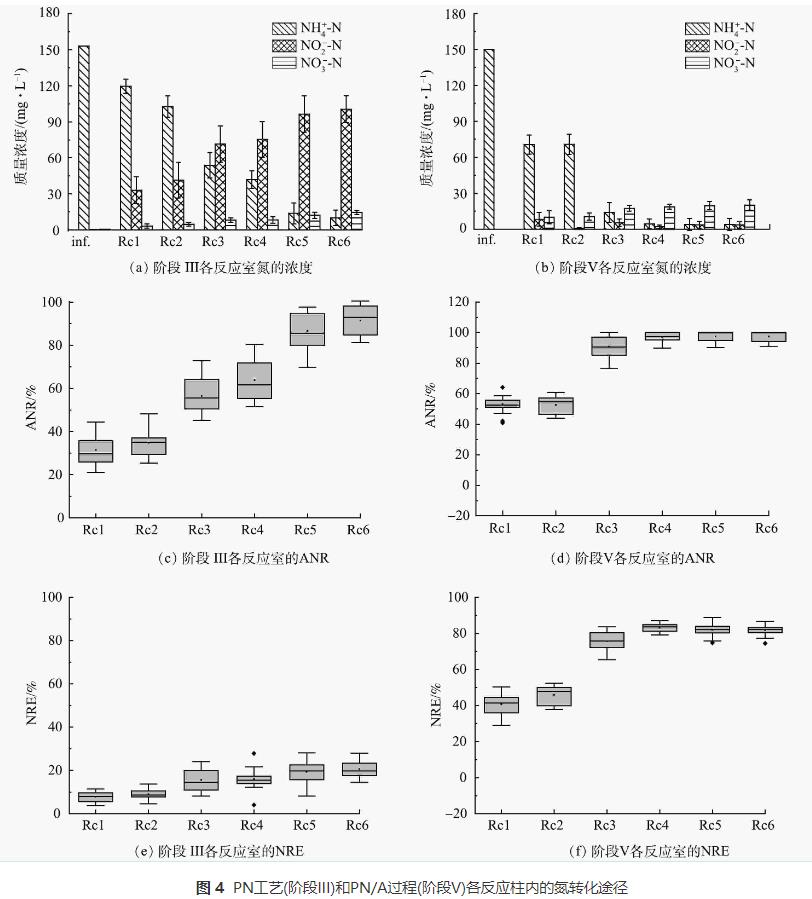
在第V阶段,由于进水中的氨(150mg·L-1)通过前4个反应柱被PN/A完全转化,最后2个反应柱(Rc5和Rc6)在此阶段被废弃。模拟废水在流经Rc4后被排出。如图4(b)所示,在此阶段出水NH4+-N降至较低水平。这表明经过长期运行,PN/A工艺的NRE有所提高。此外,由图4(d)可以看出,大部分氨氧化过程基本在Rc1完成,而在Rc4之后脱氮量达到最高(图4(f))。此外,在第V阶段各反应柱内NO2--N含量低于阶段III(图4(a)),这表明由AOB产生的NO2--N被AnAOB快速利用,即AnAOB与AOB之间形成了良好的协同脱氮效果。Rc1和Rc3中NRE和ANR均显著增加(图4(f)),因此,PN和Anammox过程主要在好氧室中进行。这是由于在好氧区内形成了内层为AnAOB和外层AOB的微生物生物膜协同脱氮系统。依赖于外部的AOB提供的NO2--N,内部的厌氧微生物将剩余的氨转化为氮。其中,由图4(f)可知,厌氧区(Rc2和Rc4)中NRE的增加远低于好氧区(Rc1和Rc3),并且厌氧区的出水NO2--N几乎为0(图4(b))。因此,NO2--N的缺乏可能限制了厌氧区的NRE。此外,在MOBAPR的好氧室中添加填料形成生物膜系统,不仅有效避免了DO对AnAOB的抑制,而且还有利于AnAOB的富集。在此阶段稳定的生物膜和颗粒污泥系统分别在好氧区和厌氧区形成。一方面,在好氧区的生物膜系统中形成了分层分布的好氧外层和厌氧内层。AnAOB在厌氧环境的生物膜内层得到富集,并与外层AOB协同脱氮。另一方面,AOB产生的大部分NO2--N被生物膜内层的AnAOB利用,剩余少量NO2--N流出并被位于厌氧区的AnAOB颗粒污泥消耗。此阶段在好氧区的脱氮方式与单阶段PN/A工艺相似,而厌氧区脱氮方式与两阶段PN/A工艺相似。因此,生物膜和颗粒污泥结构成功将单阶段与两阶段PN/A工艺的优势结合在一起,不仅具备两阶段PN/A更快的启动速度,还具备单阶段PN/A的更高效的反应速率。
2)各反应柱中AOB和AnAOB的动态分析。为了探究在PN工艺和PN/A工艺长期运行过程中,MOBAPR中不同反应柱内微生物群落的差异,对接种污泥、阶段III和阶段V获得的污泥样品进行高通量测序。其中,接种污泥样品命名为A0,在第56天(阶段III)Rc1、Rc2、Rc3、Rc4、Rc5和Rc6采集的样品分别命名为A1、A2、A3、A4、A5和A6,在第110天(阶段V)采集的样品命名为B1、B2、B3、B4、B5和B6。高通量测序得到的相关参数如表2所示。厌氧区中的Simpson指数明显低于好氧区(表2),这说明好氧区的物种富集程度是高于厌氧区的,Shannon指数也得到了类似的结论。每个污泥样品的覆盖率超过99.70%(表2),说明高通量测序基本代表了污泥样品的实际微生物群落结构。
为深入了解好氧生物膜/厌氧颗粒污泥的微生物分布情况,在阶段III和阶段V,从MOBAPR中的6个反应柱中获得的污泥样品进行了微生物群落分析。PN工艺启动并长期运行后,A1、A3和A5中亚硝基单胞菌(Nitrosomonas)的相对丰度分别从1.49%提高到30.99%、39.77%和40.74%,A2、A4和A6中亚硝基单胞菌的相对丰度分别从1.49%提高到11.42%、22.25%和22.15%(图5(c)),这证实了AOB在每个隔间中都被富集。厌氧区中AOB的富集与好氧区出水的DO有关。因此,厌氧区的AOB丰度明显低于好氧区(图5(c))。此外,在A1、A2、A3、A4、A5和A6中,AnAOB(CandidatusKuenenia)的丰度分别由0.05%提高到0.16%、5.25%、0.56%、5.87%、0.39%和5.06%(图5(c)),这表明AnAOB已经开始富集。AOB不仅通过消耗溶解氧为AnAOB创造厌氧环境还为AnAOB提供必需的基质(NO2--N)。因此,此阶段Nitrosomonas富集可能为Anammox的启动奠定了基础。
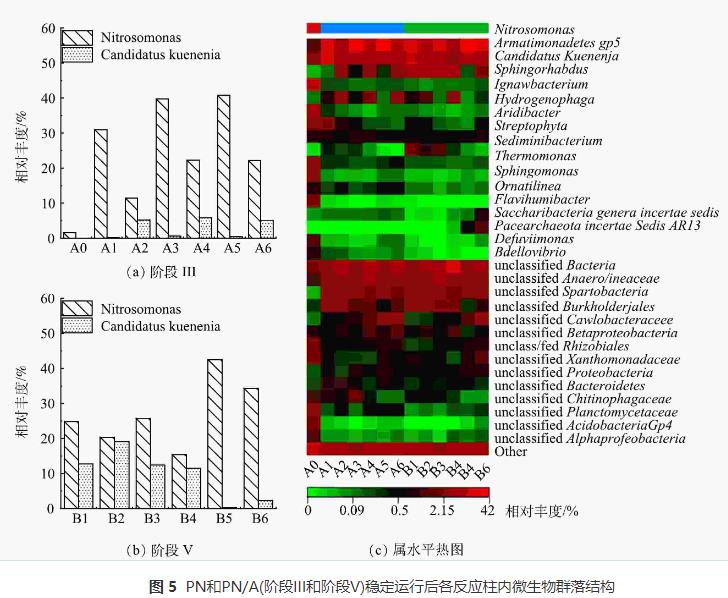
在PN/A工艺成功启动和运行后(第V阶段),B1、B2、B3和B4中CandidatusKuenenia的丰度分别增加到12.67%、19.07%、12.41%和11.43%(图5(a))。由于Rc5和Rc6中NO2--N的缺乏,B5和B6中CandidatusKuenenia的丰度较低(分别为0.24%和2.29%)。在各反应柱中,Nitrosomonas和CandidatusKuenenia都得到了较高水平的积累(图5(b))。这证实了微生物之间协同脱氮系统的存在。有趣的是,CandidatusKuenenia不仅被富集在厌氧区,而且在好氧区中也有较高的丰度,这表明好氧区已形成分层分布的生物膜系统。此外,在PN/A工艺的长期运行阶段,未分类菌数量较多(图5(c))。有研究表明,PN/A工艺微生物群落由各种功能菌和协作菌共同组成的。因此,在演替过程中会出现一些未分类协作菌以促进功能菌更好的富集。
2.4 G/L对NRE的影响
在第V阶段,MOBAPR中的DO值接近于零。一方面,不能通过控制DO值来进一步优化反应器性能;另一方面,不能人为直接调控DO值,即只能通过曝气量或流量等来间接调控DO值。因此,在PN/A工艺在运行过程中,DO控制会存在一定的滞后性。此外,在此阶段发现曝气速率越高,厌氧菌活性会降低;而曝气速率越低,厌氧菌的氮转化性能同样会将低。因此,在MOBAPR中提供合适的曝气量非常重要。
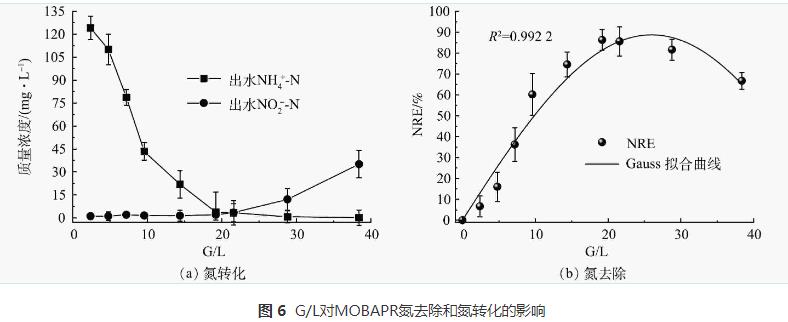
第2.1节和2.2节中的结果表明可通过缩短HRT将MOBAPR的NRE进一步提高,但好氧区中AOB的需氧量随着进水氨氮浓度的增加而增加。因此,本研究通过控制G/L,一方面可以为MOBAPR中的功能微生物提供稳定适宜的NO2--N/NH4+-N,从而促进MOBAPR的总氮去除率;另一方面,直接调控反应器参数(代替DO控制),从而简化操作。为探讨G/L对总氮去除率的影响,通过调节曝气量和HRT,在进水NH4+-N为150mg·L-1,好氧/厌氧时间为90min/30min条件下,G/L参数分别设置为2.4、4.8、7.2、9.6、14.4、19.2、21.6、28.8和38.4。用高斯模型对得到的NRE和相应的G/L进行拟合(极点拟合)以得出最适G/L,拟合结果如图6所示。可以看出,PN/A工艺的NRE在G/L为0~19.2时增大,而在G/L为21.6~38.4时减小。高斯模型的相关系数(R2)为0.9922(图6(b)),说明该模型较好地描述了NRE与G/L之间的关系。模型拟合结果表明,当G/L比值参数为20~30时,NRE可达到较高水平。
3、结论
1)本研究构建了厌氧和好氧区共存、悬浮污泥系统与生物膜系统相结合的MOBAPR。
2)在MOBAPR中15天内成功启动PN工艺,PN/A工艺在61天内成功启动。在运行阶段,PN工艺的NAR为(87.35±2.7)%,PN/A工艺的NRE为(83.41±2.45)%。
3)高通量测序结果表明,Nitrosomonas(27.09%)和CandidatusKuenenia(9.99%)在厌氧区和好氧区被同时富集。在长期运行阶段,PN工艺的NAR为(87.35±2.7)%,PN/A工艺的NRE为(83.41±2.45)%。
4)在DO低至无法控制时,G/L可能是一种可以代替DO控制的重要策略,并且高斯模型拟合结果表明,当G/L比值参数为20~30时,NRE可达到较高水平。(来源:中交(天津)生态环保设计研究院有限公司)



