随着我国经济的发展和人口的增长,餐厨垃圾(FW)和污水处理厂剩余污泥(WAS)的产量增长迅速。厌氧发酵是实现剩余污泥和餐厨垃圾稳定化、减量化和资源化的主流技术之一,且其可产生高附加值的挥发性脂肪酸(VFAs)等产物。我国剩余污泥的碳氮比(C/N)为4.6~5.0,餐厨垃圾的C/N为10~30,而厌氧发酵技术适宜的C/N为10~20,选择适当配比的剩余污泥和餐厨垃圾厌氧共发酵可提高有机质转化效能。
水解阶段是厌氧发酵的主要限速步骤。电化学预处理技术(EPT)被认为是强化厌氧发酵水解产酸的有效手段之一,EPT通过电化学过程产生强氧化性物质,可破坏污泥细胞稳态结构,有利于胞内有机质溶出,进而提高厌氧发酵的VFAs产量。由于餐厨垃圾中含盐量(主要为NaCl)较高(约为0.34%~6.4%),这些盐分经过电化学预处理后可生成活性氯化物(RCS),一方面RCS具有强氧化性,可促进胞内有机质溶出,富集筛选发酵功能菌;另一方面其浓度过高会抑制厌氧发酵菌的活性,降低产酸效能。因此,探究盐度对电化学预处理后厌氧发酵产酸的影响,可确定剩余污泥-餐厨垃圾厌氧共发酵的最佳盐度和适宜RCS浓度范围,进而提高发酵功能菌占比和VFAs产量,但截至目前尚未见相关方面的研究报道。鉴于此,笔者研究了不同盐度(3、6和10g/L,以NaCl计,下同)对电化学预处理后剩余污泥-餐厨垃圾厌氧共发酵产酸的影响,测定预处理前后有机质溶出情况和RCS浓度,考察厌氧发酵过程中VFAs产量及组成、微生物群落结构及数量的变化,探究最佳盐度。
1、材料与方法
1.1 实验材料
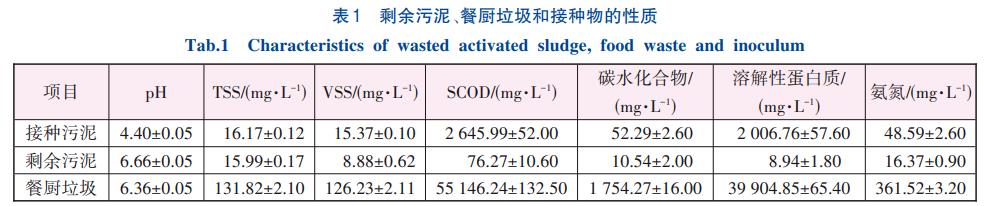
实验用剩余污泥取自武汉市汤逊湖污水处理厂二沉池,经5mm筛网过滤后,用去离子水清洗3次以去除杂质和盐分。餐厨垃圾取自华中科技大学东园学生食堂,主要成分为肉、蔬菜和米饭,除去悬浮油脂和盐分后用搅拌器研磨成浆液状态。剩余污泥和餐厨垃圾均于4℃冰箱中保存。厌氧共发酵所用接种物取自实验室规模的中温半连续餐厨垃圾厌氧发酵罐。分别检测接种污泥、剩余污泥和餐厨垃圾的pH、总悬浮固体(TSS)、挥发性悬浮固体(VSS)、溶解性化学需氧量(SCOD)、碳水化合物、溶解性蛋白质和氨氮等常规指标,具体见表1。
1.2 电化学预处理实验
1.2.1 电化学预处理装置
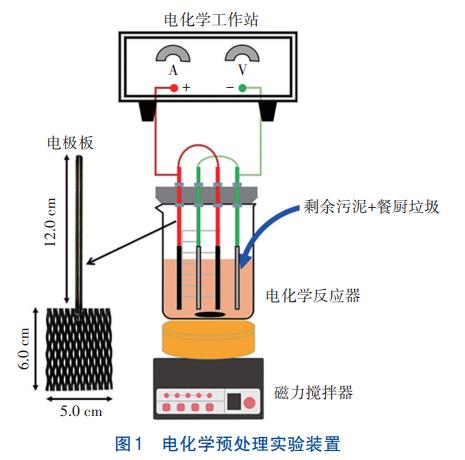
电化学预处理实验装置由电化学工作站、电极、2000mL烧杯和磁力搅拌器组成,如图1所示。电化学工作站可提供稳定电压,电极采用4片网状电极交替组成,根据前期研究结果,两片为表面涂覆钌铱金属氧化物涂层(Ti/IrO2-RuO2)的钛基阳极板,两片为纯钛基的阴极板,连接杆长12.0cm,电极网长6.0cm、宽5.0cm,极板间距为1.0cm。本实验使用5V恒定电压,采用磁力搅拌器对剩余污泥-餐厨垃圾进行搅拌混匀,避免电化学预处理过程中基质沉降,转速为180r/min。
1.2.2 电化学预处理实验设计
根据前期研究结果,按照剩余污泥和餐厨垃圾比例为1∶1(以VSS计)配制3组混合基质。烧杯有效容积为1000.0mL,分别投加419.7mL剩余污泥、29.5mL餐厨垃圾和550.8mL去离子水。配制后混合基质的TSS为8.6g/L,VSS为6.0g/L。根据前期实验结果和相关文献,向每组混合基质中加入不同剂量的NaCl,控制盐度分别为3、6和10g/L。将配制好的3组混合基质在5V恒定电压下处理60min,并在室温下避光放置0.5d作为实验组,分别命名为S3-EPT、S6-EPT和S10-EPT,以相同盐度梯度但不进行电化学预处理的混合基质作为对照组,分别命名为S3-Blank、S6-Blank和S10-Blank。分别在电化学预处理开始前和结束后取3~5mL混合基质样品,采用0.45µm过滤器过滤,分析SCOD、碳水化合物、溶解性蛋白质、VFAs、RCS等指标。
1.3 混合基质厌氧共发酵实验
预发酵实验中S10-Blank和S10-EPT组的VFAs累积产量显著低于其他四组,故混合基质厌氧共发酵实验仅从4个预处理烧杯(S3-Blank、S6-Blank、S3-EPT和S6-EPT)中分别取161.0mL转移到250.0mL厌氧发酵瓶中,再加入39.0mL接种物,此时厌氧共发酵固液混合物总体积为200.0mL,TSS为11.4g/L,VSS为8.7g/L。随后将厌氧发酵瓶密封并放入恒温箱摇床中,温度为(38±0.2)℃,转速为150r/min,进行20d的厌氧共发酵实验。每两天从发酵瓶中取3~5mL混合样品,过滤后分析发酵液的VFAs等理化指标。在第2和14天分别采集1mL样品进行功能微生物测序以分析微生物群落结构,同时对第14天采集的样品采用相关试剂盒检测关键酶活性。实验均设置平行组,并计算平均值和标准偏差。
1.4 分析项目与方法
TSS和VSS采用重量法测定,SCOD采用重铬酸钾法测定,溶解性蛋白质采用福林酚法测定,碳水化合物采用硫酸-蒽酮法测定,氨氮采用纳氏试剂比色法测定。上清液中的RCS含量采用N,N-二乙基对苯二胺(DPD)分光光度法测定,以Cl2计。甲烷含量采用气相色谱仪(GCTrace1300,赛默飞)测定,VFAs含量及组分采用气相色谱仪(GC-2014,岛津)测定。按照试剂盒法(硅基质吸附柱)从混合基质样品中提取细菌和古菌总DNA,扩增DNA序列,按照标准规程在IlluminaMiSeq平台上进行高通量测序。采用相关试剂盒对α-葡萄糖苷酶、蛋白酶、乙酸激酶(AK)、磷酸转乙酰酶(PTA)、草酰乙酸转羧化酶(OAATC)、琥珀酰辅酶A转移酶(CoAT)、辅酶F420(F420)和乳酸脱氢酶(LDH)等关键酶的活性进行检测。
2、结果与讨论
2.1 盐度对混合基质中有机质溶出的影响
经过电化学预处理后,不同盐度(3、6和10g/L)的混合基质上清液中SCOD、碳水化合物和溶解性蛋白质含量均上升,其中,SCOD分别从1788.29、2175.11、2256.14mg/L升到2445.23、2532.82、4406.13mg/L,当盐度为10g/L时SCOD上升最明显;碳水化合物分别从876.11、849.89、863.33mg/L上升到988.71、1067.38、1009.08mg/L;溶解性蛋白质分别从59.18、72.07、64.07mg/L上升到162.86、167.34、95.45mg/L,当盐度为3和6g/L时溶解性蛋白质上升更明显。以上表明,电化学预处理有助于混合基质中有机质的溶出,盐度较低(3和6g/L)的混合基质经电化学预处理后更有利于溶解性蛋白质的溶出,而盐度较高(10g/L)的混合基质经电化学预处理后SCOD溶出量更高,但溶解性蛋白质溶出量较少,混合基质的可生化性较低。因此,较低的盐度更有利于提高电化学预处理后混合基质中有机质的溶出效能,并提高混合基质的可生化性。由于盐度为10g/L的混合基质经电化学预处理后可生化性较差,几乎不产生VFAs,故后期仅探究3和6g/L这两种较低盐度对混合基质厌氧共发酵的影响。
2.2 盐度对氧化性物质产生的影响
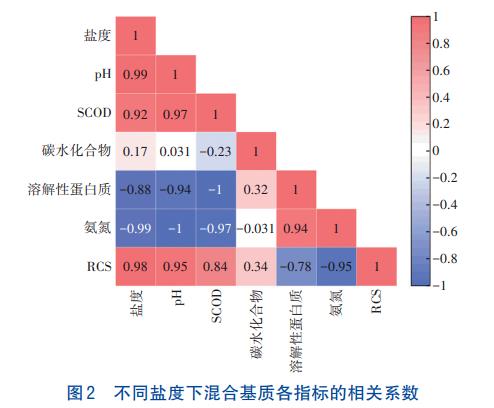
经过电化学预处理后,不同盐度(3、6、10g/L)混合基质的RCS含量分别为11.60、207.71、346.17mg/L,RCS含量随盐度的升高而升高,且在盐度为3~6g/L区间内增加迅速。图2为不同盐度(3、6、10g/L)的混合基质在电化学预处理后各指标之间的相关系数。可知,盐度与RCS、pH、SCOD呈正相关,与氨氮、溶解性蛋白质呈负相关,相关系数均高于0.85,其中,盐度和RCS含量存在良好的正相关性,R2为0.98。RCS可直接攻击污泥内部细胞结构,导致污泥细胞裂解,从而促进混合基质中SCOD、碳水化合物和溶解性蛋白质的溶出并调节pH。
2.3 盐度对厌氧共发酵产物的影响
不同盐度混合基质厌氧共发酵产VFAs的情况如图3(a)所示。可以看出,VFAs累积产量整体呈先上升后缓慢下降的趋势。不同盐度混合基质厌氧共发酵的VFAs产量有所差异,其中,S3-EPT组的VFAs产量远高于对照组,在第14天达到最高值即2259.33mg/L(以COD计,下同),相比对照组提升了33.27%,而S6-EPT组的VFAs产量低于对照组。盐度与RCS含量呈强正相关,RCS能够破坏胞外聚合物、细胞膜和细胞壁,有利于厌氧发酵产酸;但RCS含量过高时会杀灭部分微生物,不利于混合基质厌氧共发酵产VFAs。实验组的VFAs累积产量峰值均滞后对照组2~3d,说明电化学预处理后产酸时间出现迟滞。低含量的RCS有利于改善混合基质水解和酸化过程,从而提高产酸量。因此,盐度为3g/L的混合基质经电化学预处理后产酸效果最好,但仍需要一段时间消耗RCS,恢复微生物活性,从而导致最高产酸时间滞后。
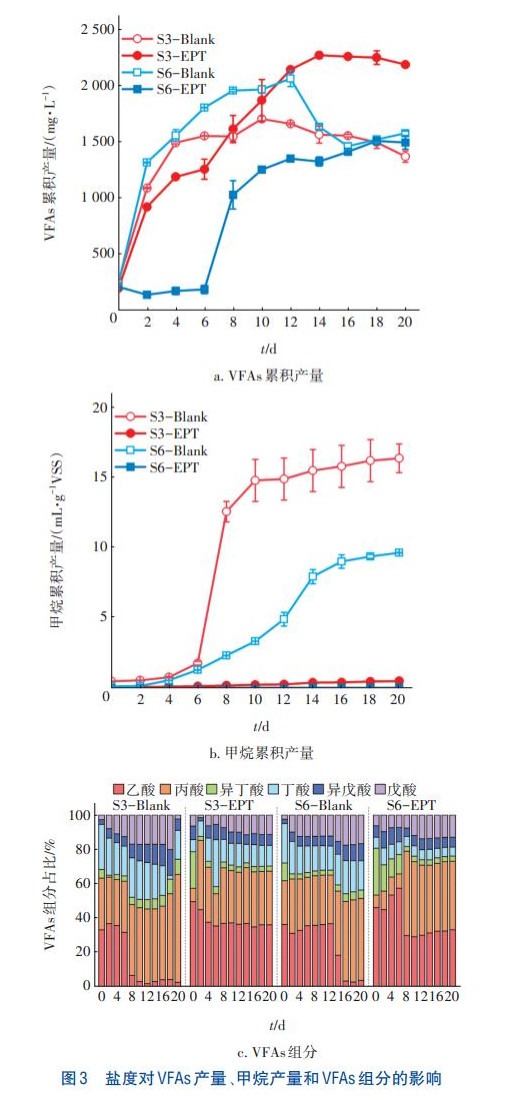
图3(b)反映了盐度对剩余污泥-餐厨垃圾厌氧共发酵产甲烷的影响。实验组的甲烷累积产量缓慢增加,但均低于1mL/gVSS,几乎没有甲烷产生,而对照组S3-Blank和S6-Blank的甲烷累积产量从第4天开始上升,在发酵期末分别达到16.28、9.59mL/gVSS。以上结果表明,电化学预处理会显著抑制产甲烷,这是由于产甲烷菌较为敏感,电化学预处理后残留的RCS抑制了产甲烷菌活性。
如图3(c)所示,在混合基质厌氧共发酵过程中,实验组产酸的主要组分为乙酸和丙酸,二者之和可占到60%以上,发酵类型为丙酸型发酵,与已有的研究结果基本一致,其他组分主要包括丁酸和戊酸等短链脂肪酸。对照组S3-Blank的乙酸占比在第8天迅速下降至7%,而S6-Blank组在第14天下降至18%,随后均处于2%~4%之间;对照组S3-Blank和S6-Blank的丙酸占比分别由前期的30%、26%缓慢升至第20天的63%、48%。乙酸的急剧下降可能是因为乙酸被产甲烷菌利用合成甲烷等,而由于丙酸转化为乙酸的途径受阻以及丁酸等分解为丙酸,导致丙酸占比持续上升。
在20d的厌氧共发酵过程中,实验组S3-EPT的乙酸占比由初始的50%逐渐下降并最终稳定在35%左右;丙酸占比在第2天迅速上升,随后逐渐稳定在30%左右。实验组S6-EPT的乙酸占比先增加(第6天增至最高即57%)后下降并最终稳定在32%左右;丙酸占比在第8天迅速上升,随后逐渐稳定在40%左右。实验组最终的丙酸占比均低于对照组。结合VFAs产量和甲烷产量来看,实验组S3-EPT在发酵14d后乙酸和丙酸累积产量最高,分别为832.51和735.60mg/L,但两个实验组均几乎没有甲烷产生。可见,电化学预处理有效抑制了产甲烷过程,阻止了VFAs中乙酸被消耗利用的途径,有利于乙酸的积累,提高乙酸在VFAs中的占比。而随着盐度的提升,电化学预处理可提高丙酸占比,但考虑到S6-EPT组的VFAs总量低于S3-EPT组,电化学预处理仍不适合盐度较高的混合基质。
以上研究结果说明,电化学预处理可有效抑制剩余污泥-餐厨垃圾混合基质厌氧共发酵产甲烷,有利于提高厌氧发酵液中的乙酸含量,提升发酵液作为碳源被利用的潜力。
2.4 盐度对关键酶活性的影响
在厌氧共发酵中微生物通过分泌关键酶来催化物质的代谢与合成。分别以对照组为基准(相对酶活性为100%),计算不同盐度实验组的相对酶活性,结果见图4。α-葡萄糖苷酶和蛋白酶为水解酶,前者可分解糖类,后者参与蛋白质的分解;乙酸和丙酸是混合基质厌氧共发酵过程中产生的主要VFAs,乙酸激酶(AK)和磷酸转乙酰酶(PTA)主要参与乙酸的生成,草酰乙酸转羧化酶(OAATC)和琥珀酰辅酶A转移酶(CoAT)主要参与丙酸的合成;辅酶F420(F420)主要负责甲烷的合成;乳酸脱氢酶(LDH)主要参与乳酸的合成,可作为评价微生物细胞膜完整性的指标。
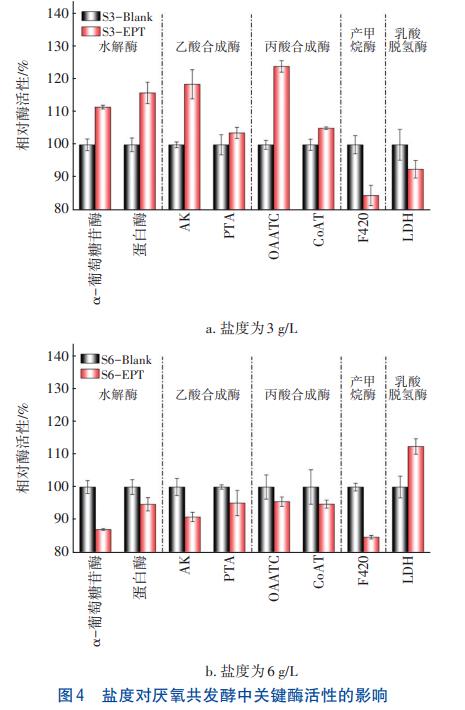
由图4可知,实验组S3-EPT的α-葡萄糖苷酶和蛋白酶相比对照组分别增加了11.48%和15.80%,实验组S6-EPT的α-葡萄糖苷酶和蛋白酶相比对照组分别下降了12.97%和5.27%。这说明水解酶的活性可能与接种时RCS含量有关,RCS含量较高时会抑制水解酶的分泌;RCS含量较低时,虽然对微生物的影响较小,但由于发酵过程中微生物间的竞争激烈,水解菌活性也会受到一定抑制;合适的RCS含量有利于水解菌成为优势菌种,促进其分泌α-葡萄糖苷酶和蛋白酶来降解糖类和蛋白质。在乙酸和丙酸合成方面,S3-EPT组AK、PTA、OAATC和CoAT的相对活性得到增强,相比对照组分别提升了18.45%、3.62%、23.88%和5.05%,乙酸和丙酸合成酶的活性增强,可促进VFAs的生成,与VFAs产量变化情况能较好地吻合。辅酶F420在电化学预处理后被有效抑制,S3-EPT组和S6-EPT组辅酶F420的相对活性较低,相比对照组分别下降了15.44%和15.29%,与实验组甲烷产量处于较低水平的情况吻合。LDH酶的活性在S3-EPT组中相对较低(92.56%),在S6-EPT组中相对较高(112.34%),说明较高含量的RCS会破坏微生物细胞结构,导致LDH酶释放。
整体来看,实验组S3-EPT中与水解、乙酸合成、丙酸合成相关的酶活性增强,而产甲烷酶和乳酸脱氢酶的活性被抑制,关键酶活性的协同变化有效强化了混合基质水解和VFAs合成。实验组S6-EPT中与水解、产酸和产甲烷相关的酶活性均降低,而LDH酶活性则提升了12.34%,说明对于较高盐度的混合基质,电化学预处理会抑制酶活性,破坏微生物细胞结构,不利于厌氧共发酵,这也与盐度为6g/L的实验组产酸表现不佳的情况一致。
2.5 盐度对微生物群落结构的影响
盐度对厌氧共发酵中微生物群落结构的影响如图5所示。由图5(a)可知,发酵前对照组和实验组在门水平上的微生物组成大致相似,占主要优势的菌门为Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)和Actinobacteria(放线菌门)等水解酸化菌,对照组S3-Blank和S6-Blank中上述4种优势菌门的相对丰度之和分别为89.79%和92.01%,经过电化学预处理后,优势菌门的丰度变化较为明显,实验组S3-EPT和S6-EPT中上述4种优势菌门的相对丰度之和分别为94.40%和74.73%,S3-EPT中4种优势菌门的相对丰度之和最高,其中Firmicutes占据主导地位(64.90%),Firmicutes是一类常见的酸化细菌,主要参与蛋白质和糖类等有机物的降解,并将其转化为VFAs,特别是乙酸。这与S3-EPT中VFAs产量最高和乙酸比例较高的情况相吻合。经过14d厌氧共发酵,实验组S3-EPT和S6-EPT中以上4种优势菌门的相对丰度之和相比对照组分别升高了24.28%和6.22%,其中S3-EPT组中Bacteroidetes在厌氧共发酵过程中的丰度提升最明显,提升至39.00%,Bacteroidetes可分解碳水化合物和蛋白质,并合成乙酸等VFAs,Bacteroidetes丰度的提升有利于乙酸累积。可见,电化学预处理有利于富集筛选水解酸化细菌,为提高VFAs的合成提供了有利条件。
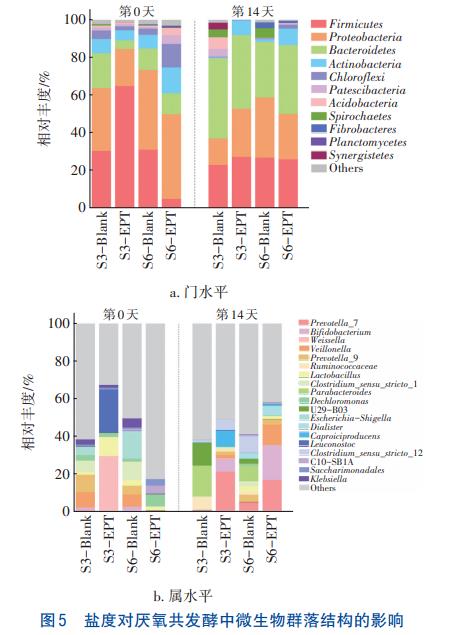
如图5(b)所示,对照组和实验组在属水平上的微生物组成差异显著,S3-Blank中占主要优势的菌属为Prevotella_9(普氏菌属,9.27%)和Veillonella(韦荣氏球菌属,8.20%),S6-Blank中占主要优势的菌属为Escherichia-Shigella(埃希氏杆菌属,13.74%)和Clostridium_sensu_stricto_1(梭菌属,9.65%)。经电化学预处理后,S3-EPT组的主要优势菌属变为Weissella(魏斯氏菌属)和Leuconostoc(明串珠菌属),相对丰度分别为29.11%和22.95%,还检测出较高丰度的Lactobacillus(乳杆菌属,9.95%),Leuconostoc、Weissella和Lactobacillus均属于Firmicutes,是常见的乳酸菌。在VFAs的合成路径中,乳酸可在丙酮酸脱氢酶作用下被转化为丙酸。S6-EPT组的主要优势菌属变为Dechloromonas(脱氯单胞菌属,6.47%),其他各菌属的相对丰度较低(低于5%)。可见,盐度的提升在一定程度上对微生物进行了筛选,盐度越高,电化学预处理后残留RCS含量越高,低含量RCS可筛选微生物种类,提高水解酸化菌的相对丰度,从而改善厌氧共发酵效果,而高含量RCS会抑制水解酸化菌活性。
经过14d厌氧共发酵,各组中优势菌属发生了明显变化,对照组S3-Blank中占主要优势的是Parabacteroides(副拟杆菌属,16.43%)和U29-B03(12.07%),实验组S3-EPT中相对丰度超过5%的菌属较多,其优势菌属主要为Prevotella_7(普氏菌属)、Caproiciproducens(产己酸菌属)、Bifidobacterium(双歧杆菌)和Clostridium_sensu_stricto_12(梭菌属),相对丰度分别为21.07%、8.52%、6.75%和5.62%。有研究表明,Prevotella在pH为4.6~5.0条件下,可降解碳水化合物和部分蛋白质,合成琥珀酸和乙酸,提高VFAs产量。Caproiciproducens主要参与有机酸的代谢,产物为H2、乙酸、丁酸和己酸等。Bifidobacterium隶属于Actinobacteria,可以将难降解的纤维素等分解。Clostridium作为一种水解菌株,在水解碳水化合物和蛋白质方面发挥着重要作用。对照组S6-Blank中占主要优势的为Clostridium_sensu_stricto_12(梭菌属,8.74%)和Parabacteroides(副拟杆菌属,8.19%),实验组S6-EPT中优势菌属主要为Bifidobacterium(双歧杆菌属)、Prevotella_7(普氏菌属)和Veillonella(韦荣氏球菌属),相对丰度分别为18.55%、16.56%和10.92%。尽管盐度为6g/L的混合基质厌氧共发酵后水解酸化菌属的相对丰度较高,但由于RCS含量较高,破坏了微生物细胞结构,细菌基因表达受限,限制了有机物分解与VFAs合成。
综上,盐度为3g/L的混合基质经电化学预处理后不仅有利于初期富集筛选Firmicutes,还可提高水解酸化细菌的丰度(如Prevotella_7),为强化产酸提供了有利条件;盐度为6g/L的混合基质在电化学预处理后残留RCS含量较高,虽筛选富集了水解酸化菌,但显著抑制了微生物活性,不利于有机物分解与VFAs合成。
3、结论
①对于剩余污泥-餐厨垃圾混合基质,盐度与电化学预处理后残留RCS含量呈强正相关性,R2为0.98,残留RCS可促进有机质溶出并调节pH,改善混合基质可生化性。相对较低的盐度(3g/L)更有利于提高电化学预处理混合基质中有机质的溶出效能,可生化性较好的溶解性蛋白质相比未预处理组提升了近2倍。较高的盐度(10g/L)虽然能促进混合基质中有机质的溶出,但易生物利用底物(如溶解性蛋白质)的溶出量较少。
②剩余污泥-餐厨垃圾混合基质的最佳盐度为3g/L,VFAs产量最高达到2259.33mg/L,相比未预处理组提升了33.27%,水解、乙酸合成、丙酸合成相关酶的活性提高,而产甲烷酶活性被抑制,关键酶活性的协同变化有效强化了混合基质水解和VFAs合成。盐度较高(6g/L)的混合基质中水解产酸相关酶活性相比对照组降低了5%~10%,不利于厌氧发酵产酸。
③盐度的提升在一定程度上筛选了微生物种类,盐度与电化学预处理后RCS含量呈强正相关性,残留RCS有利于提高厌氧发酵过程中水解酸化菌的丰度。盐度为3g/L的混合基质在厌氧发酵后优势水解酸化菌门(如Firmicutes等)相对丰度之和相比对照组升高了24.28%。但过高RCS含量会破坏细胞结构和抑制微生物基因表达。(来源:中国市政工程西南设计研究总院有限公司,华中科技大学环境科学与工程学院)



