厌氧氨氧化(anaerobicammoniumoxidation,Anammox)可以代替传统硝化反硝化工艺去除污水中的氮,具有能耗低、产泥量少、无需外加碳源和运行成本低等优势,被认为是最有前途的生物脱氮工艺之一。由于厌氧氨氧化生长缓慢,倍增时间长,工程上采用生物膜或颗粒污泥形态持留厌氧氨氧化菌(anaerobicammoniumoxidationbacteria,AnAOB),以保证系统稳定运行。目前,厌氧氨氧化工艺已成功应用于污泥厌氧消化上清液等高浓度氨氮污水处理中。由于城市污水具有氨氮浓度低、温度低等特点,限制了厌氧氨氧化的主流应用。为提高AnAOB活性,通常采用投加FeS、Fe(Ⅲ)、纳米零价铁(nZVI)、羟胺(NH2OH)、肼(N2H4)、石墨烯以及生物炭等辅助材料。其中,N2H4作为厌氧氨氧化代谢中间产物受到广泛关注。N2H4可以通过抑制其他细菌生长,降低与AnAOB对底物的竞争,同时为AnAOB的生长提供额外能量,减少NO3--N的产生,从而提高厌氧氨氧化反应器脱氮性能。
YAO等研究表明,当加入3.99mg·L-1的N2H4时,CANON系统中颗粒污泥的厌氧氨氧化活性增加,当N2H4质量浓度为4.86mg·L-1时,可以缓解NO2--N对AnAOB活性的抑制。MIODOŃSKI等添加了3.7mg·L-1的N2H4后,在高基质浓度条件下厌氧氨氧化系统在42d内完成了快速启动,平均氮负荷率(nitrogenloadingrate,NLR)比对照组高2倍。蔡庆等通过批式实验研究N2H4对高基质浓度下(NH4+-N约225mg·L-1,NO2--N约280mg·L-1)厌氧氨氧化颗粒污泥的短期影响,结果发现,当N2H4质量浓度在1.8~9.5mg·L-1时,厌氧氨氧化活性明显增加。XIANG等研究发现当N2H4质量浓度为2~5mg·L-1时,纯颗粒污泥和絮体-颗粒混合污泥的反应器均可保持长达4个月的稳定高效运行,但纯颗粒污泥系统具有更高效的性能,总氮去除速率(totalnitrogenremovalrate,TNRR)达到(0.33±0.04)g·(L·d)-1。可见,N2H4对AnAOB活性的影响不仅与N2H4质量浓度有关,还与污泥形态有关。目前大部分研究集中于N2H4对颗粒形态AnAOB的影响,而低质量浓度N2H4对生物膜形态厌氧氨氧化体系的研究尚有不足。但在城市污水低氨氮浓度条件下,厌氧氨氧化颗粒污泥粒径小,难以有效持留在系统中,而通过载体形成的厌氧氨氧化生物膜可被有效截留于反应器中,因此,生物膜形式的厌氧氨氧化技术具有更广泛的应用。悬浮载体上的生物膜可自发富集AnAOB,加速AnAOB的粘附与生长,从而加速主流厌氧氨氧化工艺性能的提升。由于生物膜传氧限制,厌氧氨氧化生物膜可以在低溶解氧(dissolvedoxygen,DO)环境下生长,对正常的北方气候温度和低氨氮底物浓度适应良好。因此,探究低质量浓度N2H4对厌氧氨氧化生物膜的长期影响,可以为厌氧氨氧化的在城市污水脱氮中的应用提供技术支撑。
1、材料与方法
1.1 实验装置
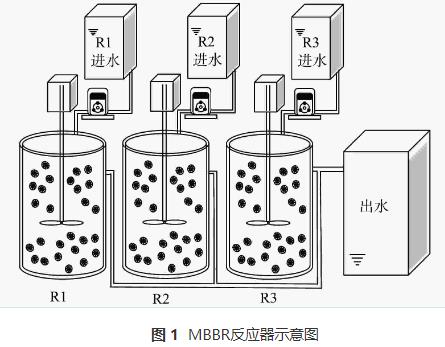
实验室规模的小试采用3个圆柱形移动床生物膜反应器,有效容积为2L。R1为对照组,R2和R3中分别添加5mg·L-1和10mg·L-1的N2H4。3个反应器中均填充已挂膜的填料,填充比为35%,填料直径为25mm,高10mm。采用序批式活性污泥法(sequencingbatchreactoractivatedsludgeprocess,SBR)运行,周期为6h(360min),包括5min进水,340min搅拌,14min沉降和1min排水,HRT为1d,日处理量为2L·d-1。3个反应器均在常温条件下运行,温度在(27.6±2.4)℃。反应器装置如图1所示。
1.2 生物膜与模拟废水
实验中用到的生物膜污泥来自实验室稳定运行196d的移动床生物膜反应器(movingbedbiofilmreactor,MBBR),NLR为0.6kg·(m3·d)-1,生物膜系统中的污泥质量浓度为(1800±100)mg·L-1。
实验采用模拟废水,主要成分有50mg·L-1 NH4+-N、55mg·L-1 NO2--N、300mg·L-1 CaCl2·2H2O、180mg·L-1 MgSO4·7H2O、27.2mg·L-1 KH2PO4以及500mg·L-1 NaHCO3。每升废水分别加入1mL微量元素Ⅰ和Ⅱ。N2H4以N2H4·H2SO4的形式投加。初始pH通过滴加1mol·L-1的HCl或NaOH溶液调节到6.9~7.3。配水采用自来水,未对其进行脱氧处理,进水DO质量浓度为5mg·L-1。
1.3 实验设计
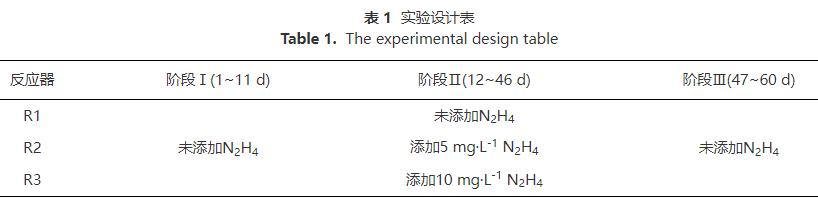
整个过程按不同运行参数分为3阶段。阶段Ⅰ(1~11d):为获取较为稳定的实验条件,反应器在初始NLR下运行。阶段Ⅱ(12~46d):加入N2H4运行,3个反应器N2H4质量浓度分别为0、5、10mg·L-1。阶段Ⅲ(47~60d):停止加入N2H4,反应器继续运行。实验设计如表1所示。
1.4 分析方法
用比色法测定NH4+-N、NO2--N、NO3--N和N2H4的质量浓度。其中NH4+-N、NO2--N和NO3--N采用标准测试方法。通过加入1mol·L-1 HCl和0.1mol·L-1 KIO3溶液消除N2H4对NH4+-N测定的干扰。N2H4依照Watt和Chrisp的检测方法,通过加入0.5%的氨基磺酸溶液消除NO2--N对N2H4测定的干扰。在每个阶段结束(反应器运行第11、46和60天)留取生物样品测定生物量(suspendedsolids,SS)、有机物量(volatilesuspendedsolids,VSS)、胞外聚合物(extracellularpolymericsubstances,EPS)、血红素和微生物群落结构。
采用水解法提取生物膜样品中的EPS(主要由蛋白质和多糖组成),蛋白质(proteins,PN)用改良Folin-Lowry法测定,使用牛血清蛋白作为标准物质。多糖(polysaccharides,PS)用蒽酮-硫酸法测定,使用葡萄糖作为标准物质。EPS浓度以单位质量挥发性有机物中EPS的质量(mg·g-1)表示。
用磷酸盐缓冲液(PBS)通过细胞破碎的方式提取血红素,以氯化血红素作为标准物质,通过Pyridine-NaOH方法测定血红素的含量。血红素浓度以单位质量挥发性有机物中血红素的物质的量(μmol·g-1)表示。
1.5 计算方法
为直观表示出整个反应体系中的主导反应,依照亚硝化反应(式(1))、硝化反应(式(2))以及厌氧氨氧化反应(式(3))的化学计量方程计算得到含有NH4+-N、NO2--N、NO3--N变化量的公式。在进水无有机物的厌氧氨氧化反应器中,异养生物对NRR的贡献通常<5%,可忽略其对整体反应的影响,故在计算时不考虑反硝化过程,计算得到式(4)~式(7)。
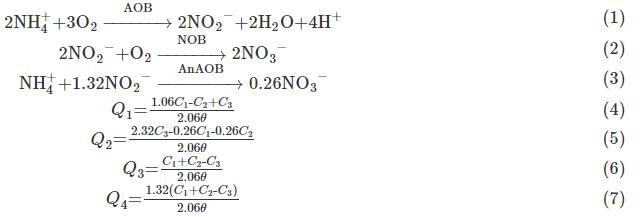
式中:θ为周期时间,d;C1,C2为1个周期内NH4+-N和NO2--N的去除量,mg·L-1;C3为NO3--N的生成量,mg·L-1。Q1为AOB对NH4+-N的氧化速率(AOR),g·(m3·d)-1;Q2为NOB对NO2--N的消耗速率(NOR),g·(m3·d)-1。Q3 为AnAOB对NH4+-N的消耗速率(AnAOR),g·(m3·d)-1;Q4为AnAOB对NO2--N的消耗速率(AnANR),g·(m3·d)-1。
1.6 微生物群落结构分析
在各阶段的稳定运行期内,保留生物膜样品于-80℃条件下冻存。实验结束后统一进行基因组DNA的提取,之后采用341F(5’-CCTACGGGNGGCWG-CAG-3’)和785R(5’-GACTACHVGGGTATCTAATCC-3’)作为扩增引物,对细菌16SrRNA基因进行2轮PCR扩增。后续使用IlluminaNovaseq6000测序平台进行高通量并行测序,将相似水平在97%的序列归为1个OTU进行生物信息统计分析。
2、结果与讨论
2.1 N2H4对总氮去除率的影响
反应器各阶段运行性能如图2所示。在进水NH4+-N和NO2--N质量浓度分别为(50.9±3.6)mg·L-1和(55.5±3.2)mg·L-1条件下持续运行11d后,3个反应器运行趋于平稳。阶段Ⅰ结束时NRR分别为27.7、24.7、23.2g·(m3·d)-1,这一差异可能是由于实验前期选取的生物膜填料挂膜不均匀导致。
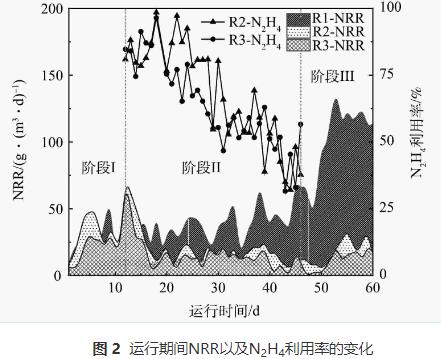
对照组R1内逐渐形成稳定的厌氧氨氧化环境,阶段III时NRR最高达到139.2g·(m3·d)-1。R2和R3在加入N2H4后均表现出NRR先快速上升后下降的趋势。阶段Ⅱ运行前期(第12~15天),R2和R3中的NRR分别提升了74%和44%,此时N2H4的利用率均在74%以上。随着运行周期的增加(第16~46天),R2和R3的脱氮效能逐渐下降,其中R2内NRR下降了53%,R3内NRR下降了64%,在阶段Ⅱ结束时(第46天)R2和R3中N2H4的利用率分别从最高值(97%和79%)下降到32%。当R2和R3系统内的脱氮效能低于15g·(m3·d)-1时停止加N2H4,开始阶段Ⅲ的运行。N2H4的抑制解除后,R2内厌氧氨氧化活性开始逐渐恢复,到阶段Ⅲ末期,NRR由阶段Ⅱ末期的11.0g·(m3·d)-1升至到33.4g·(m3·d)-1,R3的NRR也由10.4g·(m3·d)-1升至22.8g·(m3·d)-1,表明停止投加N2H4后,其抑制作用可缓慢恢复。经14d恢复后,R2反应器的脱氮效能恢复到投加N2H4前的水平,然而,10mg·L-1的N2H4对生物膜的抑制作用更强,生物膜恢复更加缓慢。SCHALK等(N2H4投加量为28.8mg·L-1)的研究结果也证实了这一点。但GANESAN等(N2H4投加量为10mg·L-1)、ZHOU等(N2H4投加量为10mg·L-1)、MIODOŃSKI等 (N2H4投加量为3.7mg·L-1)和XIANG等(N2H4投加量为2~5mg·L-1)的研究结果均表明,投加不同质量浓度的N2H4均能维持脱氮系统长期运行且N2H4可被快速消耗,这与本研究的结果并不一致。
本研究中出现N2H4浓度不断积累且NRR不断下降的现象,推测可能有以下2点原因。一方面,生物膜与颗粒污泥的形态结构存在差异。对比本研究中使用的生物膜,颗粒污泥结构更加密实,传质效率低,内部更容易形成较强的浓度梯度,即实际进入颗粒污泥内部的N2H4浓度会低于水中测得的浓度。溶质的浓度梯度是随着生物膜厚度的增加而形成的,生物膜厚度会影响液体的流动扩散和营养物质的传质效果,从而影响工艺整体性能。本研究中生物膜厚度较薄(约550μm),可推测扩散到生物膜内部的N2H4质量浓度较高,从而对AnAOB产生较强的毒性效应。另一方面,基质的质量浓度和N2H4质量浓度的比例不同。在前人研究N2H4对低基质(TN<100mg·L-1)厌氧氨氧化系统的长期影响中,维持系统良好脱氮效果的基质质量浓度与N2H4质量浓度的比例在10左右。本实验中R2和R3中此比例分别为21和10.5,但显然R3受到更强的抑制作用,很可能是N2H4扩散到生物膜的速度过快,因此,需要降低N2H4的质量浓度以达到更好的TN去除效果。根据STROUS提出的厌氧氨氧化分解代谢模型,可推知未反应完全的N2H4会促使反应逆向进行从而产生NH4+-N。SCHALK等在加入N2H4的厌氧氨氧化批式实验中观察到,1mol的N2H4可被转化为1.3mol的NH4+-N,在ZEKKER等的实验中,1mol的N2H4可形成1.63molNH4+-N。可见,AnAOB对N2H4有歧化作用,高质量浓度的N2H4会导致NH4+-N不断积累而升高,从而NRR也不断下降。
2.2 N2H4对生物量的影响
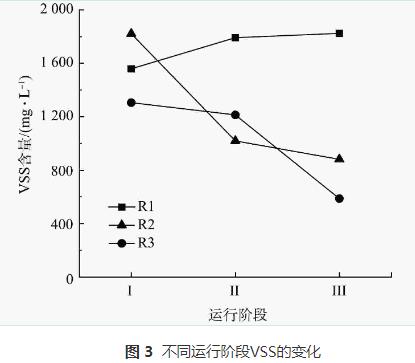
整个运行期间3个反应器内生物量变化如图3所示。对照组R1中的生物量随运行时间的增加逐渐升高,在整个实验周期结束时VSS达到1824mg·L-1。且R1在3个反应器中表现出最好的脱氮性能,也证实了R1内生物膜活性较高的结论。在阶段Ⅱ中,R2和R3中均出现了污泥流失情况。停止加入N2H4后,2个反应器内污泥量仍持续下降。R2在阶段Ⅱ和阶段Ⅲ结束时的VSS分别为1019mg·L-1和880mg·L-1,R3在阶段Ⅱ和阶段Ⅲ内VSS分别为1213mg·L-1和587mg·L-1。对比初始值,阶段Ⅲ结束时R2的VSS浓度下降了52%,R3内的VSS浓度下降了55%,可以看出,加入N2H4后反应器内部生物膜会逐渐脱落和流失,生物膜活性减弱,导致系统内部的脱氮效能下降。
2.3 N2H4对各反应过程的影响
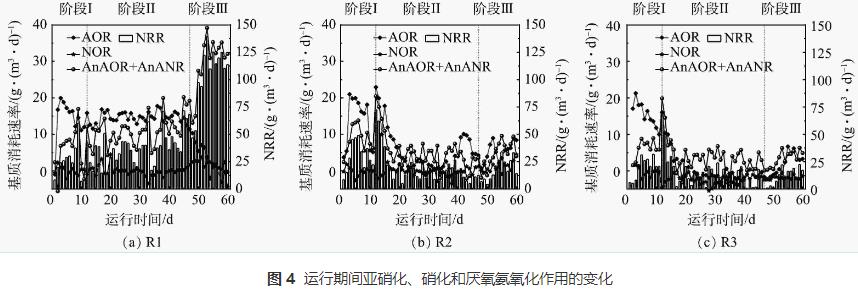
由于进水中含有一定溶解氧,促进了脱氮系统中硝化菌的生长。为评估系统中亚硝化,硝化和厌氧氨氧化效果,对反应器中各阶段的氮素变化量进行分析,从而得到各个反应体系中氨氧化菌(ammonia-oxidizingbacteria,AOB)、亚硝酸盐氧化菌(nitrite-oxidizingbacteria,NOB)和AnAOB的变化趋势,结果如图4所示。从图4(a)可以看出,在阶段Ⅰ和阶段Ⅱ,R1中的AOB和NOB均维持在稳定状态,AnAOB活性逐渐升高,阶段Ⅱ结束时提高了约80%。但在阶段Ⅲ开始时AOB作用减弱,NOB和AnAOB作用增强,NRR最高可达139.2g·(m3·d)-1。R2以及R3内基质消耗速率分别见图4(b)和图4(c)。加入N2H4后2个反应器内AOR、AnAOR和AnANR短暂提升,与NRR变化规律相一致,说明N2H4的投加会在短期内迅速提高厌氧氨氧化生物膜系统的脱氮效能。有研究表明,外源N2H4可以直接被AnAOB利用,促进厌氧氨氧化进程。对本研究中的厌氧氨氧化生物膜来说,N2H4添加量为5mg·L-1时的脱氮效果优于10mg·L-1。对比对照组R1,R2和R3系统内的AnAOB和AOB的活性均只在加入N2H4的前4d得到提升,但很快就下降到较低水平,与NRR的变化规律一致。这可能是由于N2H4的长期抑制作用导致反应器内生物量随着生物膜不断脱落而流失(SS分别为6194mg·L-1和4322mg·L-1),因此,反应器内功能菌的数量进一步降低。阶段Ⅱ运行后期(第31~46天)R2和R3出水N2H4质量浓度分别稳定在1~3mg·L-1和3~5mg·L-1,推测在此阶段N2H4的投加量超过AnAOB的利用量,AnAOB不能有效降解N2H4,继续添加会导致N2H4逐渐积累从而抑制AnAOB的活性。由于N2H4对AOB和NOB均有毒性作用,因此,整个体系中AOB和NOB作用均较弱,而NOB比AOB更敏感,会导致NOB的占比更低。在阶段Ⅲ中,停止加入N2H4后,R2和R3中AOB和AnAOB的占比逐渐上升,体系中的脱氮效果也在缓慢提升,可见N2H4的抑制效果是可逆的,但N2H4为5mg·L-1的R2能逐渐恢复到抑制前的脱氮水平,而投加10mg·L-1 N2H4的R3较难恢复。
2.4 N2H4对EPS的影响
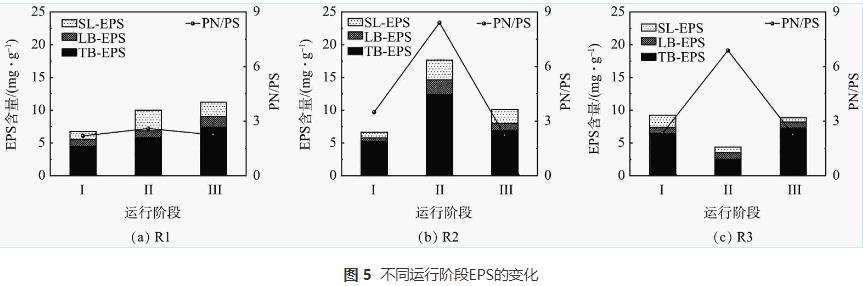
EPS对生物膜的形成和稳定有重要作用,因此,有必要探讨N2H4对生物膜EPS的影响。3个反应器中EPS变化量及蛋白质和多糖的比值(PN/PS)变化情况如图5所示。对照组R1的EPS处于稳定增长状态,各阶段EPS含量分别为6.76、10.03和11.22mg·g-1,PN/PS稳定在2.19~2.59,与反应器中NRR的变化趋势一致。阶段Ⅱ结束时(第46天),R2中EPS由阶段I的6.60mg·g-1增加到17.68mg·g-1,同时PN和PS的含量也发生变化,PN/PS由3.49增加到8.23。由于外部环境的改变会刺激细菌分泌较多的EPS,这种自我保护行为会适当减轻不良环境造成的影响,N2H4的毒性作用导致R2内的细菌分泌大量EPS。EPS中的PN/PS通常用于定义生物膜的状态,活性污泥的PN/PS维持在1~4是一个适宜的水平。由于PN会比PS优先响应外部环境变化,且较高质量浓度N2H4可通过分泌大量结合蛋白(boundprotein,B-PN)触发厌氧氨氧化污泥的自我保护机制,导致R2中的PN增长了2倍,生物膜变得蓬松不稳定,促进了生物膜的脱落和流失,引起反应器运行效能的下降。这与阶段Ⅱ观察到的反应器出水浊度增大以及NRR的下降一致。与R2相反,R3内的EPS由9.23mg·g-1下降到4.38mg·g-1,PN/PS的值由2.33增加到6.88。这可能是由于R3中N2H4质量浓度过高,对生物膜产生更强的毒性致使微生物死亡,导致EPS含量下降。停止加入N2H4后,R2的EPS含量下降了42%,PN/PS为2.20,与对照组R1近乎相平。R3的EPS含量逐渐升高至8.84mg·g-1,PN/PS为2.25。PN/PS的值越低则系统稳定性越高,2个反应器内PN/PS均降到适宜范围(1~4)内,可证明污泥结构已经趋于稳定,受N2H4刺激后生物膜缓慢恢复。
2.5 N2H4对血红素的影响
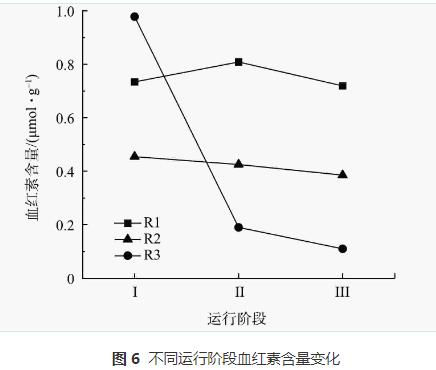
血红素参与AnAOB的主要代谢反应,具有催化和电子转移潜力,可以作为评估厌氧氨氧化性能的指标。不同质量浓度N2H4对AnAOB中血红素的影响如图6所示。对照组R1各阶段的血红素含量分别为0.73、0.81、0.72μmol·g-1,整体维持在平稳状态。R2和R3中血红素含量均呈现下降的趋势。R2从0.45μmol·g-1 降至0.39μmol·g-1,R3则从0.78μmol·g-1降至0.11μmol·g-1。在厌氧氨氧化的代谢过程中,N2H4作为厌氧氨氧化过程的中间产物,会被脱氢酶(hydrazinedehydrogenase,HDH)氧化成N2,从而完成脱氮过程。细胞色素c的含量与HDH活性存在正相关,HDH酶的活性越高,处于还原状态的细胞色素c的就越多,而血红素是细胞色素c的关键组分。在本研究中,加入N2H4后的生物膜中的血红素含量一直下降,即HDH的活性一直下降,阻碍了厌氧氨氧化过程中催化N2H4氧化生成N2这一反应的正向进行,从而导致N2H4积累。由于N2H4具有强毒性,HDH受到高质量浓度N2H4的抑制,血红素的还原能力下降,AnAOB的活性受抑制,最终导致系统中NRR下降。此外,通过对比R2和R3在整个反应阶段血红素的变化量,可看出N2H4的加入量越高,抑制作用越明显,厌氧氨氧化活性越难以恢复。
2.6 N2H4对微生物群落的影响
反应器在不同运行周期门水平和属水平的微生物群落结构如图7所示。可以看出,细菌的相对丰度随运行条件的改变有明显差异,表明N2H4对微生物群落的影响逐渐显现。由图7(a)中可观察到所有样本中的主要优势菌门有变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和装甲菌门(Armatimonadetes),这些都是脱氮系统中常见的典型细菌。有研究表明AnAOB隶属于浮霉菌门,对照组R1在整个运行周期内Planctomycetes一直维持在较高水平(12.86%~23.36%),实现了MBBR脱氮系统的长期稳定运行。加入N2H4后,R2中Planctomycetes呈现先上升至26.33%,而后下降至2.50%的现象,丰度的上升与NRR的短暂增加的结果相一致。R3内几乎不存在Planctomycetes,其相对丰度从4.44%下降到2.86%,同时可观察到放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)占明显优势,其相对丰度分别由0.55%和0.31%增长至7.17%和10.46%,说明N2H4会促进其它菌门的生长,Planctomycetes与Actinobacteria等菌门之间对底物的竞争增大,降低了AnAOB的占比,破坏脱氮系统的稳定性。
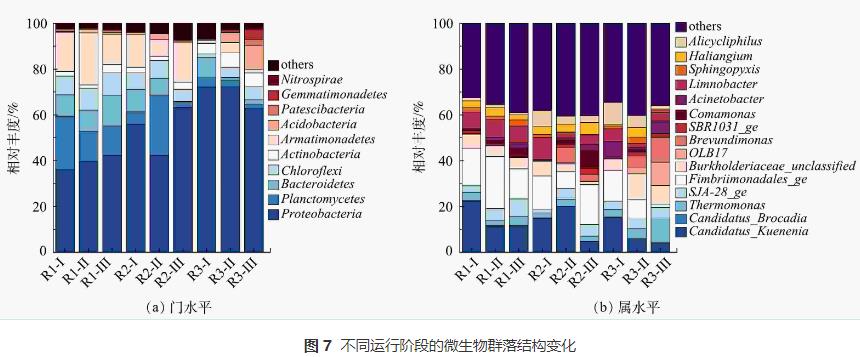
图7(b)反映了了各反应器在不同运行阶段,相对丰度占比在前15的主要菌属。样品中均检测出2种属水平AnAOB,Candidatus_Kuenenia和Candidatus_Brocadia,其中以Candidatus_Kuenenia为主。对照组R1在整个运行周期内Candidatus_Kuenenia一直维持在较高水平(11.18%~22.37%),即使在阶段Ⅱ略有下降但仍占主导地位。对比阶段Ⅲ和阶段Ⅰ,R2和R3中Candidatus_Kuenenia所占比例分别下降了64%和61%,表明长期添加微量N2H4会使AnAOB相对丰度降低,这与反应器运行过程中系统脱氮效率降低的现象一致。Fimbriimonadales在对照组R1中的相对丰度较高,为13.18%~22.68%。有研究表明,Fimbriimonadales是一种异养菌,也可以利用NH4+-N和NO2--N生成N2。本研究中Fimbriimonadales可能与AnAOB共存于反应器中协同脱氮。对照组R1中Burkholderiaceae一直维持在4.89%~6.37%,R3中Burkholderiaceae的相对丰度从阶段Ⅰ的5.16%上升到阶段Ⅱ的11.17%。Burkholderiaceae属于反硝化细菌,具有还原NO3--N或NO2--N的能力。可见,N2H4的长期加入促进了Burkholderiaceae的生长,加大了对底物NO2--N的竞争,抑制了AnAOB生长。有研究表明,Limnobacter可与AnAOB共生,这可以保护AnAOB免受不利环境的影响。对照组中Limnobacter的丰度稳定在7%左右,但该菌属在R2中的丰度由9.55%降至2.12%,R3中由5.64%降至1.62%。N2H4会破环这种保护平衡,令AnAOB暴露在不利环境中,从而降低其活性。终上所述,N2H4不仅直接降低Candidatus_Kuenenia的丰度,还对与AnAOB菌属协同脱氮的其它菌属起到抑制作用,从而降低反应器整体功能菌属的活性,进而影响脱氮效果。
3、结论
1)在进水NH4+-N质量浓度在(50.9±3.6)mg·L-1,NO2--N质量浓度在(55.5±3.2)mg·L-1的条件下,加入5mg·L-1和10mg·L-1的N2H4可以使NRR短暂增长,但长期运行后NRR分别下降了53%和64%。N2H4的长期加入会对生物膜产生生物毒性,抑制脱氮过程。
2)5mg·L-1的N2H4使生物膜的EPS分泌量提高,触发生物膜保护机制,解除N2H4抑制后,EPS浓度恢复,但生物膜变得松散,易脱落,导致污泥流失。10mg·L-1的N2H4抑制了生物膜中AnAOB的活性,EPS和血红素含量均明显下降,解除N2H4抑制后,生物膜脱氮活性也难以恢复。
3)长期添加微量N2H4会降低厌氧氨氧化生物膜脱氮系统中Planctomycetes和Candidatus_Kuenenia的丰度。(来源:北京工商大学生态环境学院,唐山曹妃甸城市排水有限公司,浦华控股有限公司)



