苯酚作为一种重要的化工原料,广泛应用于酚醛树脂、炼油、焦碳、染料、纺织、杀虫剂、农药和医药等的生产中,因此,它也是环境中常见的污染物,在相应化工工业废水中含有较高的浓度。相对于其他疏水性有机污染物,苯酚易溶于水,微生物处理方法是去除废水中这类有机物很有前景的方法。目前文献报道的、可耐高浓度苯酚的菌株有酵母菌(Yeast trichosporon)、假单胞菌(Pseudonomonas sp. )、根瘤菌(Rhizobia)、产酸克雷伯菌(Klebsiella oxytoca) 等。研究表明,微生物可以通过羟化和羧化途径启动苯酚降解,且可进一步开环裂解生成开环下游产物。目前有关微生物降解苯酚的羟化酶及其基因研究较充分,而羧化酶基因的功能研究较少。从目前的文献报道看,苯酚羧化途径仅在厌氧条件下进行 ;然而,我们实验室前期分离获得一株能快速降解苯酚的菌株—施氏假单胞菌N2,研究发现在好氧状态下亦有羧化产物的生成。为了更充分研究该菌细胞中羧基裂解酶基因的功能,实验室前期从N2 菌株中调取2 个羧基裂解酶基因ubiX 和ubiD,并已成功构建ubiX 和ubiD 单突变株N2ubiX - 菌和N2ubiD - 菌及其该双基因缺失的双突变株N2ubiX - ubiD - 菌。笔者研究了N2 菌及其突变株降解苯酚过程中对苯酚毒性的响应特性、开环裂解特性以及4 株菌生成苯酚下游产物的差异性,并对不同羧化基因在降解苯酚过程中所产生的作用进行了研究。
1 材料与方法
1. 1 实验材料
1. 1. 1 菌种来源
施氏假单胞菌N2,本实验室分离并鉴定;N2 的突变株N2ubiX - 、N2ubiD - 和N2ubiX - ubiD - ,陕西省微生物研究所提供。
1. 1. 2 培养基
2 g NH4 Cl,2 mL 微量元素 ,25 mL 磷酸盐缓冲液 , pH 为7. 5,用蒸馏水定容至1 000 mL,121 ℃高压水蒸气灭菌30 min,备用。
LB 培养基:酵母粉5. 0 g·L - 1 ,蛋白胨10. 0 g·L - 1 ,NaCl 10. 0 g·L - 1 ,蒸馏水1 000 mL,调节pH 值为7. 3 ~ 7. 5,121 ℃ 灭菌30 min,待用。
1. 2 实验方法
1. 2. 1 种子液的制备
在无菌操作环境下,将N2、N2ubiX - 、N2ubiD - 和N2ubiX - ubiD - 4 种菌株接种于相应的LB 培养基中,于31 ℃ ,150 r·min - 1 摇床好氧振荡20 h,OD550 nm 达到1. 86 ± 0. 07,待用。
1. 2. 2 不同苯酚浓度对N2 菌及其突变株生长特性和开环裂解苯酚的影响实验
取100 mL 上述无机盐培养基,在无菌操作环境下加入苯酚水溶液,使苯酚初始浓度分别为100、400、1 000 mg·L - 1 ,并且分别在其中接入8% 的N2 及其突变菌的种子液。31 ℃ ,150 r·min - 1 摇床培养,定点取样测定其OD550 nm 和紫外光谱。
1. 2. 3 N2 及其突变株对苯酚的降解效率
按照1. 2. 2 中的方法,将定点所取样品于4 ℃ ,12 000 r·min - 1 ,离心10 min,收集上清液,将上清液用0. 22 的水系膜过滤至高效液相色谱专用小瓶,备用。
1. 2. 4 粗酶液的制备
将1. 2. 2 中培养24 h 的菌液在4 ℃ 下,12 000 r·min - 1 离心10 min,收集菌体。用0. 05 mol·L - 1 ,pH为7. 0 的磷酸盐缓冲液洗涤菌体2 次,再用该磷酸盐缓冲液悬浮菌体细胞。置于0 ℃ 的冰水浴中,用JY88-II 型超声波细胞破碎仪间歇处理10 次,每次1 min,功率450 W。破碎后,在4 ℃ 下,12 000 r·min - 1离心20 min,上清液为粗酶液,备用。
1. 2. 5 苯酚降解中间产物的提取及其衍生方法
按照1. 2. 2 中的方法,利用N2 菌降解苯酚,24 h 后,12 000 r·min - 1 ,离心10 min,收集上清液。用6mol·L - 1 的盐酸调至pH 约为2,用3 × 20 mL 乙酸乙酯萃取,合并有机相,用无水硫酸钠干燥,旋转蒸发浓缩至0. 5 mL,加0. 1 mL N,O-双(三甲基硅烷基)乙酰胺, 60 ℃ 水浴,30 min,备用。
1. 3 分析方法
1. 3. 1 菌体浓度的测定条件
菌体浓度的测定采用比浊法 ,使用722 型分光光度计在550 nm 时测定其OD 值。
1. 3. 2 高效液相色谱法测定条件
日本分光公司LC-2000 二级管矩阵紫外检测器高效液相色谱系统。其色谱柱为ODS Hypersil 反相C18(25 cm × 4. 6 mm,5 μm 填料)高效液相色谱柱。所用仪器为由PU-2089 四元梯度泵,MD-2010 二极管阵列紫外可见检测器组成,进样系统为带有100 μL 定量环的自动进样器组成的日本分光JASCO LC-2010系统。本实验中所使用的流动相甲醇和超纯水都需经超声处理,其中流动相的体积比为V(超纯水) ∶ V(甲醇) = 55 ∶ 45,进样体积15 μL,流速1 mL·min - 1 。

式中:ht 表示t 时刻高效液相色谱苯酚的峰高;h0 表示初始高效液相色谱中苯酚的峰高。
1. 3. 3 紫外吸收曲线的测定条件
将培养液在4 ℃ ,12 000 r·min - 1 下离心10 min,取上清液,用DR5000 分光光度计在波长340 ~ 400nm 范围内进行紫外波长扫描。
1. 3. 4 邻苯二酚1,2-双加氧酶和邻苯二酚2,3-双加氧酶的活性测定方法
采用分光光度法[13] ,总体积为10 mL,其中粗酶液2 mL,0. 05 mol·L - 1 ,pH 为7. 0 的磷酸盐缓冲液6. 9 mL,40 mmol·L - 1 EDTA 1 mL,30 mmol·L - 1 邻苯二酚0. 1 mL。投加邻苯二酚后,立即在30 ℃ 水浴中反应,每5 min 取样一次,用DR5000 分光光度计在波长240 ~ 300 nm 和340 ~ 410 nm 范围内进行紫外波长扫描。260 nm 处光吸收随时间的增加值能反映C12O 的活性,260 nm 处峰值的增加标志产物顺,顺-己二烯二酸的积累。375 nm 处光吸收随时间的增加值能反映C23O 的活性,375 nm 处每增加1. 2 个吸光值代表1 mmol 2-羟基黏糠酸半醛(2-HMS)的生成,酶活性大小以每mg 蛋白每分钟生成的产物的量表示,单位为μmol·(mg·min) - 1 。
1. 3. 5 蛋白质的测定
按Bradford 法 进行测定。
1. 3. 6 GC-MS 测定条件
美国Finnigan 公司Trace MS 型气相-质谱联用仪, 色谱柱为DB-5(30 m × 0. 25 mm × 0. 25 μm)。GC参数:载气为99. 999% 的高纯氦气,载气流量为1 mL·min - 1 ,恒流模式,不分流,进样体积为1 μL,进样口温度为280 ℃ 。升温程序:60 ℃ 保持1 min,以5 ℃ ·min - 1 升至200 ℃ (保持5 min),再以15 ℃ ·min - 1升至280 ℃ (保持5 min)。MS 参数:EI + 轰击源,电子能量为70 eV,离子源温度200 ℃ ,连接杆温度为250 ℃ ,扫描方式为全扫描,扫描范围为m / z 30 ~ 450,扫描时间为8 ~ 28 min。
2 结果与分析
2. 1 施氏假单胞菌N2 及其羧基裂解酶基因突变株对苯酚毒性的响应特性
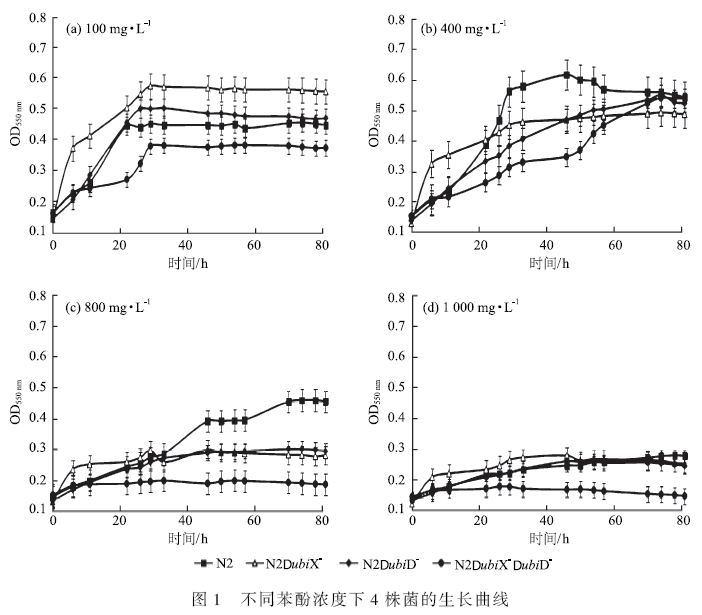
按照1. 2. 2 和1. 2. 3 中的方法,研究4 株菌在液体无机盐培养基中对苯酚毒性的抵抗性能及对苯酚的降解效率,结果如图1、图2 所示。
图1 中(a)、(b)、(c)、(d) 分别为苯酚浓度100、400、800 和1 000 mg·L - 1 体系。图1(a) 表明,N2ubiX - 在苯酚浓度低于100 mg·L - 1 时,其细胞生长速度较快,在生长24 ~ 28 h 范围内各菌细胞均达到最大生长量,OD550 nm 分别0. 574 和0. 452。在高浓度苯酚条件下,突变株N2ubiX - 仍对苯酚为碳源的生长环境表现出相对好的适应性,如图1 所示,生长初期(约12 h),突变株N2ubiX - 的生长明显比其他菌株快,其OD550 nm 值平均可高出0. 08 ~ 0. 25。这说明ubiX 基因可能对菌株生长有抑制作用。同时从图1 也可看出,浓度在400 mg·L - 1 以下,苯酚毒性对N2 菌及其突变株的生长不产生明显的抑制作用。而在浓度达到800 mg·L - 1 及其以上,尤其是浓度超过1 000 mg·L - 1 时,苯酚的毒性对4 菌株的生长均产生了明显的影响作用。相比之下,野生菌对高浓度苯酚的毒性适应能力更大,因此,N2 菌株中ubiX 和ubiD 基因在该菌体细胞适应苯酚毒性时,具有重要作用。从4 个苯酚浓度的生长结果看,当苯酚浓度在100 mg·L - 1 时,碳源浓度较低,细胞生长量较小,而800 mg·L - 1 以上苯酚浓度,毒性较大,4 株菌生长受到抑制,为了充分研究N2 菌株中ubiX 和ubiD 基因的作用,下面选择400 mg·L - 1 苯酚浓度的降解体系。
图2 为4 菌株对苯酚的降解率。由图2 可知,野生菌对苯酚的去除率普遍高于3 株突变菌,说明ubiX和ubiD 基因在N2 菌降解苯酚中起一定的作用。对单突变菌株,在46 h 时2 株单突变菌的苯酚降解率之和等于野生菌在此时段对苯酚的降解率,而在后期,单突变菌对苯酚的降解率升高,说明菌株对苯酚体系存在较长时间的生长延缓期,之后就会迅速生长并降解苯酚。就双突变菌株来讲,苯酚浓度400 mg·L - 1时其对苯酚存在一定的去除率,说明虽然ubiX 和ubiD 基因在N2 菌降解苯酚中起一定的作用,但N2 菌中还存在其他影响苯酚降解的基因。

2. 2 ubiX 和ubiD 基因对N2 菌中开环裂解酶活性的影响作用
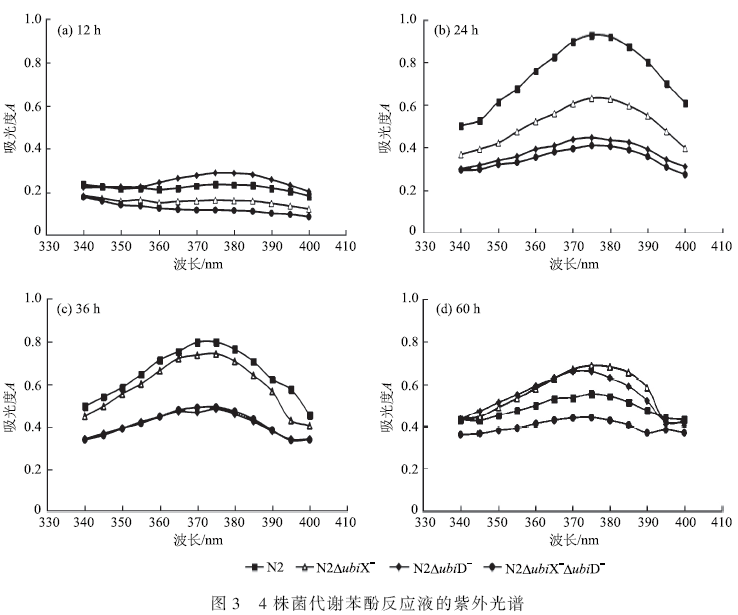
按照1. 2. 2 中的实验方法和1. 3. 3 中的分析方法,研究与2. 1 中实验平行培养的苯酚浓度为400mg·L - 1 反应体系中2-HMS 的生成、积累及其进一步代谢的特性。结果如图3 所示,(a)、(b)、(c)、(d)分别为生长时间为12、24、36 和60 h 时所取样,340 ~ 410 nm 范围的吸收峰为邻苯二酚间位开环裂解产物2-HMS 在375 nm 处的特征吸收峰。
由图3 可知,4 株菌生长至12 h 时,降解液在375 nm 处的吸收峰很小,即邻苯二酚间位开环裂解产物2-HMS 的积累量很少。而当生长至24 h 时,降解液在375 nm 处吸收峰的峰值达到最大,即转化产物2-HMS 的积累量达至最大值。由图3(c)和图3(d)可知,与24 h 相比,生长至36 h 和60 h 时,375 nm 处的吸收峰峰高降低,说明前期积累的2-HMS 被进一步分解为其他中间物质。按照文献报道,2-HMS 最终可转化为乙酸、丙酮酸等三羧酸循环的中间产物。生长至24 h 时,N2 菌株的2-HMS 积累量最大,含量用吸光度A 表示为0. 928,而3 株突变菌中,最易间位开环裂解的为突变N2ubiX - ,其吸光度A 可达到0. 632,而N2ubiD - 菌与N2ubiX - ubiD - 菌在375 nm 处的吸光度A 相近,分别为0. 447 和0. 41;因此可以推测ubiX 基因不利于苯酚间位裂解。
邻苯二酚裂解酶有2 种:其一是邻苯二酚1,2-双加氧酶(C12O),其催化作用使邻苯二酚从邻位开环裂解,生成顺,顺-己二烯二酸;其二是邻苯二酚2,3-双加氧酶(C23O),其催化作用则是邻苯二酚从间位开环裂解,生成2-HMS。
根据上述的分析结果,选择生长至24 h 时的降解液,按照1. 2. 4 中的实验方法、1. 3. 4 和1. 3. 5 中的分析方法,研究4 株菌对邻苯二酚C12O 和邻苯二酚C23O 的影响作用。
表1 为4 株菌降解苯酚过程中邻苯二酚邻/ 间位开环裂解时C12O 和C23O 酶在反应10 min 时的比活力。该结果说明,4 株菌在以苯酚为唯一碳源时,均能诱导产生C12O 和C23O。由表1 可知,反应时间为10 min 时,能诱导产生的C23O 酶活性最大的为N2 菌株,蛋白酶活可达0. 045 8 μmol·(mg·min) - 1 ,而突变株中酶活最大的为N2ubiX - 菌。而对于C12O,N2ubiX - ubiD - 的活性最大,分别为N2、N2ubiX - 和N2ubiD - 的1. 43、1. 28 和1. 67 倍。即可以认为影响邻苯二酚间位开环裂解的主要基因为ubiD,而影响邻位开环裂解的基因为ubiX。
2. 3 最佳苯酚浓度下4 株菌降解苯酚产物的差异性
按照1. 2. 5 中的方法提取4 株菌降解苯酚的中间产物,用1. 3. 6 中的GC-MS 分析方法对代谢产物进行分离,得到N2、N2ubiX - 、N2ubiD - 与N2ubiX - ubiD - 菌株以苯酚生长24 h 中间产物GC-MS 图。结果表明,4 株菌中降解苯酚得到的转化产物有较大的差别。其中野生菌株N2 代谢苯酚可检出12 种中间产物。
相同条件下,突变株N2ubiX - 代谢苯酚也可检出12 种中间产物,但含量明显低于野生菌降解苯酚的中间产物含量。而N2ubiD - 和N2ubiX - ubiD - 代谢苯酚时只能检出6 种中间产物,积累的中间产物种类较少。
通过质谱图解析,将4 株菌均可产生的羧化和羟化途径的3 种代表性产物的色谱保留时间、质谱碎片以及名称等总结于表2 中。

表1 10 min 内邻苯二酚邻/ 间位裂解酶比活力

表2 4 株菌代谢苯酚的中间产物的色谱性质


作为苯酚邻/ 间位开环裂解产物,顺,顺-己二烯二酸和2-HMS 的质谱图如图4、图5 所示。
由图4 可知,此物质的主要碎片离子峰主要有271,243,227,213,196,181,169,153,147,140,128,107,95,79,73,52,45,m / z = 271 为M + - 15(—CH3 ),m / z = 243 为M + - 45(—CH3 )3 + 2(H),m / z = 227为M + - 60(—CH3 )4 + 1(H),m / z = 213 为M + - 73[—Si(CH3 )3 ],m / z = 196 为M + - 89[—OSi(CH3 )3 ]- 1(H),m / z = 181 为M + - 89[—OSi(CH3 )3 ] - 15(—CH3 ) - 1(H),m / z = 169 为M + - 117[—COOSi(CH3 )3 ],m / z = 153 为M + - 117[—COOSi(CH3 )3 ] - 15(—CH3 ) - 1(H),m / z = 147 为[—Si(CH3 )3 ]2 ,m / z = 140 为M + - 146 [—Si(CH3 )3 ]2 ,m / z = 128 为M + - 117 [—COOSi(CH3 )3 ] - 26 ( CH ????CH) -15(—CH3 ),m / z = 107 为M + - 178[—OSi(CH3 )3 ] - 1(H),m / z = 95 为M + - 117[—COOSi(CH3 )3 ] -73[—Si(CH3 )3 ] - 1(H),m / z = 79 为M + - 117[—COOSi(CH3 )3 ] - 89[—OSi(CH3 )3 ] - 1(H),m / z = 73为—Si(CH3 )3 ],m / z = 52 为CH ????CHCH ????CH,m / z = 45 为(CH3 )3 ,综上可以推测出此物质为顺,顺-己二烯二酸。
由图5 可知,该物质的分子离子峰M + m / z = 286,主要的碎片离子峰有m / z = 271,257,243,197,187,169,157,147,128, 79, 75, 73, 55, 45。M + - 15 [ CH3 ] = 271, 说明断下了[ CH3 ] 碎片。M + - 117[—COOSi(CH3 )3 ] = 169,说明存在被衍生的羧基。而147 的存在说明被衍生2 次,即该结构中含有2 个羧基或1 个羧基和1 个羟基。M + - 257 = 29(CHO),M + - 68(OHCCH=CHCH) - 15[CH3 ] + 1[H] =204,M + - 68(OHCCH =CHCH) - 117[—COOSi(CH3 )3 ] = 89[O—Si(CH3 )3 ]。综上可以推测出此物质为2-HMS。具体参见污水宝商城资料或http://www.dowater.com更多相关技术文档。
3 结论
1)施氏假单胞菌N2 以唯一碳源苯酚生长时,就生长特性来看,ubiD 基因作用大于ubiX 基因。从菌株对苯酚的降解率上看,野生菌对苯酚的降解效率均高于突变株,说明ubiD 和ubiX 等羧基裂解酶基因在苯酚降解过程中发挥重要作用。
2)施氏假单胞菌N2 以苯酚为唯一碳源生长时,降解反应期间,基因ubiD 主导的是邻苯二酚间位开环,而基因ubiX 主导的是邻苯二酚邻位开环。
3)从质谱结果分析,野生菌和突变菌以苯酚为碳源生长时,均能通过羟化和羧化开环裂解途径将苯酚转化成中间产物:顺,顺-己二烯二酸和2-HMS。其中,单突变株N2ubiX - 降解苯酚过程中生成的中间产物与野生菌相比,种类相等,但各中间产物含量明显低于野生菌,而单突变株N2ubiD - 和双突变菌株N2ubiX - ubiD - 代谢苯酚的中间产物的含量及种类都明显低于野生菌。


