城市垃圾焚烧发电厂垃圾渗滤液具有色度高, 悬浮物含量高, COD值常高达15 000~20 000 mg·L-1, BOD5/COD在0.3~0.5之间, 可生化性好, 氨氮浓度可达1 500~2 000 mg·L-1等特点.目前其常用的处理方法为“生物法+膜过滤”.生物法是比较经济易行的处理垃圾渗滤液的方法, 其利用活性污泥中的大量微生物可有效去除垃圾渗滤液中的有机物, 氨氮和重金属.但目前影响该工艺运行的一个主要问题是活性污泥造成的膜堵塞. Ishizaki等在MBR处理城市污水中发现了一些易导致膜污染的细菌菌属, 它们的主要共同特征是会形成凸状菌落, 拥有肿胀矮胖的形状和平滑光泽的表面, 结合有大量水分子、亲水有机物质和碳水化合物.张崇淼等发现属于真菌的青霉菌属(Penicillium)、毛孢子菌属(Trichosporon)等是导致城市污水厂污泥膨胀的主要微生物.吕文洲等也从处理含油废水的膨胀污泥中分离得到真菌白地霉.以上均说明微生物种群结构会影响污泥过滤性能.如果MBR系统中丝状真菌过度繁殖时(即发生污泥膨胀), 在膜表面会形成致密无孔的泥饼层且污泥层较厚, 加剧膜污染.而李艳娜等指出之所以会发生丝状菌污泥膨胀是因为活性污泥微生态系统平衡失调, 微生物种群结构发生变化, 丝状菌种群大量生长成为优势种.
为了维持活性污泥的生态稳定, 研究处理垃圾渗滤液的活性污泥系统中的微生物组成, 抑制该条件下丝状菌属的大量繁殖, 对控制膜污染有重要作用.其中诱导丝状菌大量生长的原因有多样, 比如营养物质的缺乏, 溶解氧过低, pH值偏低.但太阳光照对丝状菌的影响却很少有人研究.基于目前一些垃圾渗滤液处理厂考虑进行好氧池加盖的现状, 研究太阳光照对微生物种群的影响很有必要.
高通量测序技术以一次能并行对几十万至几百万条DNA分子进行测序和一般读长较短等为标志, 具有高准确性, 高通量, 高灵敏度和低运行成本等突出优势, 能够对样品中所含微生物进行全面检测, 在海量数据的基础上对微生物组成的种类和相对丰度进行分析, 在环境微生物鉴定领域的应用越来越广泛.
因此本研究采用两组SBR反应器(SBR1和SBR2)进行试验, SBR1置于太阳光照下, SBR2置于室内黑暗处, 两者进水水量和水质均相同, 工艺运行参数和曝气方式也相同.定期监测两反应器内污泥的比阻值, 同时利用高通量测序技术, 对两反应器内的细菌和真菌群落组成进行分析, 从微生态的角度探讨太阳光照对活性污泥的过滤性能的影响, 以期为活性污泥法在垃圾渗滤液处理上的应用提供理论帮助.
1 材料与方法
1.1 试验装置
试验用SBR材质均为有机玻璃, 可透光, 两反应器中污泥混合液容积均为30 L. SBR1和SBR2采用相同的运行方式、进水量和进水水质, 初期污泥浓度也相同. SBR1和SBR2的运行工艺参数如下:每天曝气20 h, 静沉3.5 h, 排水和进水0.5 h.运行期间反应器内污泥混合液溶解氧浓度为4.5~5.6 mg·L-1, pH值为7.6~8.6, 水温为20~25℃(随环境温度而变), 污泥有机负荷(以COD/MLSS计)为0.12~0.24 g·(g·d)-1.
但SBR1放置在窗户边, 太阳光照充足, SBR2放置在室内角落, 几乎无太阳光照.
1.2 接种污泥和试验用水
接种污泥取自漳州市开发区生活污水处理厂好氧池, 试验用水为垃圾渗滤液原液, 取自漳州市浦江岭生活垃圾焚烧发电场的渗滤液调节池.试验期间垃圾渗滤液原液的COD值为30 618~36 456 mg·L-1, NH4+-N为947~1 868 mg·L-1, pH为7.0~7.5, 水温为18~23℃.
试验方案为:相同量的接种污泥投加至两反应器中, 第1~2 d进行闷曝, 即每天曝气20 h, 静沉后排除上清液, 加自来水到原水位(维持总容积为30 L).第3 d开始, 每天曝气20 h, 静沉后排除上清液, 加1:10(渗滤液原液体积:自来水体积)稀释后的垃圾渗滤液到原水位.第10 d开始, 每天曝气20 h, 静沉后排除上清液, 加2:9稀释后的垃圾渗滤液到原水位.试验期间, 每周测两次污泥比阻值.
1.3 分析方法
常规分析项目(COD和NH4+-N)采用国家标准方法测定. pH、DO采用WTW Multi 3400(WTW Laborprodukte, GER)便携分析仪测定; 污泥比阻采用污泥比阻装置(PJK02, 上海江科)进行测定.
1.4 DNA抽提和PCR扩增
取SBR1和SBR2运行至第50 d时活性污泥样品(此时两反应器内污泥已呈现出了较大差别, SBR1出现轮虫, SBR2发生了污泥膨胀), 经过真空冻干后碾碎提取DNA, DNA的提取采用FastDNA® SPIN Kit for Soil(Qiagen, CA, USA)试剂盒.用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对细菌16S rRNA V3, V4区进行PCR扩增, 扩增程序为:95℃预变性3 min, 27个循环(95℃变性30 s, 55℃退火30 s, 72℃延伸30 s), 最后72℃延伸10 min.用ITS1F(5′-CTTGGTCATTTAGA GGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCA TCGATGC-3′)引物对真菌ITS区进行PCR扩增, 扩增程序为:95℃预变性3 min, 35个循环(95℃变性30 s, 55℃退火30 s, 72℃延伸30 s), 最后72℃延伸10 min. PCR仪为GeneAmp® 9700型(美国ABI公司), 扩增体系为20 μL:4 μL 5×FastPfu缓冲液, 2 μL 2.5 mmol·L-1 dNTPs, 0.8 μL引物(5μmol·L-1), 0.4 μL FastPfu聚合酶; 10 ng DNA模板.
1.5 Illumina MiSeq测序和数据处理
使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA)进行纯化, Tris-HCl洗脱, 2%琼脂糖电泳检测.利用QuantiFluorTM-ST (Promega, USA)进行检测定量.根据Illumina MiSeq平台(Illumina, San Diego, USA)标准操作规程将纯化后的扩增片段构建PE 2×300的文库.
利用Illumina公司的MiSeq PE300平台(上海美吉生物医药科技有限公司)进行测序.使用UPARSE软件, 根据97%的相似度对序列进行OTU聚类; 使用UCHIME软件剔除嵌合体.利用RDP classifier 对每条序列进行物种分类注释, 比对16S细菌Silva数据库和ITS真菌Unite数据库, 设置比对阈值为70%.
2 结果与讨论 2.1 出水水质与污泥比阻
反应器运行期间SBR1和SBR2出水COD约在496~800 mg·L-1之间变化, COD去除率约为60%~78%. SBR1和SBR2出水NH4+-N均在10~20 mg·L-1之间波动, 氨氮去除率相接近且都维持在85%~95%.可见SBR1和SBR2对垃圾渗滤液中有机物和氨氮的去除效率相接近.
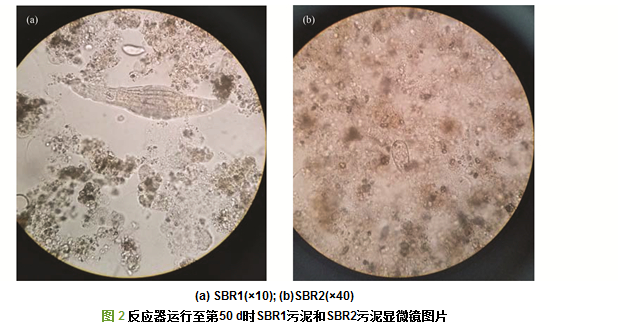
接种污泥的污泥比阻值为3.77×1012 m·kg-1. SBR1和SBR2的污泥比阻变化见图 1.污泥比阻越小说明污泥越易过滤.从图 1中可以看出, SBR1中污泥比阻随运行时间先升后降, 在第35 d时出现最大值.而SBR2中污泥比阻随运行时间一直在升高.对两反应器中的污泥进行镜检发现:SBR1在运行至第30~50 d时, 出现了大量轮虫, 污泥比阻在第35 d出现开始下降, 而SBR2在运行至第40 d时, 出现了大量丝状菌, 导致污泥比阻一直上升(见图 2).
2.2 SBR1和SBR2中细菌群落差异 2.2.1 细菌多样性差异
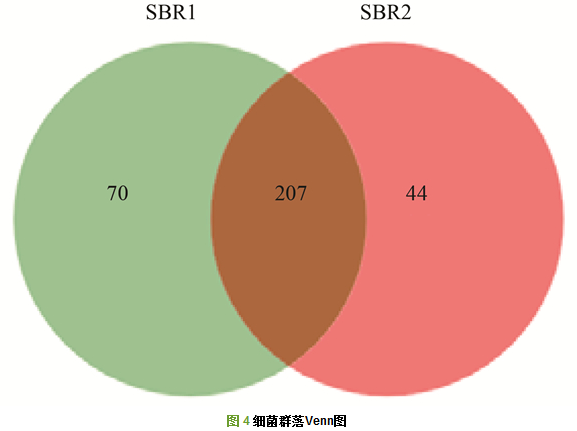
SBR1和SBR2进行细菌16S rRNA高通量测序, 共得到74 085条有效序列.在97%相似度下, SBR1和SBR2共得到321个OTUs.样品稀释性曲线如图 3所示, 两条曲线都趋于平坦, 表明测序结果涵盖了样品中绝大多数微生物信息. 图 4为Venn图, 从中可以看出, SBR1和SBR2共有的OTUs数为207, 占总OTUs的比例为64.48%, 表明两者的细菌群落组成存在较大的相似性. SBR1独有的OTUs占总数的21.81%, 略高于SBR2的13.71%.
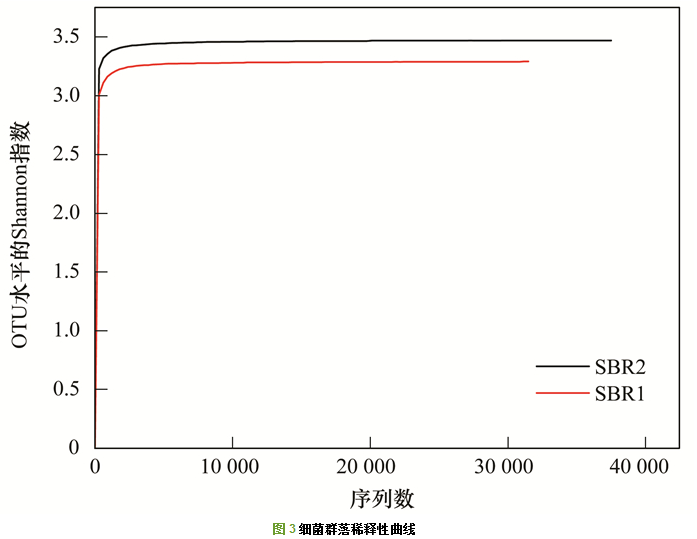
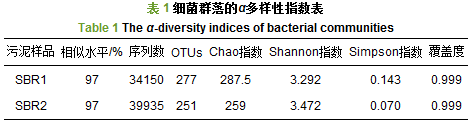
表 1为SBR1和SBR2的细菌群落α多样性指数. Chao指数与Shannon, Simpson指数可以反映出样品中微生物的丰富度与多样性. SBR1的Chao指数为287.5, 大于SBR2的259, 说明SBR1中细菌群落更加丰富. SBR1的Simpson指数为0.143, 大于SBR2的0.07, SBR1的Shannon指数为3.292, 小于SBR2的3.472, 说明SBR1中的细菌群落多样性较SBR2低.
2.2.2 细菌群落组成差异
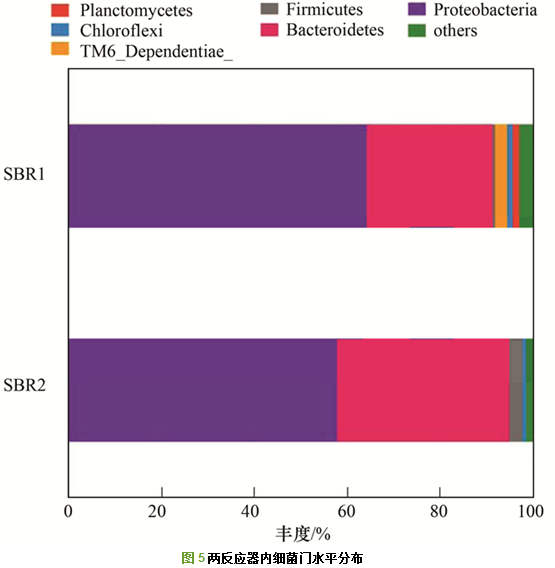
对样品OTUs代表序列进行物种注释, 并将样品的有效序列划分到不同的分类水平(从门到属).两反应器内污泥中相对丰度>1%的门如图 5所示, 其中变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为两反应器内的优势细菌门, 在SBR1中所占百分比为64.27%和27.21%, SBR2中为57.92%和37.16%.厚壁菌门(Firmicutes)在SBR2中的丰度为2.75%, 大于SBR1中的0.52%, 浮霉菌门(Planctomycetes)和TM6在SBR1中的丰度分别为1.33%和2.62%, 而SBR2中几乎没有.从门水平上看出, SBR1的优势门与SBR2大致相同, 在相对丰度上差异较小.
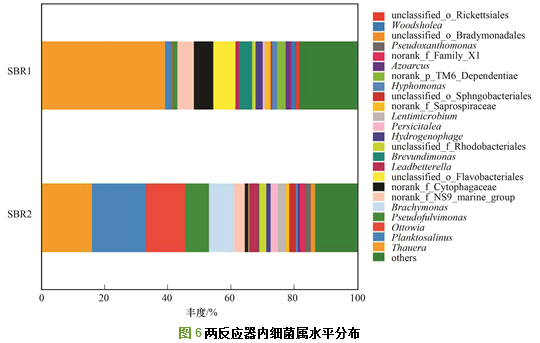
在属水平, 进一步筛选相对丰度大于1%的属(主要属)进行分析, 具体结果见图 6.
在SBR1中, 总共有15个主要属, 其总的相对丰度为80.07%.其中, β-变形菌门红环菌科(Rhodocyclaceae)Thauera菌属为最为优势的菌属, 相对丰度为39.35%, 其次为拟杆菌门黄杆菌目(Flavobacteriales)中未定义菌属, 相对丰度为6.91%;拟杆菌门噬纤维菌科(Cytophagaceae)未分类菌属, 相对丰度为6.14%;拟杆菌门黄杆菌目NS9_marine_group科菌属, 相对丰度为5.32%.在SBR2中, 总共有16个主要属, 其总的相对丰度为84.31%.其中, 拟杆菌门黄杆菌科(Flavobacteriaceae)Planktosalinus菌属为最为优势的菌属, 相对丰度为16.84%, 其次为Thauera菌属, 相对丰度为16.23%; β-变形菌门丛毛单胞菌科(Comamonadaceae)Ottowia和Brachymonas菌属, 相对丰度为12.55%和8.04%; γ-变形菌门黄单胞菌科Pseudofulvimonas菌属, 相对丰度为7.49%; NS9_marine_group科菌属, 相对丰度为3.49%.
主要菌属在两反应器内相对丰度相差较大, 比如Cytophagaceae未分类菌属在SBR1中较多, 而Planktosalinus、Ottowia、Brachymonas以及Pseudofulvimonas在SBR2中较多.从图 6中可以看出SBR1中Thauera菌属是第一大优势菌, 其他主要菌属丰度都相对较低.而SBR2中几大菌属丰度相当, 红环菌科Rhodocyclaceae的优势地位有被黄杆菌科Flavobacteriaceae和丛毛单胞菌科Comamonadaceae替代的趋势.
SBR1和SBR2均主要发生了有机物降解, 异养反硝化、自养反硝化和氨氧化过程.主要的功能菌属为属于β-变形菌门的Thauera、Ottowia和Brachymonas, 属于拟杆菌门的Planktosalinus和一些未定义菌属, 这与孙法迁和李卫华等的研究结果一致.其中Thauera是革兰氏阴性细菌, 大都为杆状且具有需氧反硝化能力.目前分离到的Thauera大约有60株,是一类广泛存在于各种类型的废水处理装置中并具有多种芳香族污染物降解能力和好氧反硝化能力的重要功能菌群.菌种Thauera sp. strain TN9可以同时去除猪场废水中的COD和氨氮, 不产生亚硝态氮和硝态氮的积累. Thauera也同样存在于处理垃圾渗滤液的同步硝化反硝化脱氮污泥中, 且为优势菌属.以上说明SBR1和SBR2中的功能菌属Thauera可能起到了异养硝化和好氧反硝化脱氮的作用.目前已报道的具有异养硝化和好氧反硝化功能的菌属有约10种. Thauera在SBR1中的丰度大于SBR2, 可能是因为SBR1由于太阳光照的影响具有更高的溶解氧, 使好氧反硝化菌占优势. 端正花等发现在某污水处理厂发生污泥膨胀的优势菌之一为黄杆菌科(Flavobacterium), 而SBR2中Flavobacterium也为优势菌科, 这说明SBR2出现了污泥膨胀.
SBR2中主要菌属Ottowia目前已分离出3个种:Ottowia thiooxydans 是从活性污泥系统中分离出的兼性厌氧菌, 可以进行反硝化作用产生N2O; Ottowia pentelensis是从焦化废水活性污泥系统中分离出的可形成絮状的细菌; Ottowia beijingensis AN3T也是从焦化废水活性污泥系统中分离出的可降解酚类的好氧菌, 无鞭毛, 不运动. SBR2中主要菌属Brachymonas具有亚硝酸盐还原酶基因(nirS), 可以进行反硝化作用, 说明SBR2中同时出现了NO2-. SBR2中主要菌属Pseudofulvimonas也可能具有异养硝化和好氧反硝化功能.同时李卫华对填埋场垃圾稳定化序批式生物反应器后期的主要脱氮功能微生物多样性进行分析发现氨氧化细菌存在高度多样性, 大部分为未知类群, 且均为不可培养菌或未经分离获得的细菌.目前也已发现很多异养微生物可以进行硝化作用.因此可能还有很多发生硝化作用的菌属未被此次测序分析出来.但是反硝化功能菌Thauera、Ottowia和Brachymonas的大量存在, 可以从微生物角度说明SBR1和SBR2有较高的脱氮效率.
Cytophagaceae可分解藻类纤维素, 而SBR1中由于太阳光照的影响, 应该出现了藻类, 使其丰度较高.
采用卡方检验对两个样本间的物种的丰度差异进行比较, 见图 7, 其中Pvalue值越接近0, 物种丰度差异显著性越大.
2.3 SBR1和SBR2中真菌群落差异 2.3.1 真菌多样性差异
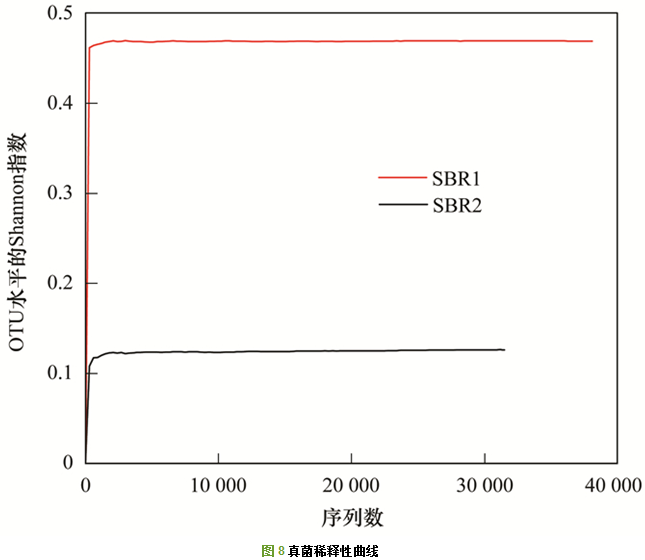
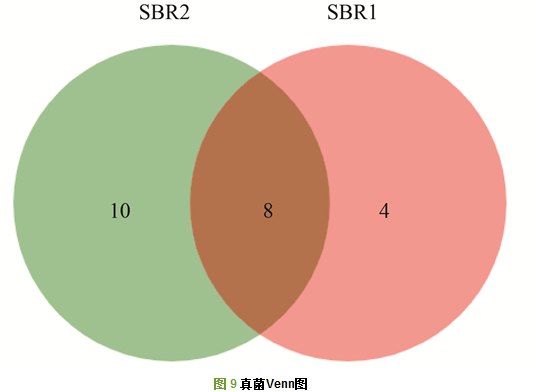
SBR1和SBR2进行真菌ITS区高通量测序, 共得到73 951条有效序列.在97%相似度下, SBR1和SBR2共得到22个OTUs.样品稀释性曲线如图 8所示, 两条曲线都趋于平坦, 表明测序结果能够覆盖样品中绝大多数微生物信息. 图 9为Venn图, 从中可以看出, SBR1和SBR2共有的OTUs数为8, 占总OTUs的比例为36.36%, SBR2独有的OTUs占总数的45.45%, 远大于SBR1的18.18%, 表明两者的真菌群落结构存在较大的差异性.
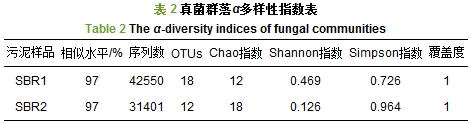
表 2为SBR1和SBR2中真菌群落α多样性指数表. SBR2的Chao指数为18, 大于SBR1的12, 说明SBR2中真菌群落更加丰富. SBR2的Simpson指数为0.964, 大于SBR1的0.726, SBR2的Shannon指数为0.126, 小于SBR1的0.469, 说明SBR2中的真菌群落多样性较SBR1低.
2.3.2 真菌群落组成差异
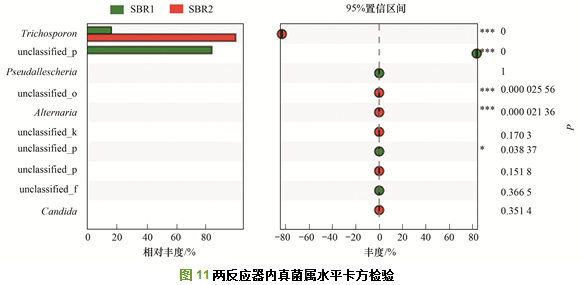
两反应器内相对丰度>1%的真菌门如图 10(a)所示, SBR1中Rozellomycota为第一优势菌门, 相对丰度为83.71%, 担子菌门(Basidiomycota)为第二优势菌门, 相对丰度为16.24%;而SBR2中Basidiomycota为唯一优势菌门, 相对丰度为99.84%.从门水平上看出, SBR1的优势门与SBR2大不相同, 且同一优势门在相对丰度上差异较大.
真菌在属水平上的相对丰度见图 10(b), SBR1中的第一优势属为Rozellomycota下未定义属, 其相对丰度为83.71%, 其次为Basidiomycota菌门下Trichosporon菌属, 其相对丰度为16.22%.在SBR2中, Basidiomycota菌门的Trichosporon是唯一优势属, 其相对丰度为99.78%.可见, SBR2中的优势菌属单一, 且相对丰度与SBR1中的差异较大. Trichosporon是一种产油脂微生物, 能够将碳水化合物与普通的油脂转化为微生物油脂储存在体内, 其大量存在会使得污泥过滤性能变差, 污泥黏性增加.张崇淼等也发现Trichosporon是导致城市污水厂污泥膨胀的主要微生物.在培养条件下, 可观察到Trichosporon形成了不规则的丝状菌体.而Trichosporon在SBR2中成为唯一优势真菌, 可能是因为SBR2中的环境有利于其生长.
真菌菌属卡方检验分析结果见图 11.
2.4 污泥比阻与微生物种群的关系
SBR1中污泥比阻由于轮虫的出现而下降, SBR2中污泥比阻由于活性污泥的丝状膨胀而一直上升, 且远远大于SBR1中的.高通量测序结果表明, 两反应器内细菌群落组成差异较小(共有OTUs占总OTUs的比例高达64.48%), 真菌群落组成差异较大(共有OTUs占总OTUs的比例为36.36%), 说明反应器内污泥过滤性能的差异应该主要是由真菌种群差异引起的.
SBR1由于有太阳光照射, 活性污泥生态系统微生物种群丰富, 原生和后生动物(轮虫)与菌胶团共存, 微生物结构合理.真菌群落多样性较SBR2高, 真菌中的Rozellomycota成长为优势菌门, 没有出现活性污泥丝状膨胀.后生动物(轮虫)的出现改善了污泥的过滤性能, 使污泥比阻下降.据李艳娜等[7]和梁少博等的研究, 轮虫等后生动物可捕食分散絮状污泥和丝状菌, 从而提高污泥沉降性能和过滤性能.因此SBR1中轮虫的出现应该是其污泥比阻下降的主要原因.
而SBR2没有太阳光照射, 真菌群落丰度较SBR1高, 但菌属结构单一, Basidiomycota菌门的Trichosporon成长为唯一优势属, 相对丰度为99.78%, 说明SBR2中的活性污泥膨胀很可能是由Trichosporon菌属大量生长引起的. SBR2中微生物代谢产物的积累和微生物种群结构单一, 打破了原活性污泥微生态系统的平衡, 可能造成了Trichosporon菌属的大量生长.
两反应器的进水条件和运行参数都保持相同, 实际运行时SBR1的DO值(5.63)略高于SBR2(5.04), 混合液的pH值SBR1为8.45, SBR2为8.63, 都呈中性.关于混合液的水温, SBR1因为有太阳光照, 白天温度比SBR2高1~2℃, 但都维持在20~25℃之间, 因此两反应器内的微生物种群的差异应该是由太阳光照引起的.太阳光照使活性污泥系统中微生物种群丰富, 利于后生动物的出现, 从而抑制真菌Trichosporon的大量生长, 维持微生物生态系统的平衡和稳定.
3 结论
(1) SBR1由于有太阳光照射, 细菌群落丰度较SBR2高, 第一主要菌属为β-变形菌门的Thauera属, 相对丰度为39.35%, 是去除有机物和脱氮的主要功能菌; 真菌群落多样性较SBR2高, Rozellomycota成长为优势真菌菌门, 相对丰度为83.71%.污泥比阻随运行时间先升后降, 大量轮虫的出现使污泥比阻开始下降.
(2) SBR2由于没有太阳光照射, 细菌群落丰度较SBR1低, 但多样性较SBR1高, Thauera也同样存在于SBR2中, 且是第二优势菌属, 相对丰度为16.23%;拟杆菌门下的Planktosalinus为第一优势菌属, 相对丰度为16.84%, 其存在预示活性污泥出现膨胀; β-变形菌门Ottowia和Brachymonas菌属是去除有机物和脱氮的主要功能菌, 相对丰度分别为12.55%和8.04%. SBR2真菌群落丰富, 但菌属结构单一, Basidiomycota下的Trichosporon成长为唯一优势真菌菌属, 相对丰度为99.84%, 说明SBR2中的污泥膨胀跟Trichosporon大量生长有关.具体联系污水宝或参见http://www.dowater.com更多相关技术文档。
(3) 在低负荷SBR中, 太阳光照有利于维持微生物生态系统的平衡和稳定, 抑制活性污泥出现膨胀.