N2O是强温室气体,同时也是可再生能源,当其替代O2与甲烷燃烧时可以提高热值,还可以用于医学、工业以及半导体行业等。由于污水处理过程是N2O释放的重要人为来源,因此生物脱氮过程中N2O的富集成为研究热点之一。食品加工、制造及酿酒等行业会产生大量酸性有机含氮废水,在反硝化脱氮之前,常需加碱进行预处理,这会增加系统的复杂性与运行费用。研究酸性条件下反硝化的性能,可为此类废水的直接处理提供依据。已有研究表明,酸性条件和游离亚硝酸(FNA)浓度是影响反硝化过程中N2O产率的重要因素。Thörn等研究发现,在酸性条件下,40%以上的NOx-会以N2O的形式积累。Pan等研究恒定pH对反硝化的影响时发现,当pH为6.0时,N2O的释放率高达40%。有学者推测酸性条件下产生的FNA通过抑制N2O还原酶的活性增加N2O的释放。由于FNA是酸性条件下NO2-质子化的结果,真正的抑制剂仍需进一步明确。
NO2-型反硝化是顺序反应的过程,依次由亚硝酸盐还原酶(NIR)、NO还原酶(NOR)和N2O还原酶(NOS)将NO2-还原为NO、N2O和N2。作为中间产物,N2O的净产率同时受其产生和还原的影响,研究酸性条件下N2O的还原特性可为其富集机理提供依据。由于N2O是溶解性气体,传统测定方法存在困难,而微电极可连续测定其浓度的变化,这就为其检测提供了有效手段。
笔者以NO2-型反硝化活性污泥为研究对象,分析了SBR系统在酸性进水条件下的反硝化运行特征和N2O释放行为,并探讨了影响N2O还原速率的因素,旨在揭示酸性条件下N2O积累的机理,并为生物反硝化过程中N2O的富集回收提供依据。
1、材料与方法
1.1 试验装置
连续试验采用SBR装置,其有效容积为0.6L,排水比为0.33。每天运行4个周期,单周期为6h,即进水5min、搅拌240min、沉淀60min、排水5min、闲置50min。采用磁力搅拌方式,在室温条件下运行,水温为20~25℃。
批式试验反应器的有效容积为0.6L,使用N2进行吹脱(氮气流速为0.2L/min)以实现泥水完全混合,并将产生的N2O吹脱出来。
1.2 污泥来源和试验用水
试验所用污泥为课题组前期驯化完成的NO2-型反硝化污泥,其整体为黄褐色絮体,MLVSS/MLSS约为0.8,采用酸性废水进行驯化,进入反应器污泥的初始pH为5.5,反应器中污泥浓度约为4000mg/L,每天排混合液,控制泥龄约为15d。
采用人工配制试验用水,其由乙酸钠、亚硝酸钠和微量元素组成,微量元素按文献配制,投加量为1mL/L。运行阶段NO2--N浓度控制在100~120mg/L,保持C/N为3。
1.3 试验方案
连续运行及典型周期试验:SBR正常运行过程中,连续监测进出水COD、NO2-的浓度及N2O释放量。定期分析典型周期碳、氮转化及N2O释放特性。
酸性pH及FNA对N2O释放的影响:取0.2LSBR中的污泥,洗泥3次后置于批式反应系统中,采用人工配水进行试验,反应时间为4h,反应温度控制在22℃。每10min采集一次气体测定N2O浓度,每30min采集一次液体测定NO2-和COD浓度,试验结束后测定MLSS和MLVSS浓度。pH影响试验中,初始NO2--N浓度为80mg/L,以0.2mol/L的HCl或NaOH保持系统内pH恒定,分别在pH为5.0、5.5、5.8、6.0、6.5、7.0的条件下进行试验,pH的变化幅度不超过±0.1。FNA影响试验中,控制反应中pH恒定为5.8,通过添加不同浓度的NO2(-10、30、40、50、70、90mg/L)使FNA的初始浓度分别为0.16、0.44、0.68、0.84、1.16、1.54mg/L。
酸性pH及FNA对N2O还原速率的影响:通入N2O标准气体配制饱和溶液,稀释65倍,配制初始浓度为10μmol/L的水溶液(a溶液)备用。a溶液在不同pH(5.5~7.0)条件下以N2O为基质进行批式试验。a溶液中加入少量亚硝酸盐制成b溶液,在不同pH(5.5~7.0)条件下形成不同FNA浓度进行批式试验。反应时间为15min,通过水浴加热控制温度为(20±1)℃。用N2O微电极测定N2O浓度,试验结束后测定MLSS和MLVSS,并计算还原速率。
1.4 分析项目及方法
COD采用重铬酸钾法测定;亚硝酸盐采用N-(1-萘基)-乙二胺光度法测定;硝酸盐采用紫外分光光度法测定;MLSS、MLVSS采用重量法测定;溶解性N2O利用微电极测定,测定前进行校准。
N2O气体的采集:批式试验产生的N2O气体用氮气进行吹脱,使用50mL注射器在反应器上部集气区采集气体样品,用气相色谱仪进行测定。气体分析与计算:利用PE600气相色谱仪对样品中的N2O浓度进行分析。N2O的释放速率和释放量参考Kong等、Kimochi等的方法进行计算。
2、结果与讨论
2.1 酸性进水条件下NO2-型反硝化的运行特性
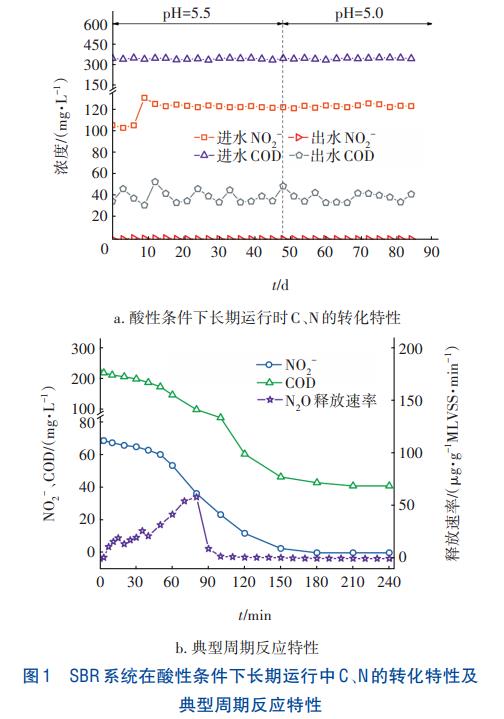
课题组前期驯化得到适应酸性条件(pH=5.5)的NO2-型反硝化活性污泥,接种后再次降低进水pH至5.0并使其稳定,研究酸性条件下NO2-型反硝化的运行特性,并在80d时分析了SBR反应器典型周期内C、N转化及N2O释放特性,结果如图1所示。由图1(a)可以看出,NO2-型反硝化在酸性条件下运行稳定。当初始pH为5.0时,出水NO2--N浓度为0~0.8mg/L,其去除率大于99%;出水COD为33~51mg/L,其去除率为86.1%~90.9%。经计算,去除的C/N在1.98~2.60之间。由图1(b)可以看出,随着反应的进行,NO2-和COD均随时间的增加呈降低趋势。经计算,NO2-的还原速率为10.88mg/(gMLVSS·h),消耗的C/N为2.28。N2O的释放主要发生在前90min,最大释放速率为58.27μg/(gMLVSS·min),有7.17%的NO2-转化为N2O,释放速率随时间呈先升后降的趋势。
2.2 pH对NO2-型反硝化及N2O转化特性的影响
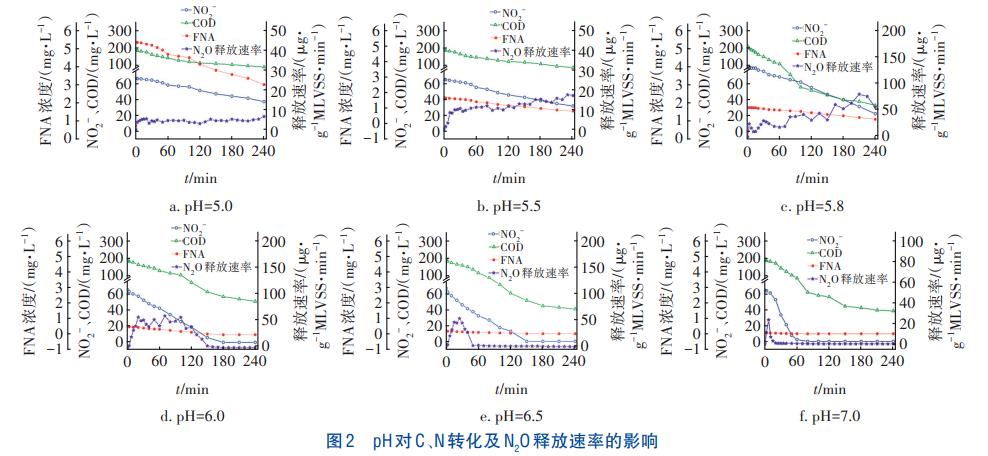
pH对C、N转化及N2O释放速率的影响如图2所示。可以看出,在不同pH条件下,NO2-和COD浓度均随时间的增加呈下降趋势,但反硝化速率不同。当pH为7.0时,60min内完成了NO2-的还原,但N2O的释放主要发生在前30min。随着pH由5.8降至5.0,出水NO2-浓度呈升高趋势。当pH为5.0时,NO2-去除率仅为43.3%。不同pH条件下,N2O释放呈现不同的特点。当pH分别为7.0、6.5时,N2O的释放速率随时间呈先升高后降低的趋势,且主要发生在反应前期,分别在第10、25分钟达到释放速率峰值。当pH为6.0时,N2O释放速率呈先升后降的趋势,在20~100min保持较高的释放速率并出现了4个较明显的释放速率峰值。当pH≤5.8时,N2O释放速率随时间增加呈先上升后趋于稳定的趋势。
不同pH条件下N2O的释放特性见图3。
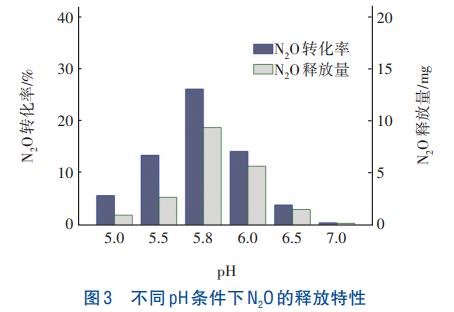
从图3可知,酸性条件对NO2-还原速率及N2O释放量与转化率的影响显著。经计算,随着pH的降低,NO2-还原速率明显下降,pH为7.0时NO2-还原速率是pH为6.5的2.3倍。当pH降至5.0时,还原速率仅为7.0时的11.67%,表明酸性环境对反硝化具有抑制作用。由图3可知,随着pH的降低,N2O转化率和释放量均呈先升高后降低的趋势,N2O转化率在pH为5.8时达到最大,为26.26%;当pH降至5.0时,N2O转化率降至5.78%。呈现这种规律的原因可能是,以NO2-为电子受体时,较低的pH对系统中NIR、NOR、NOS的活性产生了不同程度的影响。
彭永臻等的研究表明,pH对于以NO2-为电子受体的反硝化过程影响显著,除pH本身外,产生的FNA也会影响C、N的转化特性。由图3还可以发现,当pH由7.0降至5.0时,NO2-还原速率大幅降低,表明在酸性条件下NIR活性受到抑制,且pH越低抑制程度越严重。同时,酸性条件下NO2-的积累产生了较高浓度的FNA,然而N2O的释放量和转化率并未随着pH的降低呈单向升高的趋势,因此pH低于5.8时,很可能是pH及FNA对NOR的抑制更严重,导致N2O净产量下降。有研究报道,在以NO2-为电子受体时,FNA是N2O还原酶的主要抑制剂。因此,分析相同pH、不同FNA浓度条件下NO2-还原及N2O释放特征有助于探明FNA对NO2-型反硝化的影响。
2.3 FNA对NO2-型反硝化及N2O转化特性的影响
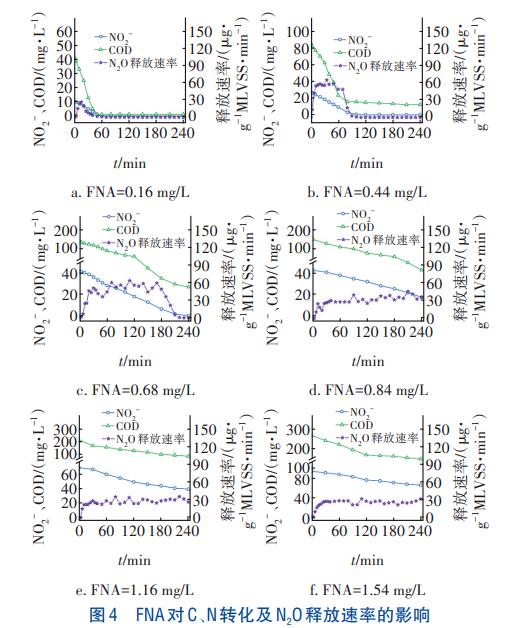
FNA对C、N转化及N2O释放速率的影响如图4所示。可知,随着FNA浓度的升高,COD和NO2-浓度均随反应时间呈下降趋势,但NO2-还原速率呈先升后降的趋势,由4.03mg/(gMLVSS·h)(FNA浓度为0.16mg/L)升至5.34mg/(gMLVSS·h)(FNA浓度为0.44mg/L),然后逐渐降至2.30mg/(gMLVSS·h)(FNA浓度为1.54mg/L)。此外,不同FNA浓度下的N2O释放速率不同。低FNA浓度(0.16~0.68mg/L)时,N2O释放速率随时间的增加整体呈先升高后降低的趋势,且N2O的释放时间随FNA的升高而增加。高FNA浓度(0.84~1.54mg/L)时,N2O释放速率在整个反应过程中均维持较高水平。经计算,N2O转化率随FNA的升高呈先升后降的趋势,当FNA=0.84mg/L时,达到最大值42.56%。
FNA是NO2-质子化的结果,改变pH或NO2-浓度均影响FNA浓度。将两种条件下(酸性pH和NO2-浓度的变化)的FNA浓度与NO2-还原速率和N2O转化率进行了线性拟合,结果如图5所示。可知,FNA浓度在特定区间内与NO2-还原速率具有线性负相关关系,与N2O转化率具有线性正相关关系,但是进一步升高FNA浓度则降低了N2O产率。由图5(a)可知,pH改变时FNA浓度在0.169~1.641mg/L区间与NO2-还原速率具有线性负相关关系,相关系数为0.9833。当初始FNA浓度为0.052、5.26mg/L时,NO2-的还原速率分别为25.28、2.95mg/(gMLVSS·h),表明FNA浓度低于一定水平,即pH较高时,其对NO2-还原速率的抑制作用微弱;当FNA浓度高出某一阈值,即pH较低时,其对NO2-还原速率的抑制作用增长不明显。当FNA浓度处于0.052~1.031mg/L区间时,N2O转化率与FNA浓度具有线性正相关关系,相关系数为0.9977,N2O转化率在FNA为1.03mg/L时达到最大值26.26%;当FNA浓度继续增至1.64、5.26mg/L(即pH分别为5.5和5.0)时,N2O转化率降至13.54%、5.78%,表明过低的pH不利于N2O的富集。
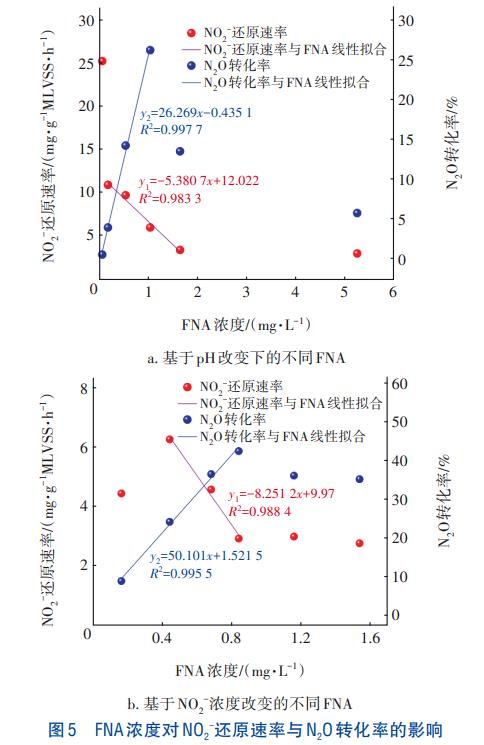
由图5(b)可知,随着FNA浓度的升高,N2O转化率呈现先升后降的趋势。当FNA处于0.44~0.84mg/L区间时,FNA浓度与NO2-还原速率具有线性负相关关系,相关系数为0.9884;当FNA浓度继续增至1.16、1.54mg/L时,NO2-还原速率缓慢降至2.98、2.76mg/(gMLVSS·h),FNA浓度与NO2-还原速率突破原有的线性关系,表明过高的FNA浓度对NO2-还原的抑制作用快速减弱。当初始FNA浓度为0.16mg/L时,NO2-还原速率低于浓度为0.44mg/L时的还原速率6.26mg/(gMLVSS·h),推测原因是初始NO2-基质浓度过低所致。当FNA处于0.16~0.84mg/L区间时,FNA浓度与N2O转化率具有线性正相关关系,相关系数为0.9955,因为FNA抑制NOS活性,导致N2O还原速率下降。当FNA浓度为0.84mg/L时,N2O转化率达到最大值42.56%。当FNA浓度继续增至1.16、1.54mg/L时,N2O转化率降至36.20%、35.29%。
综上所述,基于酸性pH或NO2-浓度改变所得FNA浓度均在一定区间内与N2O转化率具有正相关关系,相关系数分别为0.9977和0.9955,进一步证明了酸性条件下FNA是NOS的主要抑制剂,与现有研究结论相一致。当FNA超过一定浓度或pH低于5.8时,N2O转化率下降,表明过高的FNA浓度及过低的pH不利于N2O的富集。
2.4 pH和FNA对N2O还原速率的影响
pH和FNA对N2O还原速率的影响如图6所示。从图6(a)可以看出,当pH由7.0降至5.5时,N2O的浓度均呈降低趋势。经计算,当pH为7.0和5.5时,N2O的还原速率分别为4.78×10-5和3.58×10-5g/(gMLVSS·min),后者较前者降低了25.1%。由图6(b)可知,随着pH从7.0降至5.5,N2O的还原速率同样逐渐降低,由4.74×10-5g/(gMLVSS·min)降至3.01×10-5g/(gMLVSS·min),降低了36.5%。当加入少量NO2-,即存在FNA时,N2O还原速率均低于无FNA存在时的,当pH为6.0和5.5时尤为显著。通过对比发现,pH和FNA都会抑制N2O还原酶的活性,且存在FNA时,抑制程度增强。而以单一N2O作为基质时,N2O消耗速率受影响较小,当添加了一定量NO2-后,随pH的降低N2O消耗速率大幅下降,因此FNA浓度是NOS活性的主要抑制剂。
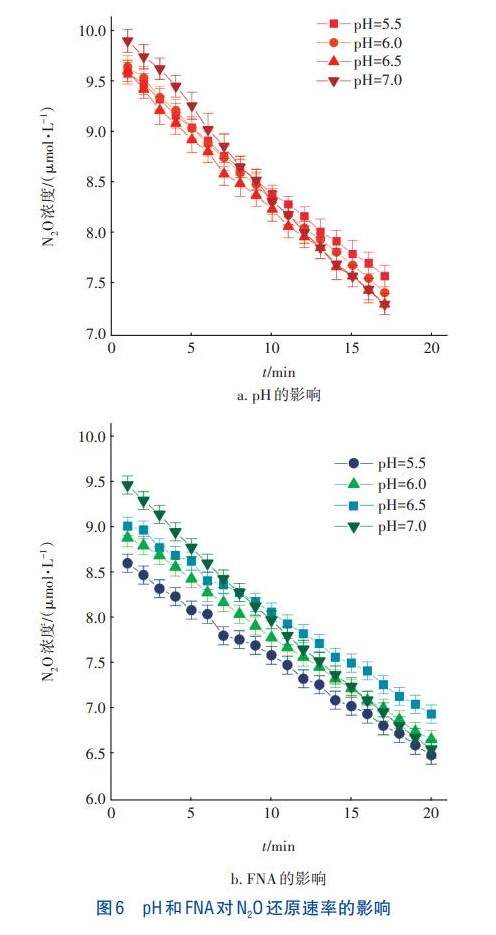
由图3可知,随着pH的降低,N2O转化率和释放量均呈先升高后下降的趋势。由图6(a)可知,以N2O为电子受体时,随着pH的降低,N2O还原速率逐渐下降,因此当pH低于5.8时,N2O释放量降低是pH抑制NOR所致,即过低的pH降低了N2O的产生。Field等发现,N2O合成酶的最适pH为6.0,这与本试验结果一致。同理,FNA浓度对N2O转化率和释放量的影响类似,较高FNA浓度下,N2O释放量降低也是因FNA抑制NOR所致。
3、结论
①利用微电极研究了酸性条件(5.5~7.0)对N2O还原的影响,发现N2O的还原速率随pH的下降及FNA浓度的升高呈降低趋势,且存在FNA时降低幅度增大,表明酸性条件及FNA均可抑制NOS活性,且后者是主要抑制剂。
②NO2-还原速率随pH降低而下降,而N2O转化率先升后降,当pH为5.8时可获得最大转化率,证明过低的pH会抑制NOR活性,导致N2O产量减少。
③在pH为5.8、FNA为0.16~0.84mg/L条件下,N2O转化率与FNA浓度具有正相关关系,而过高的FNA浓度会抑NOR活性,导致N2O产量下降。(来源:中国市政工程华北设计研究总院有限公司西安分公司,西安建筑科技大学环境与市政工程学院,、陕西省膜分离技术研究院陕西省膜分离重点实验室)



